昆明地区多重耐药鲍曼不动杆菌耐药特征及同源性分析
王 佳,曹向红,彭传梅,徐 益,储丹丹,陈秋芳,丁家伟
昆明医科大学附属延安医院/云南心血管病医院检验科,云南昆明 650051
鲍曼不动杆菌曾经被认为是毒力低、致病性弱的病原菌,20世纪70年代以前,大多数抗菌药物对鲍曼不动杆菌治疗有效。近三十年来,临床上各类抗菌药物的滥用、有创治疗技术的开展、激素类药物和免疫功能抑制剂的广泛使用等都使鲍曼不动杆菌在临床上的检出率及耐药率与日俱增[1-3]。据统计,全球每年约有100万人感染鲍曼不动杆菌,这些感染中有一半是由多重耐药鲍曼不动杆菌(MDRAB)引起的[4]。MDRAB对当今几乎所有常用的抗菌药物都表现出耐药,使得可选择的治疗抗菌药物有限,这已成为一个全球问题,并威胁到全世界的医疗保健系统[5]。鲍曼不动杆菌不但耐药机制多样,而且存在严重的感染播散现象。对MDRAB进行基因分型,明确其同源性关系,有利于及时发现MDRAB的暴发流行,追寻传染源和明确传播途径,从而为医院感染控制提供有力的依据。鉴于此,本研究收集了昆明地区两家三甲医院92株非重复MDRAB进行了相关研究,现将结果报道如下。
1 材料与方法
1.1菌株来源 收集2018年1月至 2020年12月昆明医科大学附属延安医院(简称医院甲)、昆明市第一人民医院( 简称医院乙) 临床分离的非重复MDRAB菌株共92株,其中医院甲50株,医院乙42株。
1.2仪器与试剂 微生物培养箱、VITEK2-Compact全自动微生物鉴定仪及其配套试剂、抗菌药物纸片、恒温孵育器、离心机、电子天平、PCR扩增仪、电泳仪、凝胶成像系统,以及Oligo公司的引物、Master Mix、核酸染料、DNA标志物、琼脂糖凝胶、TAE缓冲液。
1.3细菌鉴定及药敏试验 菌株的分离、培养参照《全国临床检验操作规程(第4版)》进行。采用VITEK2-Compact全自动微生物分析仪进行细菌鉴定与药敏试验。其中氨苄西林/舒巴坦、头孢哌酮/舒巴坦、阿米卡星、米诺环素、哌拉西林、哌拉西林/他唑巴坦的药敏试验采用纸片扩散法,其余抗菌药物药敏试验均采用微量肉汤稀释法检测最低抑菌浓度(MIC)。结果判定参照美国临床和实验室标准协会(CLSI)2018、2019、2020年的标准。质控菌株包括大肠埃希菌ATCC25922、铜绿假单胞菌ATCC27853、金黄色葡萄球菌 ATCC25923,均购自国家卫生健康委员会临床检验中心。MDRAB纳入标准为对5类抗假单胞菌抗菌药物(包括头孢菌素类、氨基糖苷类、喹诺酮类、含β-内酰胺酶抑制剂的复合制剂、碳青霉烯类)中的3类或3类以上耐药者,收集菌株于—70 ℃温度条件下保存待用。
1.4常见β-内酰胺酶耐药基因检测
1.4.1DNA模板制备 采用煮沸法制备聚合酶链反应(PCR)模板。将经过VITEK2-Compact全自动微生物鉴定药敏分析系统鉴定后储存于-70 ℃低温冰箱的MDRAB转入血平板,经18~24 h培养后,挑取适量菌落到300 μL蒸馏水中,充分振荡混匀,然后100 ℃水浴15 min,13 000 r/min离心5 min后取上清液作为DNA模板,-20 ℃冰箱保存备用。
1.4.2PCR扩增 反应体系总体积为50 μL,包括Master Mix 25 μL,上游引物1 μL,下游引物1 μL,DNA模板2 μL,蒸馏水21 μL。引物序列及产物长度见表1,参照文献[6-8]设计引物,由北京博迈德基因技术有限公司合成。反应条件:94 ℃预变性5 min,然后94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸60 s,共30个循环,最后72 ℃延伸5 min。

表1 PCR引物序列
1.4.3PCR产物分析 扩增完产物经2%琼脂糖凝胶,110 V电泳30 min,放入凝胶成像系统扫描成像。电泳出现明亮的条带并且该条带与预期产物大小相同者送北京博迈德基因技术有限公司进行测序,测序结果通过NCBI网站Blast比对分析。
1.5菌株同源性分析
1.5.1DNA模板制备 采用煮沸法制备PCR模板,操作同1.4.1。
1.5.2PCR扩增 反应体系:总体积50 μL,包括Master Mix 25 μL,上游引物1 μL,下游引物1 μL,DNA模板2 μL,蒸馏水21 μL。管家基因引物参照鲍曼不动杆菌MLST数据库(http://pubmlst.org/abauniannii/)牛津方案,扩增柠檬酸合酶(gltA)、DNA促旋酶亚基B(gyrB)、葡萄糖脱氢酶B(gdhB)、同源重组因子(recA)、60×103伴侣蛋白(cpn60)、葡萄糖-6-磷酸异构酶(gpi)、RNA聚合酶σ因子(rpoD)7个管家基因,引物名称及序列、产物长度、用途见表2,由北京博迈德基因技术有限公司进行合成。反应条件:94 ℃预变性5 min,然后94 ℃变性30 s ,55 ℃退火30 s,72 ℃延伸60 s,共30个循环,最后72 ℃延伸5 min。

表2 鲍曼不动杆菌管家基因引物序列
1.5.3PCR产物分析 扩增后的PCR产物送北京博迈德基因技术有限公司进行纯化并测序,将测序结果提交到鲍曼不动杆菌MLST数据库中,从而得到每个管家基因的等位基因编号,按照gltA、gyrB、gdhB、recA、cpn60、gpi、rpoD的排列顺序,将其编号输入数据库中,即能获得相应菌株的序列型(ST)。
1.6统计学处理 采用WHONET 5.6软件及Excel表格对菌株信息进行分析,计数资料以例数或百分率表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1药敏试验结果 92株MDRAB对所检测抗菌药物耐药程度均较高,对青霉素类、单环β-内酰胺类、头孢菌素类和碳青霉烯类抗菌药物的耐药率高达100.0%;在含β-内酰胺酶抑制剂的复合药物中,医院甲、乙检出的MDRAB除对头孢哌酮/舒巴坦的耐药率为96.0%、90.5%外,对其余复合药物耐药率均为100.0%;两家医院检出的MDRAB对妥布霉素、复方磺胺甲噁唑、阿米卡星、庆大霉素、左氧氟沙星的耐药率差异较为明显,医院甲检出的MDRAB对上述药物耐药率均在80.0%以上,而医院乙检出的MDRAB耐药率仅为65.0%左右,甚至更低;两家医院检出的MDRAB对米诺环素耐药率差异尤为显著,医院甲耐药率达62.0%,医院乙耐药率仅为7.1%;与之相反的是医院甲检出的MDRAB对替加环素具有很高的敏感性,耐药率为0,医院乙检出的MDRAB耐药率达到14.3%。见表3。
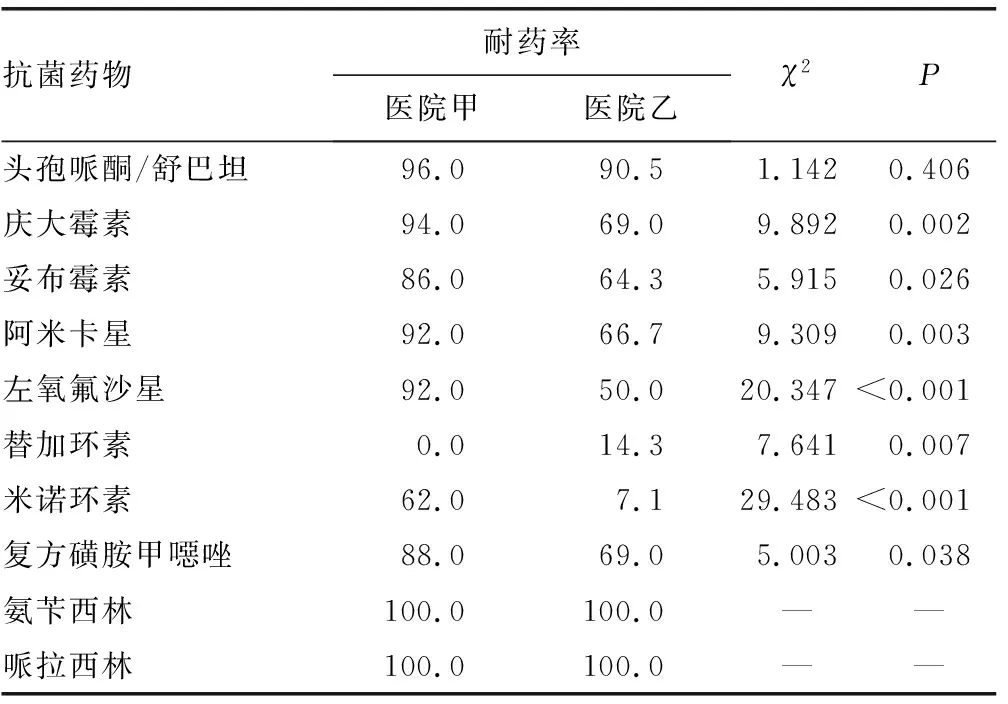
表3 不同医院检出MDRAB对常见抗菌药物的耐药率比较(%)
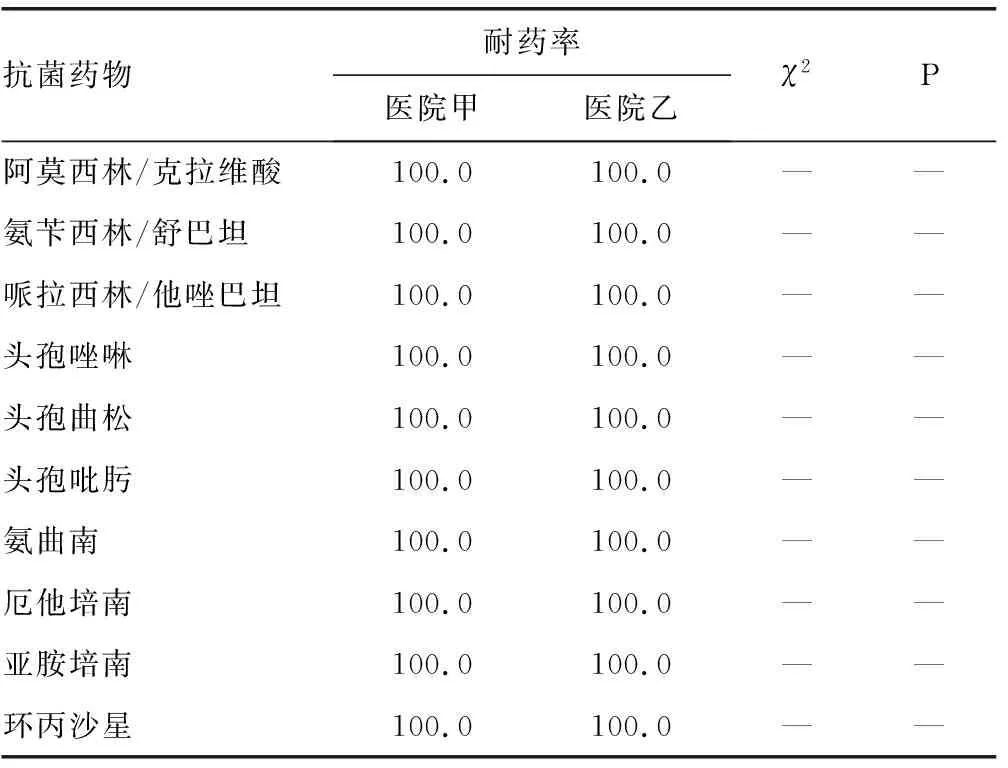
续表3 不同医院检出MDRAB对常见抗菌药物的耐药率比较(%)
2.2耐药基因检测结果 92株MDRAB β-内酰胺酶耐药基因分布如下:88株携带OXA-23基因,占95.7%(88/92);77株携带ADC基因,占83.7%(77/92);70株携带TEM基因,占76.1%(70/92);其余基因检测均为阴性。携带ADC+OXA-23基因的菌株占81.5%(75/92),携带TEM+OXA-23基因的占73.9%(68/92),携带TEM+ADC基因的占60.8%(56/92),携带TEM+ADC+OXA-23基因的占59.8%(55/92)。见表4。
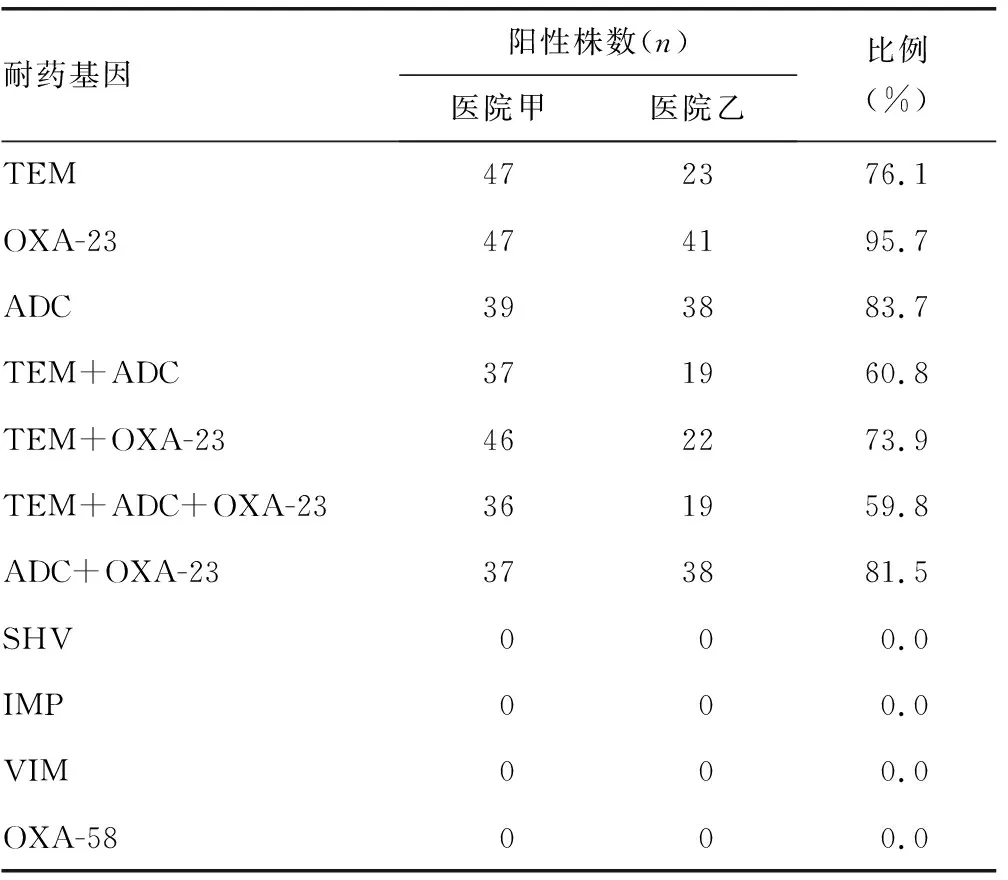
表4 92株MDRAB β-内酰胺酶耐药基因检测结果
2.3同源性结果分析 将92株MDRAB各管家基因测序结果提交到鲍曼不动杆菌MLST数据库进行比对,共分为12个ST,主要型别包括ST208型、ST368型、ST1145型、ST195型和ST191型,检测到的其他分型还包括ST540型、ST159型、ST369型、ST1696型、ST136型、ST1646型、ST1353型。有3株细菌有新的等位基因位点,但鲍曼不动杆菌MLST数据库尚未匹配,见表5。对两家医院MDRAB菌株ST型别进行对比分析,结果显示两家医院的优势型别各不相同:医院甲以ST208为主要型别,占58.0%(29/50);其次为ST1145型,占24.0%(12/50);再次为ST159型,占6.0%(3/50)。医院乙以ST368为主要型别,占31.0%(13/42);其次为ST195型,占21.4%(9/42);再次为ST208型,占19.0%(8/42)。两家医院存在共同型别为ST208和ST540型,其余型别均不同。见表5、图1。
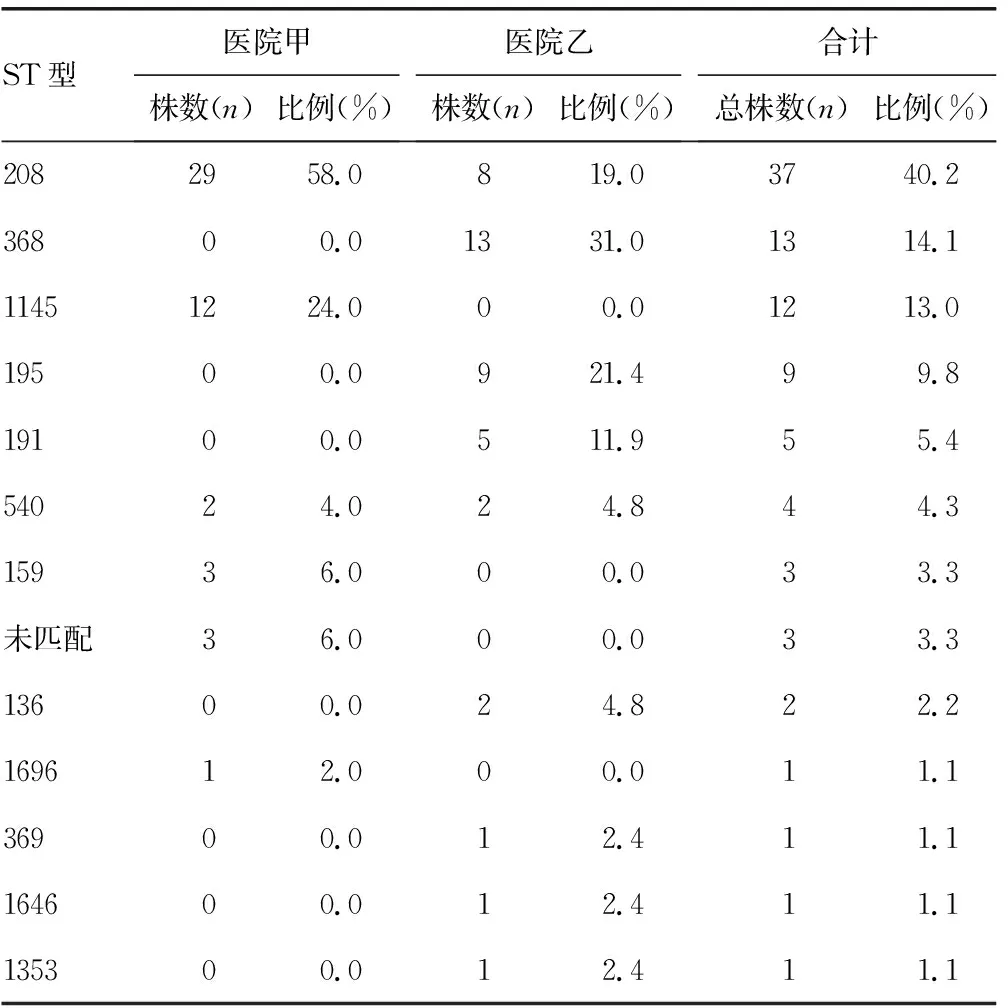
表5 MDRAB多位点序列分型结果
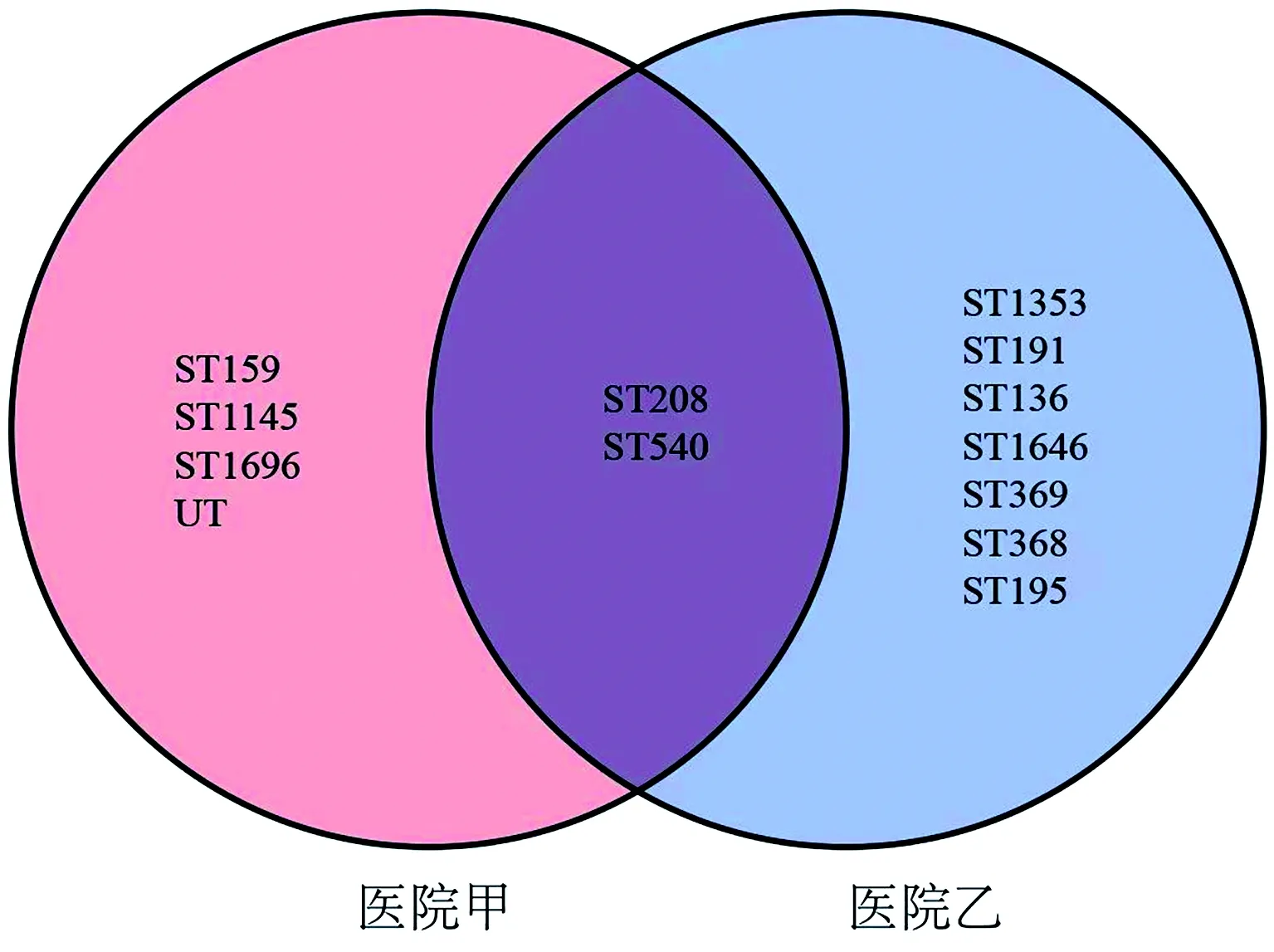
注:UT为鲍曼不动杆菌MLST数据库尚未匹配ST。
3 讨 论
MDRAB由于其扩展的耐药基因组可逃避宿主的免疫效应,能够在生物膜中生长,在极端环境条件下生存,并以最小的代谢率转向潜在的生长形式,治疗可选择的抗菌药物有限等,使其成为耐药较严重的病原体之一[6]。根据中国细菌耐药监测网公布的数据显示,中国常见革兰阴性菌对碳青霉烯类等抗菌药物耐药情况非常突出,而MDRAB表现更为明显[7]。本研究分离的92株MDRAB中,对青霉素类、头孢菌素类及碳青霉烯类抗菌药物的耐药率高达100.0%,对庆大霉素、妥布霉素、左氧氟沙星、复方磺胺甲噁唑、阿米卡星的耐药率均大于或等于50.0%,仅对替加环素保持较高敏感率。虽然两家医院MDRAB均存在高耐药现象,但是对某些类别抗菌药物的耐药性不尽相同,如:医院甲检出的MDRAB对米诺环素耐药率达62.0%,而医院乙检出的MDRAB耐药率仅为7.1%;医院甲检出的MDRAB对替加环素具有很高的敏感性,耐药率为0,医院乙检出的MDRAB耐药率达到14.3%。推测上述耐药性差异是由于本地区不同医院常使用的抗菌药物存在差异所导致。
MDRAB对不同抗菌药物的耐药性由不同的耐药机制介导:产生水解酶,膜通透性降低,外膜蛋白改变、缺失及主动外排系统过表达均可以导致细菌多重耐药。MDRAB在内源性基因突变和高水平基因组可塑性的双重影响下,细菌菌体表面外排泵表达过度,能够排出如庆大霉素、卡那霉素、氯霉素、红霉素、喹诺酮类等抗菌药物,尤其是外排泵RND系统中的AdeABC泵,在MDRAB对氨基糖苷类药物的耐药机制中发挥重要作用,加之生物膜保护作用,抗菌药物无法进入鲍曼不动杆菌的菌体内,使得MDRAB逃避了抗菌药物的杀灭作用,继而对多种抗菌药物均耐药[8]。目前,研究得较多、较透彻的是鲍曼不动杆菌对临床常用的β-内酰胺类抗菌药物敏感性下降的机制。鲍曼不动杆菌的β-内酰胺酶按照Ambler分类分为A、B、C和D 4种分子类型[9]:A类酶为超广谱β-内酰胺酶(ESBL),主要包括SHV、TEM、CTX-M、PER和GES等型[10-12];B类酶又称为金属β-内酰胺酶(MBL),因其催化活性需要锌离子等金属离子而得名[13];C类酶为头孢菌素酶(AmpC酶),可由染色体和质粒介导,产此类酶鲍曼不动杆菌对头霉素类、单环类和第1~3代头孢菌素类抗菌药物耐药且不被β-内酰胺酶抑制剂所抑制[14];D类酶又叫苯唑西林酶(OXA酶),属于弱的碳青霉烯类水解酶,但当其上游携带强启动子的ISAba1等可移动元件过度表达时,可导致产此类酶鲍曼不动杆菌对碳青霉烯类抗菌药物的耐药。MDRAB对碳青霉烯类抗菌药物耐药机制中,产生β-内酰胺类水解酶为其最普遍的机制,为进一步分析两家医院MDRAB对碳青霉烯类抗菌药物的耐药机制,本研究选取7种常见β-内酰胺酶耐药基因(SHV、TEM、IMP、VIM、ADC、OXA-23、OXA-58)进行检测,结果显示OXA-23、ADC、TEM基因为MDRAB主要携带的耐药基因,分别有95.7%、83.7%、76.1%的菌株检出,而SHV、IMP、VIM、OXA-58基因均未检出。本研究中,MDRAB对青霉素类、头孢菌素类和碳青霉烯类抗菌药物均表现出极高的耐药率,与TEM、ADC、OXA-23基因的高检出率相符,表明MDRAB对β-内酰胺类抗菌药物高耐药的产生与菌株携带TEM、ADC、OXA-23基因密切相关。医院甲携带耐药基因以TEM、OXA-23为主,而医院乙携带耐药基因则以OXA-23、ADC为主,两家医院携带耐药基因的差异,有可能是导致两家医院分离的MDRAB耐药率不同的主要原因。从上述结果来看,医院甲对氨基糖苷类、喹诺酮类抗菌药物(除环丙沙星)耐药率相对医院乙总体偏高,推测是由于各医院的治疗手段、消毒措施、环境等各不相同,暴露的感染危险因素也不尽相同,致使细菌面临的选择性压力不同,导致菌株的耐药性出现差异。此外,医院甲的MDRAB是否具备其他耐药机制,如膜蛋白的改变及外排泵的过度表达等,值得以后的研究继续对其进行进一步探讨。
MDRAB作为一种院内感染条件性致病菌,在其生存过程中,保持遗传性的同时不断发生变异,携带各种耐药基因的多重耐药和泛耐药菌株克隆传播是造成世界各地医院暴发流行的原因。本研究对选取的92株MDRAB进行同源性分析,结果显示92株MDRAB包括ST208、ST368、ST1145、ST195、ST191、ST540、ST159、ST369、ST1696、ST136、ST1646、ST1353型共12个型别,其中ST208型包含37株,占40.2%,其次是ST368型,共检出13株,占14.1%。分别对两家医院菌株进行同源性分析,发现两家医院的主要型别并不一致。医院甲以ST208型为主要型别,占58.0%;医院乙则以ST368型为主要型别,占31.0%,这说明两家医院在各自医院不同科室可能存在克隆传播现象,但是目前未发生明显的医院间MDRAB菌株克隆传播。虽然医院乙ST208型所占比例仅为19.0%,不是该医院MDRAB菌株的主要型别,但仍然需要警惕未来同一地区不同医院间的ST208克隆株流行传播的可能。

