艾司氯胺酮减轻HT22细胞炎症损伤及铁死亡相关机制
王京燕,丁 慧,钟薇薇,鲁显福,黄 艳,李元海,
(安徽医科大学 1.附属巢湖医院麻醉科,安徽 巢湖 238000,2.第一附属医院麻醉科、3.药学院,安徽 合肥 230032)
神经炎症[1]可导致神经元损伤、退化和活性氧增多,这可能是神经系统疾病,如帕金森病、亨廷顿舞蹈症和阿尔茨海默病的重要病因。随着预期寿命的增加,接受手术和麻醉的老年患者越来越多。手术创伤引起的全身炎症反应导致围手术期神经认知障碍现象的发展[2]。由于影响因素众多,大多数研究集中于手术和麻醉的综合作用上。麻醉药物作为中枢神经系统调节剂,与记忆学习密切相关,由于结果相互矛盾,不确定性仍然存在。
铁死亡[3]是一种新型的程序性非凋亡细胞死亡模式。这种新发现的细胞死亡方式主要是在二价铁离子或酶机制[4]的作用下,催化细胞膜上不饱和脂肪酸的高表达,脂质体过氧化,从而诱导细胞死亡。在由炎症引起的神经系统退行性疾病中,可以检测到活性氧堆积、脂质过氧化、铁代谢紊乱等与铁死亡密切相关的指标。铁死亡被证实在肿瘤抑制和器官损伤中发挥重要作用[5]。并且研究进一步发现,由铁死亡引起的损伤相关分子模式导致的一系列损伤会促进炎症因子释放从而加重神经系统疾病的发展[6]。
氯胺酮主要作用是治疗难治性疼痛、抑郁症和药物诱导的痛觉过敏[7]。新近研究表明,氯胺酮可以逆转帕金森病动物模型中的短期记忆障碍[8],临床病例中亚麻醉剂量氯胺酮输注会导致左旋多巴引起的运动障碍减少和改善[9]。ESK是氯胺酮更有效的S-异构体。除了良好的镇静镇痛作用外,ESK的神经毒性更低,可以明显减少皮质神经元细胞的损伤,减轻脑缺血后的损伤和后遗症[10]。ESK这些愈发突出的神经保护作用促使我们探讨ESK的保护作用机制可能与其抗炎特性有关。然而,ESK抵抗炎症相关的信号通路和分子机制仍有待确定。众多研究证实,铁死亡和炎症密切相关,因此,本文主要探索ESK对铁死亡机制的影响。
HMGB1是机体中高度保守的核蛋白,在细胞受到外界刺激和损伤后,由免疫细胞主动分泌或者被动释放到细胞外促进炎症[11]。据报道,HMGB1通过RAS-JNK / p38途径成为铁死亡的新靶点[12]。本研究采用HT22细胞来考察ESK对神经细胞炎症的影响,探讨铁死亡以及HMGB1-MAPK途径相关机制,期望为临床合理用药提供理论依据。
1 材料与方法
1.1 材料
1.1.1细胞与试剂 小鼠海马神经元细胞系HT22细胞(武汉普诺赛生物科技有限公司,CL-0697);胎牛血清(以色列Biological Industries公司,C04001-050);LPS(美国Sigma公司,L4391);DMEM高糖培养基(武汉塞维尔生物科技有限公司,G4510);0.25%胰酶消化液(碧云天生物技术研究所,C0201);细胞增殖-毒性检测试剂盒(迈克生物,BL001B);MDA试剂盒(碧云天生物技术有限公司,S0131S);β-actin、TFR1、Ferritin、HMGB1抗体(美国Abcam公司,ab8227、ab214039、ab75973、ab18256);ACSL4、PTGS2、p-JNK、p-P38、p-ERK1/2抗体(武汉爱博泰克生物科技有限公司,A6826、A1253、AP0631、AP1165、AP0485);FPN抗体(北京博奥森生物技术有限公司,bs-4906R);IL-1β、TNF-α ELISA试剂盒(武汉易瑞莱特生物科技有限公司,E-EL-M0037c、E-EL-M3063);DHE荧光探针(上海翌圣生物科技有限公司,50102ES02);FITC标记山羊抗兔抗体(武汉爱博泰克生物科技有限公司,AS014);ECL发光试剂盒(上海雅酶生物医药科技有限公司,SQ101);FerroOrange荧光探针(日本dojindo公司,F374);盐酸艾司氯胺酮注射液(江苏恒瑞医药股份有限公司,200219BL)。
1.1.2仪器 荧光显微镜(德国Leica公司);细胞培养箱、透射电镜(美国Thermo公司);酶标仪(德国Tecan公司);离心机(德国Beckman公司);蛋白电泳仪、化学发光成像系统(美国Bio-Rad公司);激光共聚焦显微镜(德国Zeiss公司)。
1.2 方法
1.2.1细胞分组 HT22细胞随机分为4组:① 对照组(Con组):HT22细胞置于DMEM/F12完全培养基中常规培养;② 脂多糖处理组(LPS组):使用终浓度10 mg·L-1的LPS处理HT22细胞24 h;③ 艾司氯胺酮+脂多糖组(ESK+LPS组):使用终浓度1 μmol·L-1的艾司氯胺酮预处理2 h后,使用终浓度10 mg·L-1脂多糖处理24 h;④Ferrostain-1+脂多糖组(Fer-1+LPS组):使用终浓度2 μmol·L-1的铁死亡抑制剂(Ferrostatin-1,Fer-1)预处理2 h后,使用终浓度10 mg·L-1脂多糖处理24 h。
1.2.2CCK-8评估HT22细胞生存能力 HT22细胞按照密度5×103个/孔接种在96孔板上常规培养,取生长状态良好的HT22细胞,每孔加入100 μL,培养12 h后,加入不同浓度的LPS(终浓度为1、5、10 mg·L-1),另设对照组(Con:等量含有细胞的培养基和CCK-8溶液)和空白孔(等量不含细胞的培养基和CCK-8溶液),每孔设6~8个复孔。按照实验设计方案进行加药和预处理,孵育结束后每孔加入10 μL CCK-8溶液(现配现用)。继续孵育1 h后,使用酶标仪测定450 nm波长处各孔的光密度(optical density,OD值)并记录实验结果,计算各实验孔相对存活率。计算公式为细胞相对存活率/%=(A实验组-A空白组)/(A对照组-A空白组)×100%。
1.2.3细胞内活性氧检测 HT22细胞按照密度1×104个/孔接种在12孔板上常规培养,按照“1.2.1”方法分组处理细胞,加入LPS 10 mg·L-1孵育24 h后,使PBS洗涤两遍。以终浓度为10 μmol·L-1DHE荧光染料和加入PBS中,孵育30 min后,将5 mg·L-1Hoechst 33342染料加入PBS中,继续孵育5 min,然后立即上机,荧光显微镜下采集图像拍照。通过ImageJ计算红色荧光强度,比较不同组的荧光强度。
1.2.4免疫荧光检测脂质氧化产物丙二醛(malondialdehyde,MDA)生成 HT22细胞按照密度1×104个/孔接种在12孔板上常规培养,按照“1.2.1”处理HT22细胞,加入10 mg·L-1LPS孵育24 h后进行脂质过氧化测定,测定试剂盒进行MDA测定。通过BCA蛋白测定确定样品中的蛋白质浓度。MDA是经典的脂质过氧化产物,当MDA与试剂盒的硫代巴比妥酸反应会螯合成复合物。复合物通过比色法定量,OD532 nm处测得。
1.2.5FerroOrange荧光探针检测细胞内Fe2+变化 将HT22细胞以1×104个/孔密度接种于共聚焦专用培养皿,按照“1.2.1”方法分组处理细胞,加入10 mg·L-1LPS孵育24 h后,为了检测细胞内 Fe2+,我们使用了 FerroOrange荧光探针。将细胞用无血清DMEM洗涤3次,然后在5%CO2培养箱中与1 μmol·L-1FerroOrange 工作溶液在37 ℃下孵育30 min,使用共聚焦激光扫描显微镜获取图像。使用ImageJ确定平均绿色荧光强度。将每组的平均荧光强度标准化为对照组的平均荧光强度。
1.2.6Western blot 检测蛋白表达 HT22细胞以1×105个/孔接种于6孔板,按照“1.2.1”方法分组处理细胞,加入10 mg·L-1LPS孵育24 h后,制取样品,弃去培养基,使用PBS冲洗3遍,加入含有蛋白酶抑制剂(PMSF)的高效RIPA裂解液(组织/细胞),冰上裂解10~30 min,用细胞刮刮下,转移至1.5 mL EP管中,4 ℃,12 000 r·min-1,30 min离心。取上清至另一批1.5 mL EP管,用BCA蛋白定量试剂盒检测蛋白浓度。加蛋白上样缓冲液(上清 ∶缓冲液=4 ∶1),涡旋离心,再在100°水浴锅中煮10 min变性。以每孔10 μL蛋白样品量进行蛋白电泳后,使用200 mA恒流转膜,转膜时间为蛋白分子量 ±10 min。再使用5%的脱脂奶粉+100 mL TBST溶液,封闭于室温1~3 h。封闭完成后,使用TBST置于摇床洗涤3遍,每遍10 min。孵育的一抗(抗体 ∶一抗稀释液=2 μL ∶2 mL)于4 ℃过夜,d 2用TBST在室温下洗涤3遍,每遍15 min。然后将洗涤结束的PVDF膜置于HRP标记的二抗(每格中两张用10 mL牛奶 + 1 μL二抗)中室温孵育1 h,置于TBST洗涤3遍,每遍15 min。使用ECL发光试剂盒显影,以β-actin作为内参。
1.2.7透射电镜观察HT22线粒体超微结构的改变 HT22细胞按照密度1×105个/孔接种在6孔板上常规培养,按照分组处理细胞,加入10 mg·L-1LPS孵育24 h后,弃去培养基,采用胰蛋白酶消化或用细胞刮刮下细胞收集于1 mL PBS中,1 000 r·min-1,10 min。重复PBS洗涤,再离心1 000 r·min-1,10 min。离心完毕后弃去培养液,沿管壁缓慢倒入0.5~1 mL 2.5%戊二醛固定液。然后送去安徽医科大学科研实验中心进行制样,最终在透射电子显微镜下检查。

2 结果
2.1 LPS促进HT22细胞中的铁死亡为了评估LPS刺激对铁死亡的影响,HT22细胞用不同浓度的LPS(1、5、10 mg·L-1)处理24 h,用CCK-8检测细胞活性,结果Fig 1A显示:LPS可以剂量依赖性降低细胞活力(P<0.01)。与此同时,检测脂质过氧化、ROS和Fe2+的水平。如Fig 1B~F所示,与对照组相比,LPS组呈剂量依赖性升高脂质过氧化、ROS和Fe2+水平(P<0.01),Fig 2G~H中PTGS2和ACSL4水平的蛋白表达也随着LPS浓度的升高而提高(P<0.01)。
2.2 ESK减轻LPS诱导的HT22细胞的损伤ESK的化学式如图所示(Fig 2A)。将不同浓度(0.01、0.1、1、10 、50和 100 μmol·L-1)的ESK应用于HT22细胞后,通过 CCK-8法测量细胞活力。结果显示(Fig 2B),在0.01~50 μmol·L-1该浓度范围内细胞活力不受影响。提示ESK在0.01~50 μmol·L-1剂量范围内对HT22细胞无明显毒性作用。因此,在加入LPS 10 mg·L-1孵育HT22细胞前按照浓度梯度增加ESK(0.01、0.1、1、10 、50 μmol·L-1)预处理2 h。由Fig 2C显示:1 μmol·L-1ESK明显降低LPS诱导的神经毒性(P<0.01)。但在50 μmol·L-1的高浓度下,ESK的保护作用明显降低。因此后续实验我们选择1 μmol·L-1浓度的ESK处理细胞。
2.3 ESK 减轻 LPS 诱导的 HT22 细胞的炎症利用ELISA检测到HT22细胞中LPS处理后相关炎症细胞因子 TNF-α和IL-1β的表达(Fig 3),结果显示:对照组分别为(23.75±5.241) μg·L-1和(16.58±1.669) μg·L-1。LPS处理后,LPS组中TNF-α和IL-1β水平分别升高为(108.9±9.961) μg·L-1(P<0.01)、(54.60±3.049) μg·L-1(P<0.01)。而1 μmol·L-1ESK预处理可明显降低LPS诱导的HT22神经细胞中TNF-α和IL-1β表达(P<0.01)。
2.4 ESK减轻LPS诱导的HT22细胞的脂质过氧化和氧化应激通过DHE探针和MDA试剂盒测量细胞内ROS和脂质氧化水平。观察到在LPS处理后,HT22细胞中的ROS红色荧光强度和脂质过氧化浓度明显增加(P<0.01)。Fig 4A~C显示,用1 μmol·L-1ESK处理后明显降低细胞内ROS和脂质过氧化的表达(P<0.01)。在Fig 4D~E中,检测到LPS组铁死亡相关标志性蛋白ACSL4、PTGS2的表达明显升高(P<0.01)。ESK明显降低ACSL4、PTGS2蛋白的表达(P<0.01),这表明ESK的保护作用与ACSL4、PTGS2密切相关。与此同时,与LPS组相比,Fer-1+LPS组中的ACSL4、PTGS2的蛋白水平也被Fer-1明显减轻(P<0.01)。
2.5 ESK调节LPS诱导的HT22细胞内二价铁离子含量和铁稳态研究表明,LPS在体内外诱导铁超载,在本研究中利用FerroOrange荧光探针对HT22中的二价铁离子进行检测。Fig 5C,D显示LPS处理组细胞内二价铁离子含量明显上升(P<0.01),而ESK阻止了二价铁离子含量的增加(P<0.01)。此外,进一步探索ESK在铁稳态中的作用。如图所示(Fig 5A,B),利用蛋白印迹方法检测到ESK明显降低了LPS诱导的HT22细胞中TFR1、FPN水平的升高和铁蛋白降解(P<0.05,P<0.01,P<0.05)。与此同时,与LPS组相比,Fer-1+LPS组中的二价铁离子水平、TFR1、FPN蛋白表达明显降低(P<0.01),铁蛋白降解也减少(P<0.01)。

Fig 1 LPS promoted ferroptosis in HT22 cells n=3)
2.6 ESK可改善LPS诱导的HT22细胞线粒体改变线粒体的形态变化是铁死亡最具代表性的特征。电子显微镜检查(Fig 6)显示,在LPS处理的HT22细胞中,线粒体变小,线粒体嵴融合或消失。
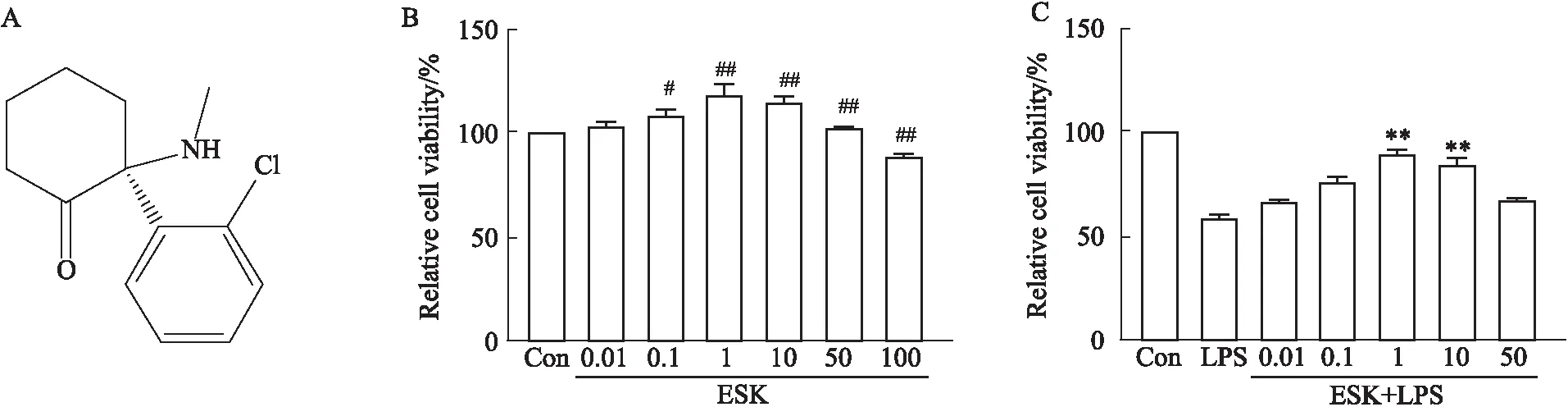
Fig 2 ESK mitigated damage to LPS-induced HT22 cells n=3)
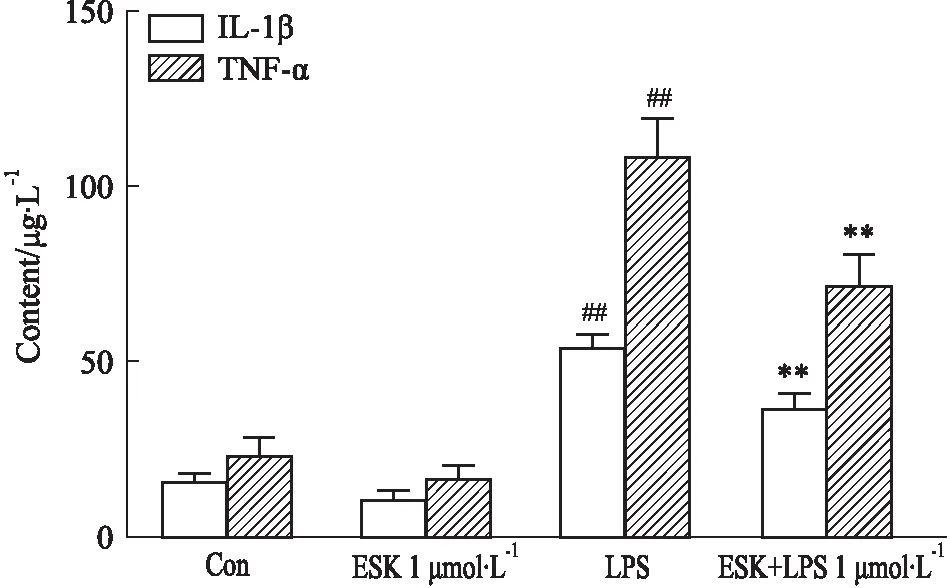
Fig 3 ESK attenuated LPS-induced inflammation in HT22 cells n=3)
ESK可改善线粒体嵴状态,使其肿胀减少。Fer-1作为铁死亡特异性抑制剂,对线粒体的损伤也有所缓解。
2.7 ESK可减轻LPS诱导的HT22细胞HMGB1-MAPK通路的激活如Fig 7所示,LPS刺激可明显促进HT22细胞中HMGB1、p-ERK、p-P38、p-JNK的表达上调(P均<0.01),而ESK预处理可降低HT22细胞中HMGB1、p-ERK、p-P38、p-JNK的表达(P均<0.05)。
3 讨论
本研究主要探讨了艾司氯胺酮对LPS诱导的HT22细胞损伤的抗铁死亡和抗炎作用。我们证明ESK可减轻细胞活力、炎症、氧化应激和脂质过氧化,同时降低铁代谢重要调节因子TFR1、FPN蛋白水平以及减轻铁蛋白的降解。此外,结果表明,HMGB1在LPS诱导的HT22炎症中高表达,ESK下调HMGB1并减轻MAPK通路的激活。
神经元是神经系统基本结构组成,神经元和胶质细胞的炎症和氧化应激是神经退行性疾病的关键调节因子。过度激活的神经胶质细胞对神经炎症和神经退行性疾病的贡献已得到充分证明[12],但关于海马神经元的作用和炎症过程中影响神经元功能的因素的研究比较局限[5]。以前的研究表明,单次小鼠海马内注射LPS导致小胶质细胞活化与阿尔茨海默症中淀粉样蛋白轴突病变和树突变性[13]。本研究使用HT22细胞作为神经元细胞模型来观察ESK对LPS诱导的神经炎症的保护作用。我们发现,给予ESK处理可以有效抑制LPS诱导HT22细胞中炎症因子 TNF-α和IL-1β的表达[14]。这与氯胺酮在各种疾病如疼痛、抑郁症、神经退行性疾病和急性神经系统损伤的抗炎作用研究一致。
前期课题组研究发现HT22细胞是铁死亡敏感性细胞系,铁死亡在谷氨酸诱导的HT22细胞毒性中具有重要意义。但在HT22细胞上关于炎症和铁死亡的关系尚不清楚,因此本研究探讨了HT22细胞中铁死亡和炎症的关系。与凋亡和自噬不同,铁代谢紊乱是铁死亡的基本因素。铁代谢的最基本组成部分是铁流入、铁储存、铁输出,分别由关键性把控因子TFR1、铁蛋白、FPN组成[15]。二价铁通过芬顿反应加剧ROS积累和铁死亡。更重要的是,铁螯合剂、铁死亡抑制剂Fer-1和Lip-1(Liproxstatin-1,Lip-1)等抑铁因素可以改善神经系统的炎症[16]。这项研究中,我们发现铁死亡标志性蛋白ACSL4和PTGS2 表达水平在 LPS 诱导的模型中随着LPS浓度的增加而升高,并且LPS呈剂量依赖性(1、5、10 mg·L-1)促进HT22细胞中的ROS、脂质过氧化和Fe2+的水平,这表明在 LPS 诱导的HT22细胞中发生了铁死亡,并且LPS可以促进铁死亡的发展。因此,我们在10 mg·L-1LPS诱导的模型中进行后续实验,通过CCK-8确定合适的ESK浓度为1 μmol·L-1,与LPS组相比,1 μmol·L-1ESK可以显着降低ROS、脂质过氧化和Fe2+水平;此外ESK可以明显降低ACSL4、PTGS2水平以及改善铁代谢相关指标,包括TFR1、FPN蛋白水平的降低和铁蛋白降解的减少。并且在线粒体中,研究发现LPS组线粒体嵴明显肿胀、外膜破裂、部分线粒体膜密度增加。而ESK处理减轻了LPS导致的线粒体损伤。为了确定铁死亡在其中的作用,我们引入了Fer-1作为阳性对照组,发现ESK的保护作用与Fer-1的保护作用一致。以上结果说明,ESK确实可以通过抑制HT22细胞铁死亡,从而减轻LPS诱导的损伤。
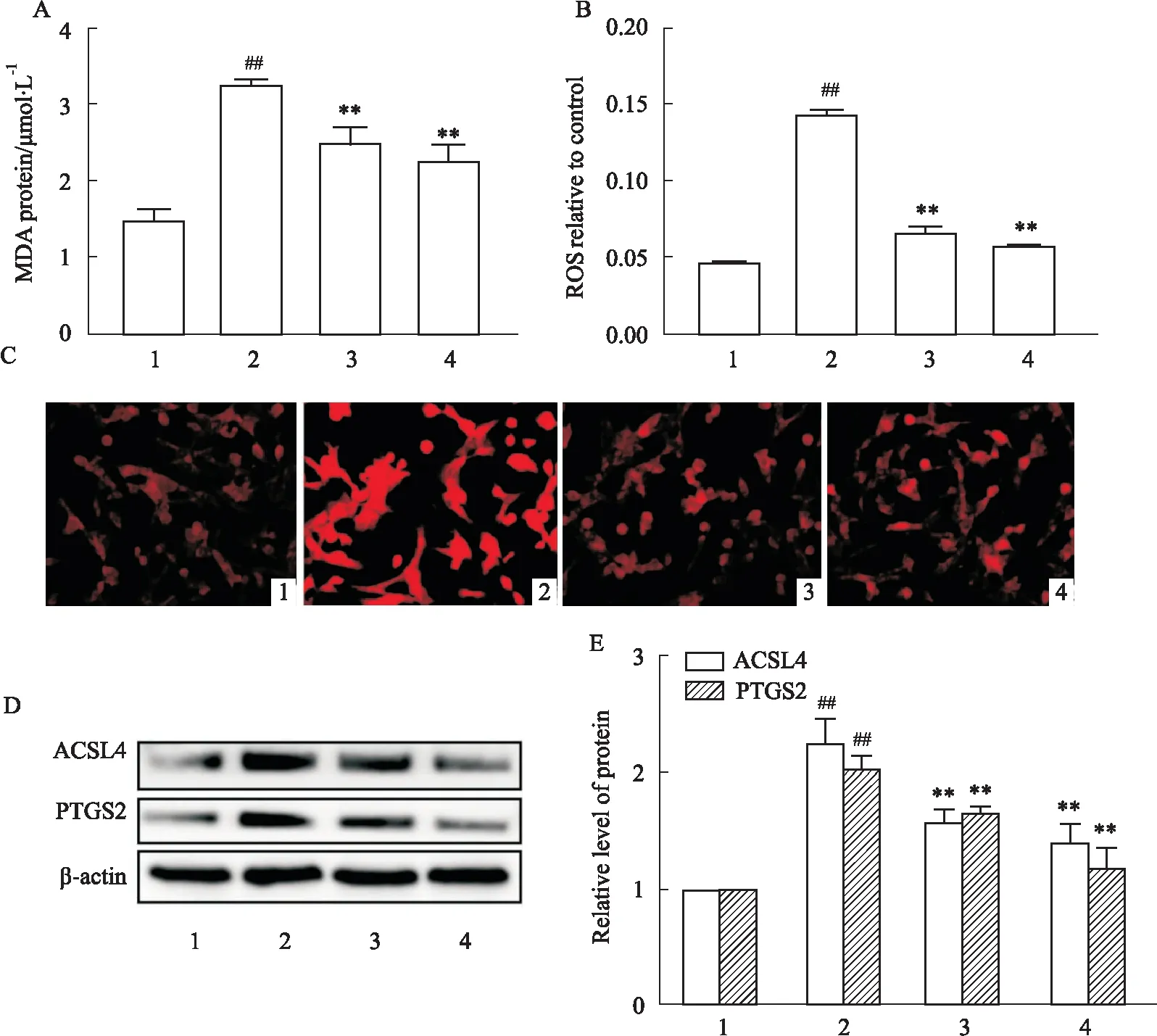
Fig 4 ESK inhibited production of ROS and lipid peroxidation in LPS-induced HT22 cells n=3)
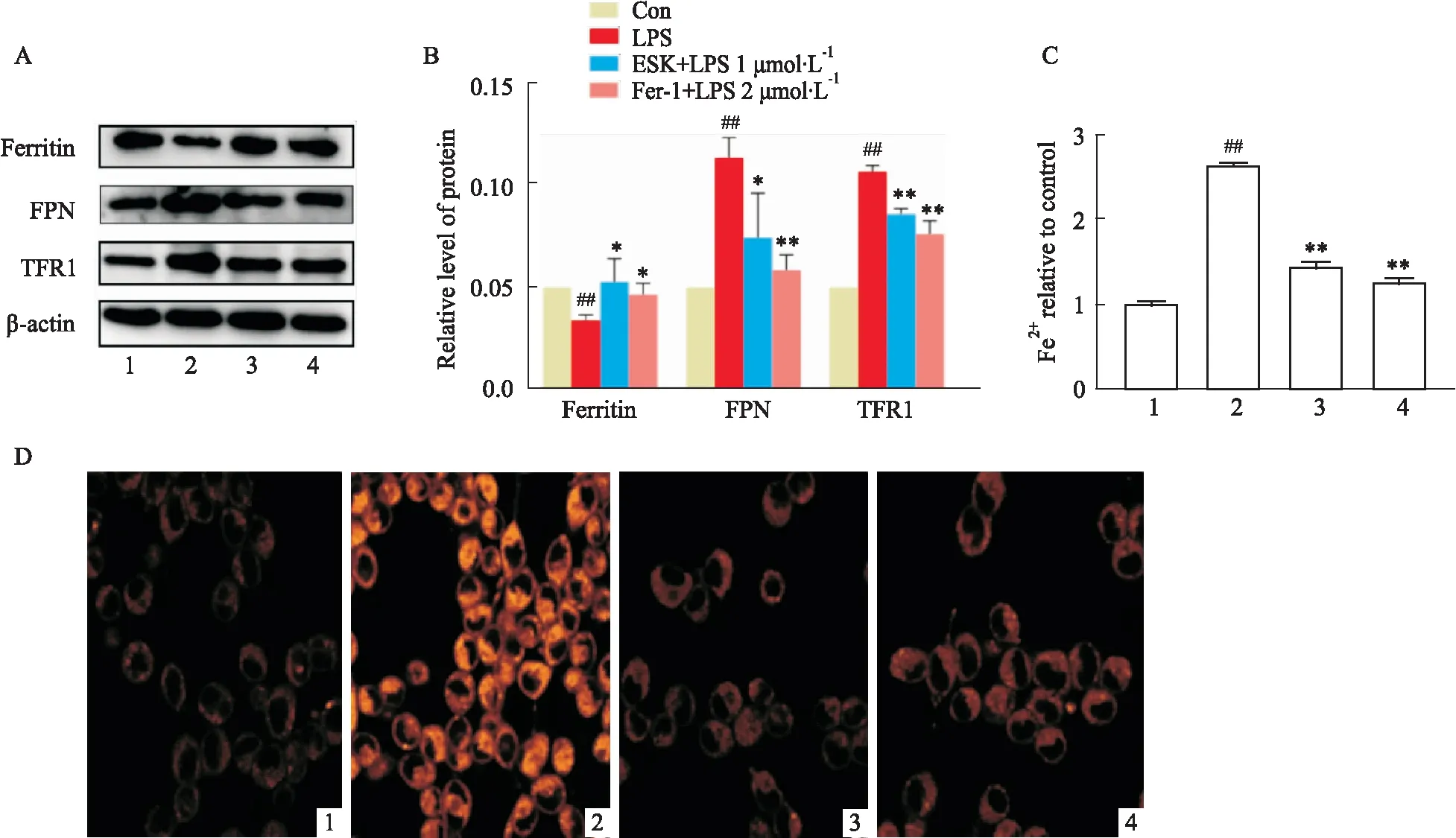
Fig 5 ESK regulated total intracellular iron content and iron homeostasis in LPS-induced HT22 cells n=3)
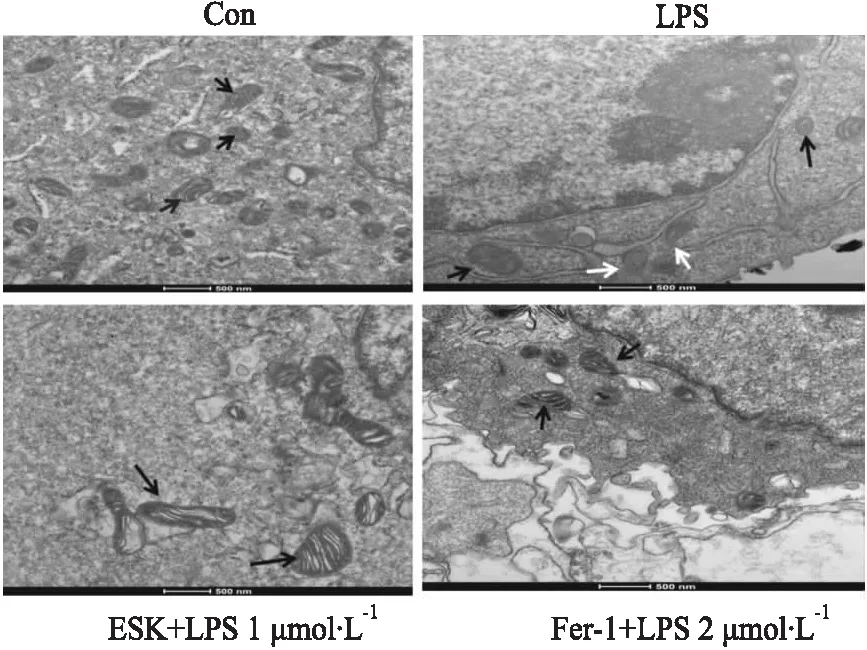
Fig 6 ESK ameliorated LPS-induced mitochondrial changes in HT22 cells
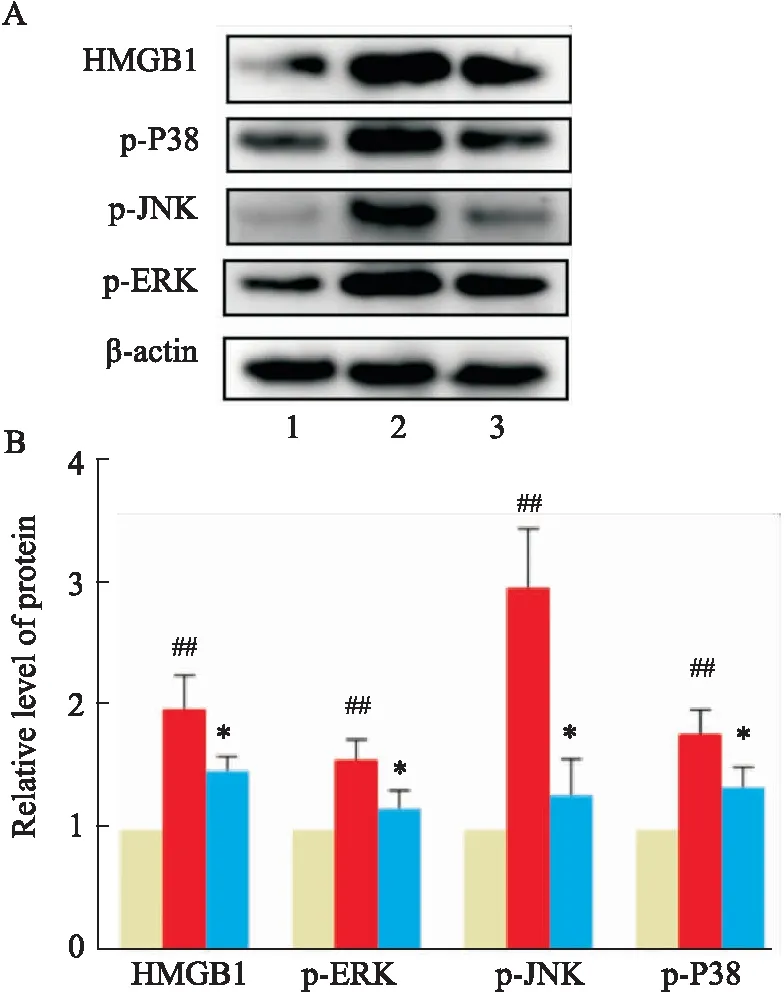
Fig 7 ESK attenuated activation of HMB1-MAPK pathway in LPS-induced HT22 cells n=3)
我们进一步研究了ESK在LPS诱导的损伤中起作用的潜在机制。HMGB1是铁死亡重要调节因子,细胞外HMGB1在RSL3和Erastin诱导的铁死亡期间触发炎症和免疫反应[12]。MAPK通路是经典的下游效应通路,也是氯胺酮非竞争性N-甲基-D天冬氨酸受体(N-methyl-D-aspartate receptor ,NMDAR)的下游。HMGB1-MAPK通路平行于NMDAR通路,其抗炎作用依赖于Toll样受体4(Toll-like receptors 4,TLR4),HMGB1作为LPS转移分子发挥作用,与LPS协同工作通过TLR4触发炎症反应。因此我们监测了HT22细胞中HMGB1-MAPK通路的表达情况,我们发现LPS 诱导的 HT22 细胞中HMGB1、p-ERK、p-P38、p-JNK蛋白水平的增加,ESK预处理可以降低其水平。这些结果表明,ESK的保护作用与 HMGB1-MAPK通路密切相关。
本实验认为,HMGB1在ESK抑制LPS损伤中起着关键的作用,但缺乏HMGB1敲低后ESK对HT22细胞的保护作用的深入研究。考虑到坏死性凋亡,焦亡和自噬也具有促炎作用。因此,我们很难评估和区分不同细胞死亡模式的贡献及其作用顺序,这就要求我们建立更具体的体内模型,深入分析它们对LPS诱导的炎症的影响,从而为神经系统疾病提供更精确的靶标。其次本研究使用的盐酸艾司氯胺酮注射溶液是商品试剂,其溶媒是盐酸盐,对细胞实验有一定的影响。综上所述,我们的实验发现,铁死亡在LPS诱导HT22细胞的炎症中起着关键作用,ESK可能通过抑制HMGB1-MAPK信号通路在HT22细胞中表现出抗炎和抗铁死亡作用。这拓宽了ESK在神经系统疾病中的应用,并且为治疗神经系统疾病提供了更丰富有力的证据。
(致谢:本实验在安徽医科大学药学院抗炎免疫药物教育部重点实验室完成,感谢各位老师和同学的帮助。)