多糖对炎症性疾病及肠道菌群调控作用的研究进展
黄宇哲,吴前震,许腾龙,陈 浩,张坤峰,陈洁琳,李大祥,陈 彦
(1.安徽大学生命科学学院,生态工程与生物技术安徽省重点实验室,安徽 合肥 230000;2.南京康之春生物科技有限公司,江苏 南京 210000;3.安徽农业大学茶与食品科学技术学院 茶树生物学与利用国家重点实验室,安徽 合肥 230036)
多糖是通过糖苷键连接,由10个以上单糖分子构成的链状糖,广泛存在于天然产物中,其中包括高等植物多糖(菊糖、果胶等)、海洋多糖(海藻酸、壳聚糖等)、微生物胞外多糖(透明质酸、葡聚糖)等[1]。近年来,研究表明不同来源的多糖具有免疫调节、抗肿瘤、抗病毒、抗氧化、降血糖、降血脂等多种生物活性。随着肠道微生物研究的不断深入,人们发现存在于自然界中的多糖普遍具有调节肠道菌群功能,肠道菌群对多糖的降解是多糖生物活性产生的基础。
研究表明,人体胃肠道内分布着大量的菌群,庞大的微生物体系是机体趋于健康态的“桥梁”,它们不但控制着物质的消化吸收和机体免疫,而且具有预防和治疗代谢性疾病等作用[2]。研究显示,β2-1果聚糖和β-葡聚糖能够显著增加益生菌双歧杆菌的丰度,其中β-葡聚糖可为菌群繁殖产生乳酸提供条件,并发挥酵解多糖作用改善代谢相关疾病[3]。车前子多糖提高卵圆拟杆菌的相对丰富度,在降解β-1,4链接木聚糖中发挥重要作用[4]。大豆多糖促进益生菌双歧杆菌的生长并抑制致病菌,与此同时产生大量的乙酸、乳酸,改善肠道微生态。综上结果均提示多糖与肠道菌群相互作用是影响机体健康的关键因素。
多糖已被证明对机体肠道菌群组成影响显著,但由于宿主-肠道菌群-营养代谢三者间的相互作用研究不健全,其生理机制尚不清楚。目前,基于分子方法测序、DNA指纹、荧光原位杂交(FISH)、猎枪元基因组测序、元基因组学和元转录组技术与代谢组学方法的联用为菌群分析提供了新的研究模式。本文将根据国内外研究成果,重点综述多糖与肠道菌群的相互作用,展望以肠道菌群为靶点,多糖发挥“益生元功效”干预炎性相关疾病的治疗前景。如Fig 1。
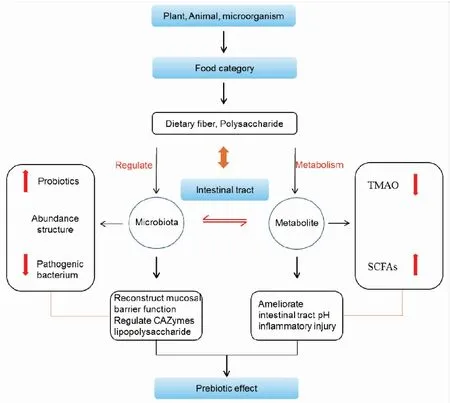
Fig 1 Impact of active compounds from polysaccharides on gut microbiota
1 肠道菌群的结构
肠道内定植着庞大数量的微生物群落,菌群数约在103~104之间,种类约有1 000种,编码超过300万个基因,产生的数千个代谢物参与完成人体正常的物质转化,被认为是人体重要的“虚拟器官”维持机体健康。肠道菌群在人体主要分为4大类群,分别为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria),其中厚壁菌门和拟杆菌门是优势菌门,占据肠道菌群总量的90%以上[5]。Joshua Lederberg 教授在2000年提出“超级生物体”概念后,越来越多的科研工作者将重点转向人体与肠道菌群之间相互作用关系研究。结果发现益生菌可以修复肠道黏膜损伤,维持肠道功能平衡。
人体肠道菌群结构容易受饮食、年龄、生活方式及药物等因素影响。华大基因研究院覃俊杰等研究人员基于元基因组测序技术对124个欧洲人粪便样本进行提取检测,发现人群的肠道基因99%源自细菌,数量约1 000~1 150种[6]。其中,拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)为优势菌,真杆菌属(Eubacterium)、瘤胃球菌属(Ruminococcus)、双歧杆菌属(Bifidobacteria)、链球菌属(Streptococci)等在肠道内也占据一定的比例。这一发现再次证明机体的健康受菌群基因的调控。Nishijima S 等[7]研究表明肠道菌群与地理环境,饮食差异存在密切的联系,通过宏基因组数据比较日本、欧洲、美国、中国等11个国家健康人群,发现日本人肠道菌群中放线菌门和双歧杆菌属比其他国家更丰富,此外,约90%的日本人拥有分解海苔和裙带多糖类相关酶基因,上述结果提示肠道菌群组成受长期饮食影响较大。因此,通过调控肠道菌群结构,或可成为促进机体健康和预防疾病的新靶点。
2 肠道菌群降解多糖的作用
多糖由单糖亚基和糖苷键构成,不能被人体直接消化吸收,其在体内发挥效用取决于肠道菌群的酵解,由于人类自身基因组只能编码17种多糖消化酶,大多数多糖需借助数量庞大的碳水化合物活性酶(CAZymes)参与降解、修饰及生成糖苷键功能。
多糖被CAZymes分步骤的降解成低分子量的寡糖或单糖,易于机体吸收,与此同时产生活性代谢物质-短链脂肪酸(short chain fatty acids,SCFAs)滋养肠道菌群并维持肠道微生态平衡。Bernard Henrissat根据其作用将CAZymes分为糖苷水解酶、多糖裂解酶、碳水化合物酯酶、糖基转移酶和辅助氧化还原酶5类,其中糖苷水解酶(GHs)、多糖裂解酶(PLs)和碳水化合物酯酶(CEs)是影响多糖结构降解变化的关键酶,目前,GHs分为130个家族,PLs分为22个家族,它们在降解同一复杂多糖时将发挥协同特性,这些活性酶影响着基因簇编码聚糖系统发挥降解作用[8]。结构越复杂的多糖,降解所需的关键菌就越多,Ndeh 等[9]发现B.thetaiotaomicron可利用已知结构最复杂的果胶多糖-II型鼠李半乳糖醛酸聚糖(rhamnogalacturonan-II,RG-II),研究挖掘得到了3个多糖利用位点(polysaccharide utilization loci,PULs)上的40余种酶参与RG-II降解过程。多糖进入体内作为“碳源”滋养肠道菌群,CAZymes将大分子物质分级转化成小分子物质、代谢产物和ATP被机体吸收,进而发挥调节免疫,抑制炎症等作用。如Fig 2。
菌群不同对多糖的降解能力有差异,编码的CAZymes 基因数量决定某类菌群对多糖的降解有通用性还是专化性。Rivière A等[10]研究发现拟杆菌属平均编码137.1个CAZymes 基因,具有降解多种多糖的能力,而厚壁菌属仅编码39.6个CAZymes 基因,只能降解部分特异性多糖。如卵形拟杆菌(Bacteroidesovatus)ATCC8483 能增加菊粉形成小分子产物被普通拟杆菌代谢利用;直肠真杆菌(Eubacteriumrectale)仅分解阿拉伯木聚糖的树胶醛糖侧链,长双歧杆菌(Bifidobacteriumlongum)则进一步代谢初级产物形成单糖,供直肠真杆菌利用[11]。活性酶之间协同完成多糖降解,主链通过GHs和部分PLs完成降解,侧链则需要木糖苷酶、甘露糖苷酶及大量水解酶参与,侧链的移除暴露新末端,为主链继续降解提供作用位点。不同的肠道菌群对多糖的降解特性存在差异,菌群分泌的活性酶对不同多糖的敏感性也有区别,拟杆菌在体内发挥益生作用,通过水解和发酵多糖,产生短链脂肪酸,被肠上皮细胞吸收利用。Gordon 等[12]于2006年发现并检测出拟杆菌门基因组内存在多糖利用位点(PULs)的独特特征,阐明其消化、降解和转运方式。每个PULs协调单个或多个特定聚糖分解,并编码蛋白质组成淀粉利用系统(Sus-like systems)。多形拟杆菌编码α-甘露糖苷酶、β-葡糖醛酸糖苷酶、α,β-葡糖苷酶等261种糖苷水解酶及多糖裂解酶,这一发现为菌群编码活性酶在多糖结构中的应用提供理论基础。
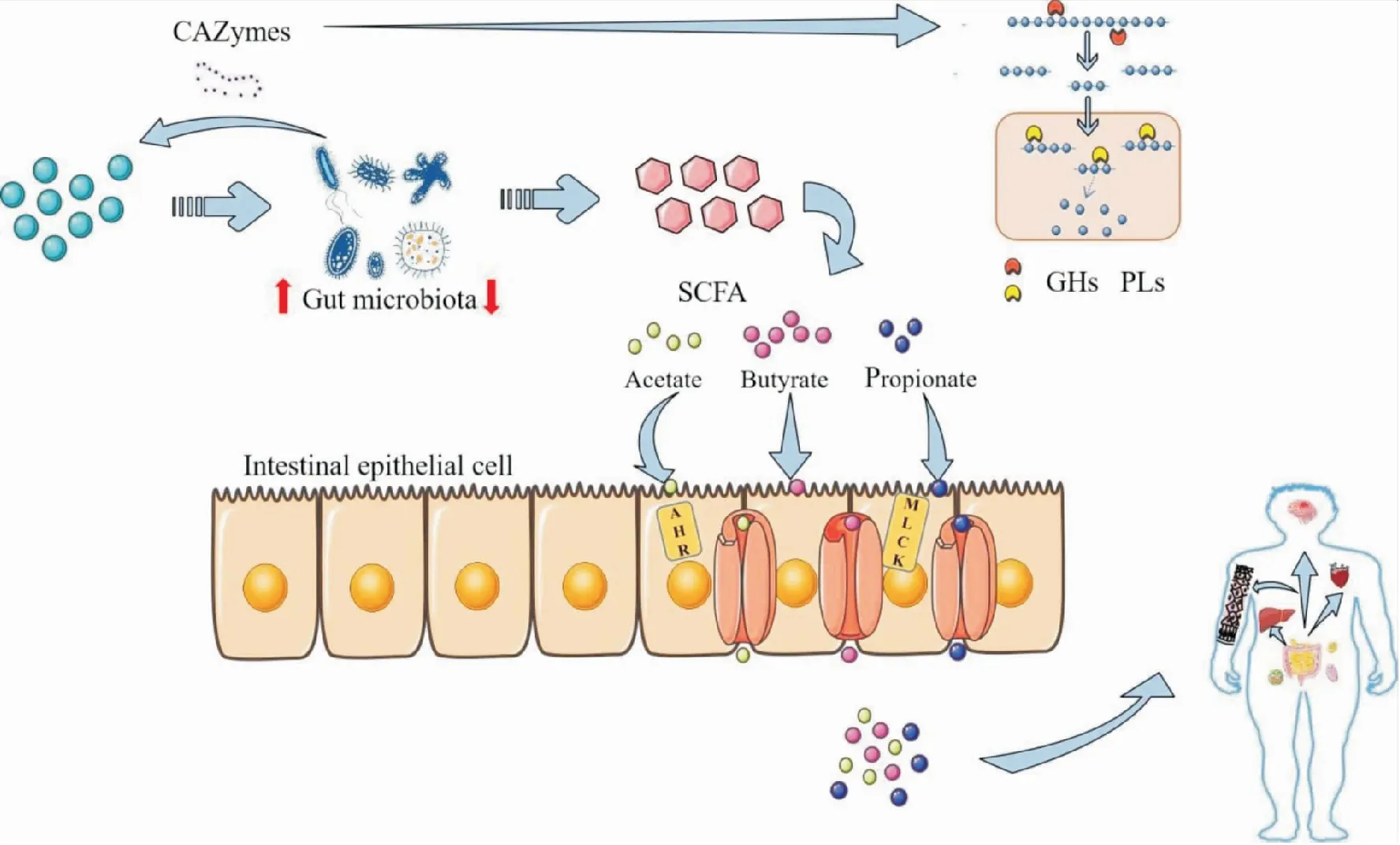
Fig 2 Schematic diagrm of CAZymes degrades polysaccharides
3 天然多糖调节肠道菌群作用
长久以来,肠道菌群调节人体代谢机制一直被人们忽视,但随着宏基因组学和代谢组学在肠道菌群中研究的深入,肠道菌群所发挥的作用不仅影响机体生命活动,而且决定着众多疾病的走向。天然多糖不能被人体直接消化吸收,需进入肠道内被肠道菌群分解后才能被机体利用,肠道菌群对多糖的降解是多糖生物活性产生的基础。2016年国际益生菌与益生元科学协会(ISAPP)将其重新定义为能够被宿主体内的菌群选择性利用并转化为有益于宿主健康的物质,提出了益生元的3个标准,一是不能在消化道被消化吸收;二是能促进有益菌的增殖;三是有利于促进机体健康。根据定义及标准,多糖可作为肠道菌群的碳源促进有益菌生长,起到益生元的作用。Tab 1中展示了活性多糖治疗的相关疾病及肠道菌群的结构变化。
3.1 调节肠道菌群丰度和多样性多糖在健康人的肠道中能发挥益生元作用保护肠黏膜,滋养益生菌生长。Chang等[13]研究发现,灵芝多糖即逆转肥胖小鼠肠道微生态失衡,促进肠道屏障完整,降低代谢性内毒血症和厚壁杆菌与拟杆菌间的比值,证明灵芝高分子量多糖具有更好的益生元活性。Cui等[14]探讨了从黄芩中分离出的一种均质多糖SP2-1对溃疡性结肠炎(UC)的影响。结果表明,SP2-1治疗可减轻DSS诱导的UC小鼠的体质量减轻,减轻DAI,改善结肠病理损伤,降低MPO活性。SP2-1也能抑制了炎性细胞因子水平。此外,SP2-1可使ZO-1、Occludin和Claudin-5的表达上调,肠道屏障得到了修复,与模型组相比,SP2-1处理后厚壁菌门、双歧杆菌、乳酸杆菌和罗斯伯氏菌的丰度明显增加。SP2-1对拟杆菌、变形杆菌门和葡萄球菌的水平有显著抑制作用。综上,基于其天然的免疫活性和肠道菌群的调节功能,多糖在维持黏膜屏障功能方面作用显著。
3.2 肠道菌群免疫调节肠道免疫系统在与炎症的发生发展紧密相关,随着自身免疫性疾病人数逐年增加,免疫调节剂的研究逐渐被科研工作者广泛关注,菌群协助肠道恢复免疫功能,是抵御众多疾病的重要手段,因此从天然产物中筛选免疫调节剂是安全可行的。早在1976年,香菇多糖的调节免疫作用就被证实,并用作临床辅助治疗。Liu Q等[15]建立小鼠骨髓抑制模型,发现香菇多糖具有调节丝裂原活化蛋白激酶(MAPK)和NF-κB的作用,减轻四氢吡喃阿霉素介导的骨髓抑制。Wang 等[16]研究证实香菇多糖(LNT)可以通过调节仔猪肠道菌群的组成和代谢产物来减轻大肠杆菌脂多糖(LPS)诱导的肠道损伤,口服给予LNT 治疗能显著抑制炎症信号通路(TLR4、NLRs)和促炎因子(IL-1、IL-6)的释放。由此提示香菇多糖的免疫调节作用需借助肠道菌群与多种途径协同发挥功效。此外,经肠道菌群酵解的多糖产生短链脂肪酸,激活下游信号通路FFAR2,抑制单核细胞释放白介素(IL-1β)等炎症因子,促进免疫细胞分化(T→Th2),增加IL-10释放,减缓炎症发展进程。Zhang等[17]研究证实,牛蒡子水溶性多糖也可有效调节巨噬细胞和小鼠血清中炎症细胞因子水平,提高乳杆菌、欧式杆菌和考拉杆菌等有益菌的丰度,增加SCFAs含量改善代谢紊乱。Bing等[18]评估了灵芝多糖(GLP)缓解DSS诱导的结肠炎的治疗能力,经GLP治疗后的结肠炎小鼠TNF-α、IL-1β和IL-6水平显著下调,抑制MAPK和NF-κB通路缓解了小鼠结肠炎。近期,本课题组也进行了相关研究,结果发现虎掌菌多糖(SAP)能有效激活巨噬细胞的MAPKs 信号通路释放免疫因子,降低肠道内厚壁菌门与拟杆菌门(F/B)比值,提高疣微菌门(Verrucomicroia)与变形菌门(Proteobacteria)的丰度[19]。
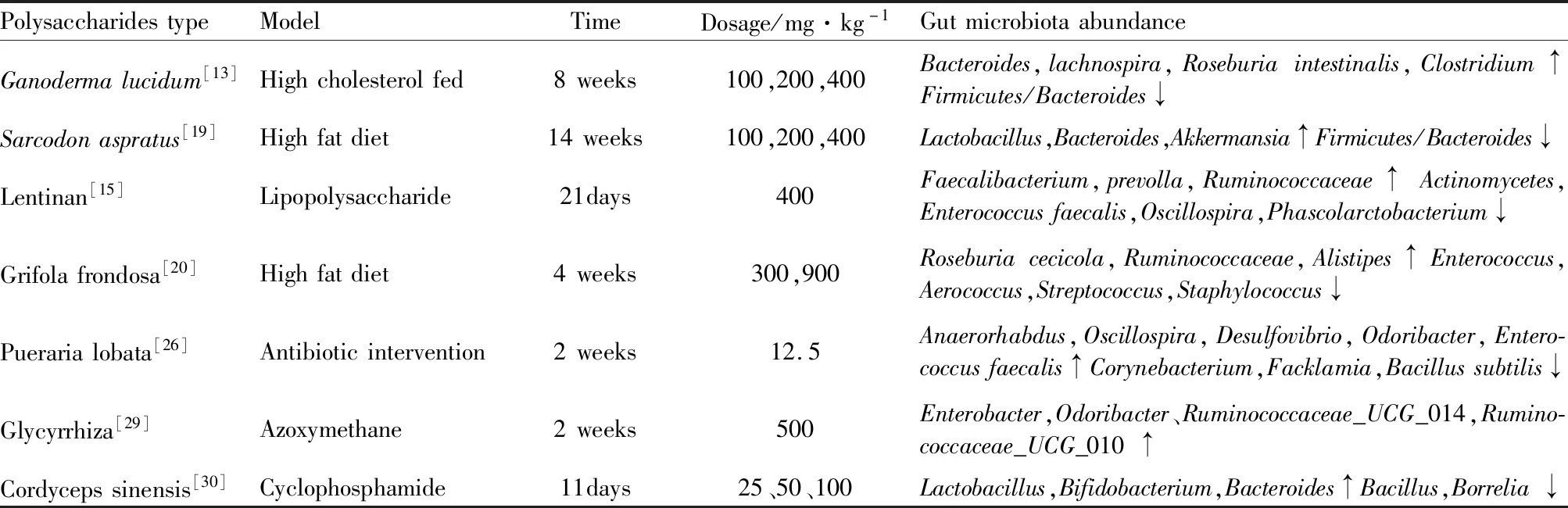
Tab 1 Influence of polysaccharides on gut microbiota
3.3 肠道菌群与炎性疾病的关系新技术的发明和应用促进了全面了解肠道微生态环境,如肠道菌群和疾病发病机制之间的关系,肠道菌群组成与膳食营养之间的关系,肠道菌群和免疫系统之间互作等。研究发现,长期高胆固醇摄入会影响肠道菌群组成,增加氧化三甲胺等有害物质的产生,从而导致肥胖、高血压、糖尿病和心血管疾病等疾病的发生。不健康的生活方式和药物的滥用同时破坏了健康肠道菌群的架构,使宿主更易感染或患病。因此,改善肠道菌群结构是建立机体健康的重要途径。
3.3.1调节糖/脂紊乱作用 根据《柳叶刀》和中国疾病预防控制中心报道显示,截止到2021年,我国成人肥胖率为16.4%,BMI指数高于25 kg·m-2的人数超过了9亿,其中肥胖人群占6亿(BMI>30 kg·m-2)。肠道菌群是参与机体能量转换和新陈代谢重要途径,菌群在结肠、盲肠内酵解复杂的碳水化合物,空肠和十二指肠内消化脂肪和单糖,并分泌出保护肠道黏膜的抗菌剂,抵御外界致病菌的入侵,肠道内细菌丰度改变,被认为是影响机体糖、脂代谢的关键因素。Guo等[20]发现,灰树花多糖(GFP)能够抑制高脂饮食(HFD)诱导的小鼠体质量增加和链脲佐菌素(STZ)诱导的糖尿病小鼠血糖值,显著降低肝脏TC、TG 和游离脂肪酸(NEFA)水平,这些作用与其调控小鼠肠道菌群密切相关(降低与肥胖正相关的肠球菌属、气球菌属、链球菌属和葡萄球菌属数量;增加与肥胖负相关的罗斯氏菌属和另枝菌属的数量),使高脂小鼠肠道菌群恢复到正常丰度水平。Chen等[21]采用16SrDNA测序和1HNMR谱分析方法,检测了灵芝多糖(GLP)对高脂饮食和STZ诱导的T2DM大鼠肠道微生物群和粪便代谢物的影响,结果表明,给予GLP可导致大鼠空腹血糖和胰岛素水平的显著降低。此外,GLP处理降低了气球菌、瘤胃球菌、棒状杆菌和变形杆菌等有害细菌的丰度,并增加了布劳氏菌、脱卤杆菌、副拟杆菌和拟杆菌的水平。PICRUSt分析表明,GLP可以恢复T2DM大鼠肠道细菌群落中氨基酸代谢、碳水化合物代谢、炎症物质代谢和核酸代谢紊乱,非靶向代谢组学分析观察到的大部分代谢变化与这些结果一致。Xu等[22]研究表明,龙须菜多糖能够治疗高脂饮食引起的代谢综合征作用,减少小鼠组织中脂肪的积累和炎症,其效应与肠道菌群改善紧密相关(上调拟杆菌门/厚壁菌门的比例,减小整体肠道菌群组成比例变化),纯化的多糖D-GLPs 对部分拟杆菌成员的增殖促进更好,这些结果均表明肠道菌群对多糖结构(聚合物长度、分支度、糖苷键连接等)具有选择性,从而为精确调控肠道菌群和制备低聚糖提供基础理论依据。沙嵩多糖(ASPK)对高脂昆明小鼠给予小鼠200 mg·kg-1、400 mg·kg-1、800 mg·kg-1ASPK持续8周后,高剂量ASPK显著增加Coprococcus,Anaerotruncus,Dorea和Bifidobacterium的丰度,降低Rikenella的相对丰度分别,同时下调ACC-1,FAS,SREBP-1c 和PPARc脂肪酸合成基因表达,减少肝脏脂质积累,发挥降血脂、降血糖和保肝等生物活性[23]。研究发现球藻多糖(Mw≈5.63×106u)能够改善小鼠肠道菌群的丰度和多样性,同时调节菌群组成,增加Coprococcus_1、Lactobacillus和Turicibacter的丰度,减少[Ruminococcus]_gauvreauii的丰度。此外,球藻多糖能改善血浆和肝脏脂质代谢,加速盲肠总胆汁酸和短链脂肪酸代谢[24]。Yao等[25]探讨了青钱柳多糖(CCPP)对2型糖尿病大鼠肠道微生物群和肠道代谢物,特别是短链脂肪酸(SCFAs)的影响,结果得出,CCPP治疗后大鼠血糖水平受到抑制,糖耐量和血脂参数得到改善。此外,CCPP增加了体内和体外SCFAs的产生,而肠道微生物群是这一过程的关键因素。在CCPP处理的大鼠中,GPR41、GPR43和GPR109a受到显著刺激,并伴随着GLP-1和PYY的表达上调。总结,CCPP可以通过增加可产生SCFA的菌群,促进SCFAs的产生,上调SCFA-GLP1/PYY相关的受体来缓解2型糖尿病症状。以上研究提示我们肠道菌群的改变与机体代谢之间存在密切的联系,有益菌丰度的提升将在一定程度上协助宿主肠道内环境稳定,减少内毒素入血,防止如胰岛素抵抗等在内宿主代谢紊乱的发生。
3.3.2炎症调节作用 肠道内菌群的变化时刻影响着体内炎症的发生发展,肠道黏膜表面寄居着种类繁多的微生物,是肠道内外环境稳定的生理屏障:构成的物理屏障、分泌抗菌肽和粘蛋白,能够有效地保护宿主不被外源微生物入侵,防止肠黏膜受损。国内外大量研究证明,炎症的发生和发展均会伴随着肠道屏障功能的损伤以及ZO家族蛋白(zonula occludens,ZOs)、咬合蛋白(occludin)等细胞紧密连接表达水平的改变。千日菊中分离出的鼠李糖半乳糖醛酸(RGal)在小鼠肠道炎症实验模型中的保护和愈合作用。结果得出,与对照相比,RGal除了保护胶原稳态和增加细胞增殖外,还能保护结肠上皮,促进黏膜肠上皮细胞和黏液分泌杯状细胞的维持。在体外屏障功能试验中,RGal降低了IL-1β暴露后的细胞通透性,同时降低了IL-8的分泌和claudin-1的表达,并保留了咬合蛋白的分布。Chen等[26]通过葛根多糖(PPL)以12.5 mg·kg-1给予正常和抗生素相关腹泻型小鼠2周后发现,PPL降低了异戊酸浓度,显著增加颤螺菌和厌氧棍状菌属等有益菌丰度。此外,其还能缓解结肠炎性病变阐明PPL是一种优良的肠道菌群功能调节剂。Thomson等[27]研究发现,菊粉分别与乳杆菌、双歧杆菌培养时可产生大量乳酸和乙酸,而木聚糖与共生梭菌、拟杆菌共培养能产生较多的丁酸,乙酸和丁酸都具有抑制炎症因子TNF-α、IL-8 和NF-κβ表达的作用,进而缓解炎症反应。Yan等[28]揭示了黄秋葵多糖(OP)激活了炎症通路TLR4/ NF-κB 和MAPKs信号对CUMS诱导的抑郁症小鼠产生炎性细胞因子的抗炎作用,同时OP改善菌群定植小鼠的焦虑和抑郁行为,揭示OP抗抑郁作用的潜在机制与“肠脑轴”双向调节相关。上述研究提示,多糖与肠道菌群之间的相互作用对宿主内慢性炎症的产生至关重要,保持菌群内结构合理将对炎症因子的改善产生积极的作用。
3.3.3肿瘤作用 多糖具备优秀的抗肿瘤活性,近年来研究发现,其发挥作用的机制与肠道菌群功能的调节密不可分。以往的研究大多局限于多糖天然活性对肿瘤的抑制作用,然而,目前越来越多的研究结果指向肿瘤发生过程伴随着肠道菌群失调。Zhang等[29]研究同样证实,甘草多糖(GCP)发挥抗肿瘤作用主要与其调控肠道菌群有关,研究通过粪便移植实验对比治疗组与模型组之间的肠道菌群组成存在差异,其中Enterorhabdus、Odoribacter、Ruminococcaceae_UCG_014、Ruminococcaceae_UCG_010、Enterococcus和Ruminiclostridium_5丰度恢复正常,而经抗生素处理后的GCP治疗组也失去了抗肿瘤活性,表明GCP发挥肿瘤抑制作用依赖专属菌群调控。研究同样认为多糖发挥抗肿瘤活性主要与改善机体免疫功能作用有关,如冬虫夏草多糖(CSP)通过调节肠道黏膜免疫,发挥保护微生物的作用,提高了益生菌乳酸菌、双歧杆菌、拟杆菌的丰度,降低了致病菌(梭状芽孢杆菌、柔螺旋体)的丰度,从而降低抗肿瘤药物环磷酰胺导致的肠道紊乱问题,组织切片结果表明其具有减毒增效的作用[30]。虽然对于多糖调节肠道菌群的抗肿瘤作用已有相关报道证明,但其优秀的活性也仅体现在部分天然活性多糖成分中,现在绝大部分多糖的抗肿瘤作用依然基于其免疫调节作用,研究者可以充分挖掘天然产物中的功能活性产物,为多糖活性的机制研究提供更多的理论依据。
3.3.4其他疾病 随着天然多糖研究不断深入,其通过调节肠道菌群发挥治疗疾病的作用被广泛关注。例如有效改善阿尔茨海默病患者的神经功能退化、减少病毒引起的肠黏膜损伤、缓解细菌引发的肝肾功能衰竭和身体乏力、腹泻等病症。研究具有益生元作用的活性多糖及肠道菌群关系,探讨多糖-肠道菌群-疾病相互作用规律,揭示活性多糖在肠道中降解利用的机制,为多糖功能因子改善人体肠道健康研究提供重要科学依据。
4 结论和展望
肠道菌群在宿主健康中发挥着至关重要的作用,人们逐渐认识到肠道菌群在调节宿主代谢中重要性。相较于机理、遗传和环境等难控因素,通过天然产物活性成分调节肠道菌群促进机体健康已成为研究的趋势和热点。因此,探究不同类型多糖对肠道菌群的影响,能够为今后通过合理膳食调节肠道菌群结构促进宿主健康提供相应理论依据。
在总结多糖与肠道菌群关系的过程中,我们逐渐意识到,多糖作为一种“大分子物质”具有调节多种生物活性的能力,因此类似的“桥”概念也可以应用于人类健康。其中最主要的是宿主肠道内稳态的自我调节。许多研究表明,多糖可以通过调节肠道微生态来预防和缓解疾病的发生,但对于人体器官间复杂的调节机制仍有进一步研究的空间。目前的主流观点是相对分子质量和聚合物长度影响多糖在微生物间的识别和糖酵解过程中的参与。因此,有必要加强对天然多糖结构与肠道微生态调节关系的研究。为了确保多糖的安全有效剂量,还需要进行更多的临床试验。研究学者通过研究肠道菌群构建起天然多糖与人体健康的“桥梁”是具有深远意义的,而解析多糖的结构与肠道微生物的作用关系也同等重要,且具有更加重要的价值。越来越多的研究工作表明,天然多糖对肠道内的真菌和病毒等低水平微生物有显著的作用。在一定的适宜条件下,需要利用多糖资源丰富、疗效稳定、副作用小的优点。可以认为是未来肠道微生态调节的疾病预防、治疗选择的发展方向。