川芎嗪抗糖尿病大鼠脑缺血再灌注损伤的转录组学研究
袁仕林,孙 苗,周玉佳,刘 琼 ,常 青,黑常春,杨 笑,4
(宁夏医科大学 1.临床医学院神经病学中心、2.基础医学院、3.生育力保持教育部重点实验室、4.宁夏颅脑疾病重点实验室,宁夏 银川 750004)
脑卒中因其居高不下的发病率、致残率及死亡率而给人类社会带来沉重负担。糖尿病(diabetes mellitus,DM)作为脑卒中的独立危险因素不仅增加缺血性脑卒中的发病率,而且显著加重缺血脑组织的损伤程度。然而DM加重脑缺血损伤的具体机制尚不十分明确,同时缺乏有效防治手段。
川芎嗪(tetramethylpyrazine,TMP)是从川芎根茎中提取的一种生物碱类化合物。许多体内外实验与临床证据表明其具有舒张血管、保护心肌细胞、抗肝纤维化、抗脊髓损伤等多种作用[1]。一项TMP治疗缺血性脑卒中患者的Meta分析显示[2],TMP能够改善缺血性脑卒中患者的神经功能缺损,且不良事件发生率低。Ding等[3]发现TMP通过激活PI3K/Akt通路对脑缺血/再灌注(ischemia/reperfusion,I/R)损伤大鼠起到神经保护作用。但目前,TMP对DM加重的脑I/R损伤是否有改善作用尚未见报道。
近些年,转录组学技术不断发展,逐渐在基因挖掘、代谢调控、药物研发、揭示疾病分子机制等方面发挥日益重要的作用。因此,本研究利用全长转录组测序技术,拟从整体角度探讨TMP对DM大鼠脑I/R损伤的神经保护作用及其分子机制。
1 材料与方法
1.1 材料
1.1.1动物 宁夏医科大学实验动物中心提供8~10周龄SD雄性大鼠,体质量(220~280 g),动物许可证号为SCXK(宁)2020-0001。实验中所有操作均经过宁夏医科大学实验动物中心实验动物福利伦理委员会审核,批准号为ACUC-NYLAC-2019-109。
1.1.2药品、试剂 链脲佐菌素(streptozotocin,STZ)(美国Sigma公司,货号S0130);血糖测量仪、血糖试纸(三诺生物传感股份有限公司,批号130911);盐酸川芎嗪注射液(河南辅仁怀庆堂制药有限公司,批号20062311);尼氏染色试剂盒(北京索莱宝科技有限公司,货号G1430);TUNEL试剂盒(南京诺唯赞生物科技有限公司,货号A112-02);反转录、RT-qPCR试剂盒(北京全式金生物技术有限公司,货号分别为AU341-02、AQ601-02);Toll样受体2(Toll-like receptor 2,TLR2)抗体(沈阳万类生物科技有限公司,货号WLH4120);磷酸化核因子-κB p65(phosphorylated-nuclear factor kappa-B p65,p-NF-κB p65)、核因子-κB p65(nuclear factor kappa-B p65,NF-κB p65)抗体(美国CST公司,货号分别为3033、8242);髓样分化因子88(myeloid differentiation primary response 88,MyD88)抗体(英国Abcam公司,货号ab2064);白细胞介素-1β(interleukin-1β,IL-1β)抗体(上海碧云天生物技术有限公司,货号AF7209);白细胞介素-6(interleukin-6,IL-6)抗体(北京博奥森生物技术有限公司,货号bs-0782R);活化的含半胱氨酸的天冬氨酸蛋白水解酶-3(cleaved cysteinyl aspartate specific proteinase-3,cleaved Caspase-3)抗体(英国Abcam公司,货号ab214430);含半胱氨酸的天冬氨酸蛋白水解酶-3(cysteinyl aspartate specific proteinase-3,Caspase-3)、B细胞淋巴瘤-2(B-cell lymphoma-2,Bcl-2)抗体(上海艾比玛特医药科技有限公司,货号分别是T40044、T40056);GAPDH抗体(武汉三鹰生物技术有限公司,货号10494-1-AP)。
1.1.3仪器 R5401E小动物麻醉机(深圳市瑞沃德生命科技有限公司);Leica RM 2235切片机(德国Leica公司);Thermo Scientific Multiskan GO全波长酶标仪、Proflex 3×32型数字PCR 仪(美国Thermo Fisher公司);OSE-DB-02制冷型程控五段金属浴(北京天根生化科技有限公司);PromethION48测序仪(英国Oxford Nanopore Technologies公司)。
1.2 方法
1.2.1动物分组 122只SD大鼠先分为正常血糖组(Control组)和糖尿病组(DM组),将DM模型成功的大鼠随机又分为DM对照组和川芎嗪(TMP)治疗组。每个大组又分为假手术组(Sham)和脑缺血/再灌注组(I/R)。分组如下:正常血糖假手术组(NC组)、正常血糖脑缺血/再灌注组(NG组)、DM假手术组(DMC组)、DM脑缺血/再灌注模型组(DMG组)、DM假手术+TMP治疗组(TMPC组)、DM脑缺血/再灌注模型+TMP治疗组(TMP组)。舍弃DM模型不成功的大鼠12只及脑缺血/再灌注术中死亡的大鼠8只(DMG组6只,NG组2只),余下102只动物纳入研究,每组均为17只。
1.2.2建立DM模型与给药 DM组大鼠在给药前一晚禁食12 h,次日一次性快速腹腔注射STZ(50 mg·kg-1)诱导DM模型。3 d及1周后测量其血糖值,血糖值>16.7 mmol·L-1则认为DM模型建立成功。同时每间隔1周监测其血糖值。4周后进行脑缺血/再灌注处理。TMP治疗组连续腹腔注射TMP 1周(40 mg·kg·d-1)后进行手术,其余组给予等量生理盐水注射。
1.2.3建立全脑缺血/再灌注模型 大鼠经动物麻醉机异氟烷诱导麻醉,整个手术过程维持低浓度运行。按照课题组前期方法[4]建立全脑缺血/再灌注模型:双血管闭塞法(2-VO,10 min),再灌注16 h。实验流程图如下。
1.2.4脑含水量测定 大鼠在术后16 h水合氯醛麻醉下处死,迅速取出大脑,去除小脑、嗅球及脑干,用生理盐水冲洗脑组织血液并用吸水纸吸干,将整个大脑放置于电子天平称量纸上称质量,此为湿质量,然后放置于100 ℃烘干箱内干燥24 h,再次称取大脑质量,即为干质量,脑含水量/%=(湿质量-干质量)/湿质量×100%。
1.2.5HE染色 术后16 h,对动物进行脑组织灌注固定,取出大脑,4%多聚甲醛继续固定24 h。常规脱水、石蜡包埋、切片、HE染色。显微镜下观察坏死细胞、拍照。坏死细胞排列紊乱,形态不规则,呈现三角形、菱形和不规则形,细胞质嗜酸性,核固缩、核膜不清楚、核仁不清。每组选用5张切片,每张切片选取皮质区的4个视野进行统计。结果表示为坏死细胞数除以总细胞数(%)。
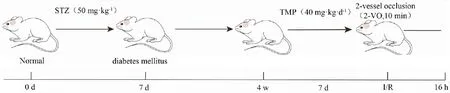
Fig 1 Experimental flow chart
1.2.6尼氏染色 使用尼氏染色试剂盒进行脑片染色。将切片置于试剂盒焦油紫染色液中,并放置于42 ℃水浴锅中1 h,95%乙醇分化后脱水透明,中性树胶封片。显微镜下拍照、观察神经元、尼氏体。
1.2.7TUNEL染色 使用TUNEL试剂盒进行脑片染色。分别滴加50 μL蛋白酶K工作液、1×Equilibration Buffer、TdT孵育缓冲液、DAPI溶液,荧光显微镜下拍照。结果以TUNEI阳性细胞数/DAPI细胞总数的百分比来表示。
1.2.8转录组测序 取右侧皮质,用TRIzol试剂盒提取RNA。使用mRNA capture beads从总RNA中纯化出Poly(A) mRNA,利用反转录引物通过退火与mRNA的poly A尾结合,然后加入RT逆转录酶合成第一链,通过PCR扩增引物扩增成双链 cDNA,使用NEBNext FFPE DNA Repair Mix和NEBNext Ultra Ⅱ End Repair/dA-Tailing Module完成核酸片段的损伤修复和末端修复加A,使用SQK-LSK109试剂盒完成测序接头的连接,配置上机文库,用PromethION48测序仪进行测序,每组设4个生物学重复。
1.2.9生物信息学分析 测序完成后,过滤原始数据,得到总的高质量的数据(Clean Data)以利于后续生信分析。把Fold Change≥1.5且P<0.05作为筛选标准,将筛选出的差异表达基因(differentially expressed genes,DEGs)进行GO、KEGG分析。
1.2.10实时荧光定量PCR(RT-qPCR) 提取大鼠脑组织RNA,反转录成cDNA,使用RT-qPCR试剂盒检测各组关键基因TLR2、MyD88、NF-κB p65、IL-1β、IL-6、Caspase-3、Bcl-2的基因表达水平,反应程序为94 ℃、30 s,94 ℃、5 s,55 ℃、15 s,72 ℃、10 s,45 个循环,引物序列见Tab 1。
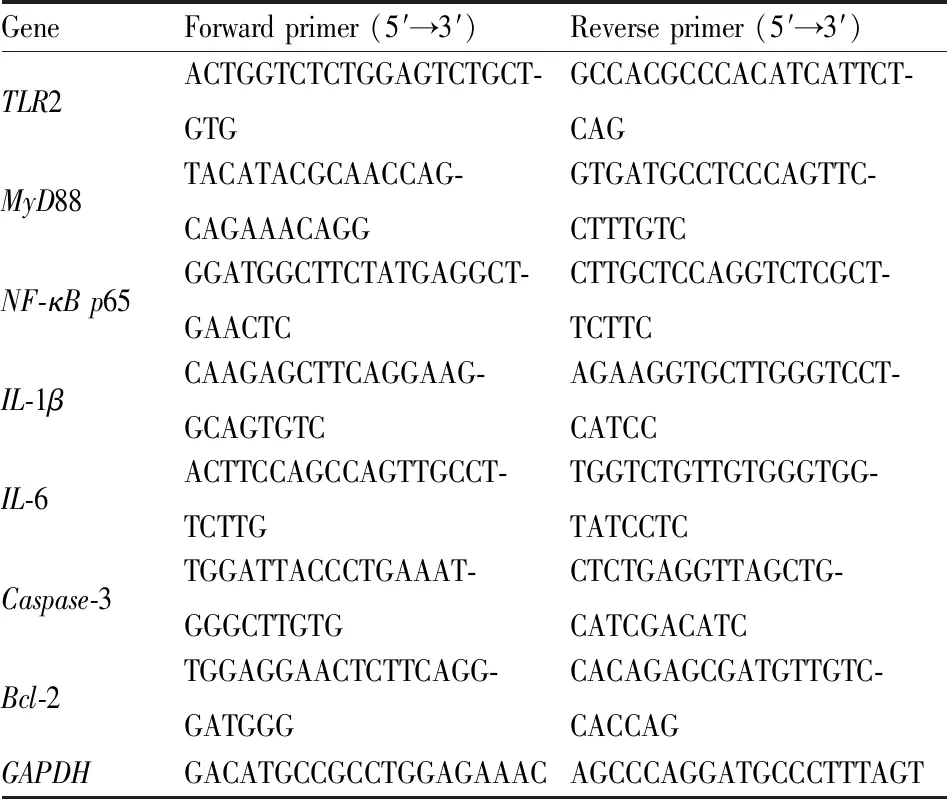
Tab 1 Primer sequences
1.2.11Western blot 提取大鼠脑组织蛋白,BCA法蛋白定量,以10 μL体系上样,常规电泳,转膜300 mA 1 h,快速封闭液封闭2 h。加入TLR2(1 ∶1 000)、MyD88(1 ∶500)、p-NF-κB p65(1 ∶1 000)、NF-κB p65(1 ∶1 000)、IL-1β(1 ∶1 000)、IL-6(1 ∶1 000)、Cleaved Caspase-3(1 ∶4 000)、Caspase-3(1 ∶1 000)、Bcl-2(1 ∶1 000)、GAPDH(1 ∶10 000)一抗、对应二抗孵育(1 ∶10 000),曝光,用ImageJ分析条带灰度值。

2 结果
2.1 各组大鼠血糖值统计结果NG组术前血糖为(5.52±0.73)mmol·L-1,STZ诱导的DMG组术前血糖为(26.59±3.62)mmol·L-1,TMP组术前血糖为(26.45±3.19)mmol·L-1,血糖值未见明显变化(P>0.05)。
Tab 2 Statistical table of preoperative blood glucose
of rats in each
2.2 各组大鼠脑含水量统计结果与NC组比较,NG组脑含水量明显增加(P<0.01),DMG组脑含水量进一步增加(P<0.01);与DMG组比较,TMP治疗可明显降低DM大鼠脑I/R后的脑含水量(P<0.01),表明TMP可以减轻DM大鼠脑I/R后的脑水肿程度。
Tab 3 Comparison of brain water content among
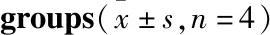
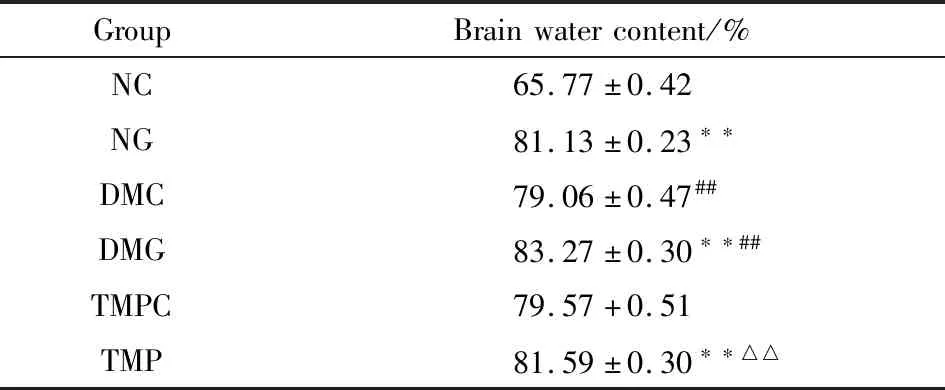
GroupBrainwatercontent/%NC65.77±0.42NG81.13±0.23∗∗DMC79.06±0.47##DMG83.27±0.30∗∗##TMPC79.57+0.51TMP81.59±0.30∗∗△△
2.3 TMP对DM大鼠脑I/R后细胞坏死的影响HE染色结果如Fig 2所示,NC组大鼠脑组织右侧皮质神经元排列整齐,细胞形态完整,可见清晰核膜,染色均匀。NG组细胞间质水肿,核仁显示不清,核固缩可见明显坏死神经元,与NC组相比,坏死细胞明显增多[(1.33±0.23)%vs(16±1)%,P<0.01]。DMG组较NG组神经元损伤进一步加重[(34±2.64)%vs(16±1)%,P<0.01]。TMP与DMG组相比,坏死细胞明显降低[(17.33±1.52)%vs(34±2.64)%,P<0.01]。
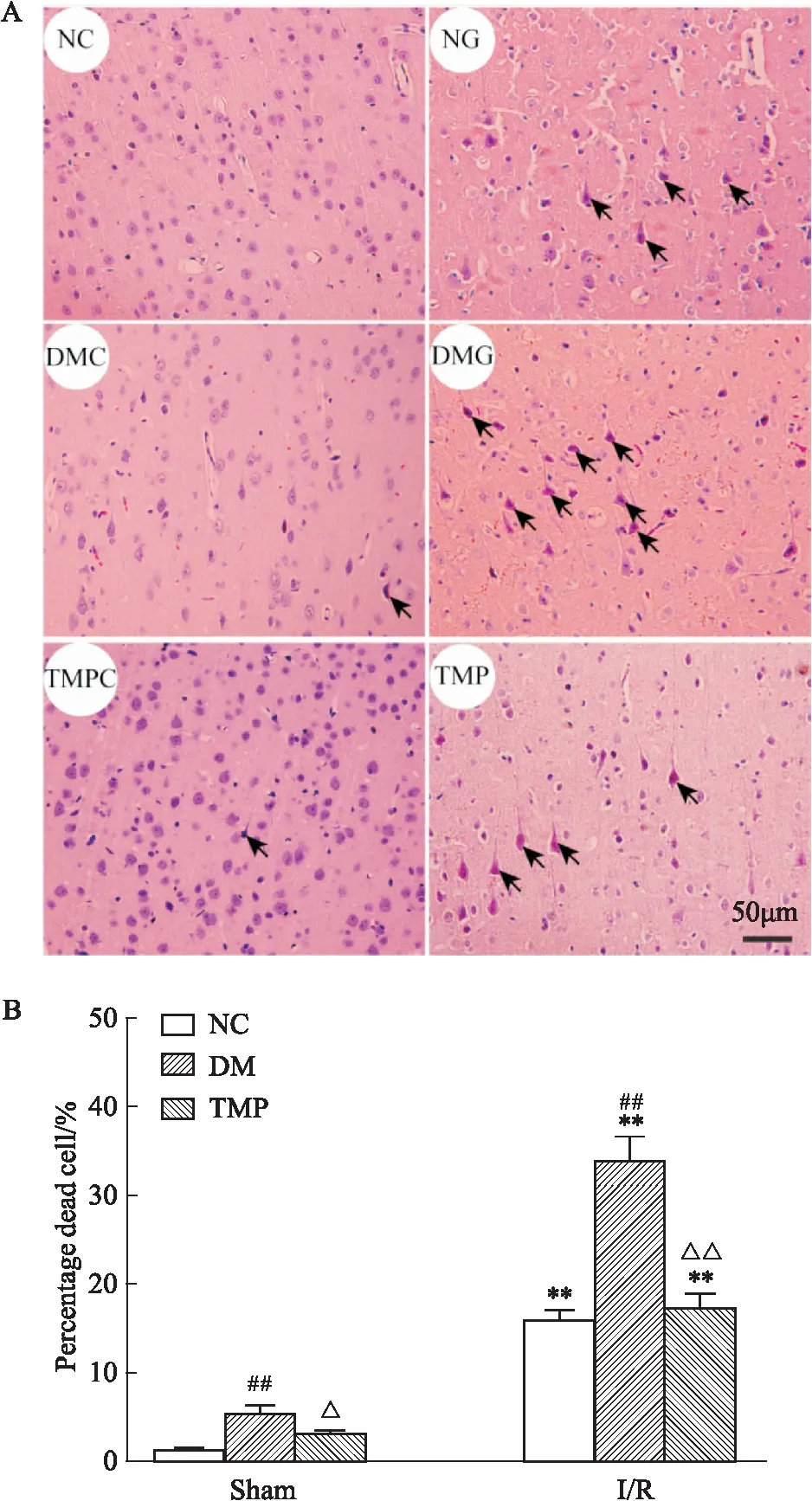
Fig 2 HE staining and necrotic neurons statistical
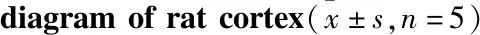
A:HE staining of rat cortex.The arrow refers to necrotic neurons;B:Statistics of necrotic neurons.**P<0.01vsSham group;##P<0.01 DMvsControl group;△P<0.05,△△P<0.01 TMPvsDM group.
2.4 TMP对DM大鼠脑I/R后神经元及尼氏体的影响尼氏染色结果如Fig 3所示,NC组大鼠脑组织右侧皮质神经元染色均一、排列整齐、结构完整,数目较多,尼氏体丰富。NG组可见神经元数目和尼氏体减少,DMG组神经元数目及尼氏体进一步减少,TMP组神经元数目有所恢复,尼氏体增多。
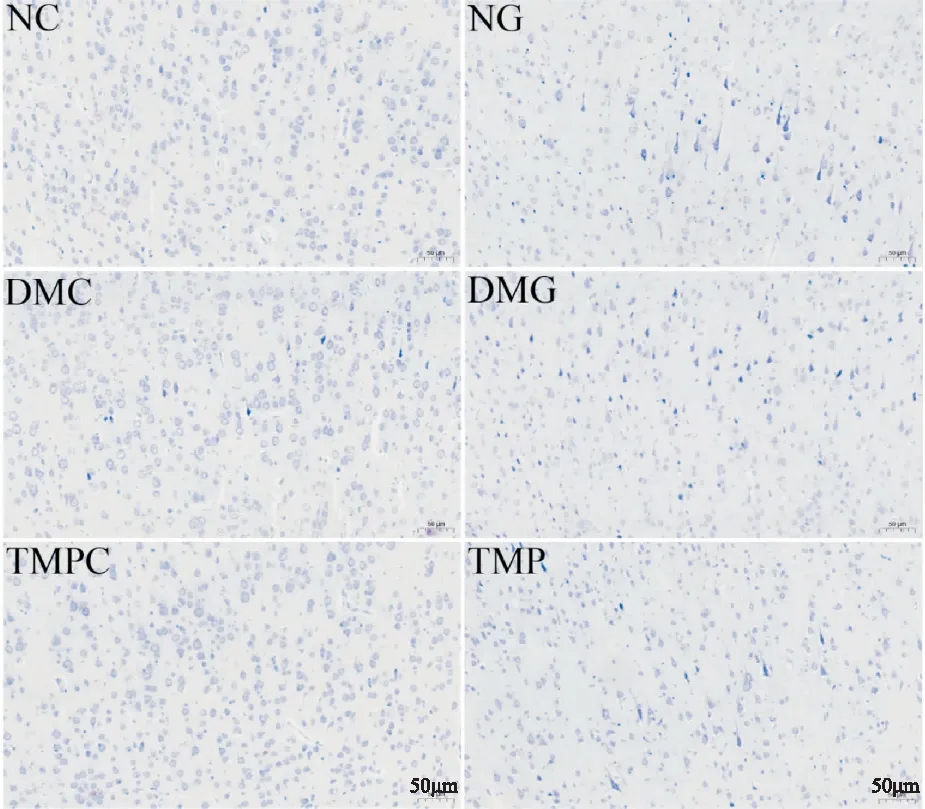
Fig 3 Nissl staining of rat
2.5 TMP对DM大鼠脑I/R后细胞凋亡的影响TUNEI染色结果如Fig 4,Sham组偶可见零星凋亡细胞,NG组凋亡细胞数量明显增多(8.13±1.17)%(P<0.01);DMG组较NG组明显多(13.97±1.57)%(P<0.01);而TMP组阳性细胞数量明显减少(7.06±1)%(P<0.01),表明TMP能够减轻DM大鼠脑I/R后的神经元凋亡。
2.6 全长转录组数据分析
2.6.1测序数据产出统计 将原始fastq数据经过过滤后得到总的高质量的数据(Clean Data),其信息统计见Tab 4。
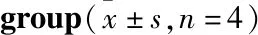
Tab 4 Statistical table of Clean Data of each
Fig 4 TUNEL staining and TUNEL positive cell statistical
2.6.2差异表达基因分析 采用DESeq2软件筛选DEGs(须满足Fold Change≥1.5且P<0.05)。结果如Fig 5。与DMC组比较,DMG组筛选到的DEGs一共有3 289个,其中明显上调的基因有2 489个,明显下调的基因有800个;而给予TMP干预后,共出现1 125个DEGs,这其中包括上调基因473个,下调基因652个。
2.6.3差异表达基因GO富集分析 为了研究TMP抗DM大鼠脑I/R损伤的分子机制,进一步对
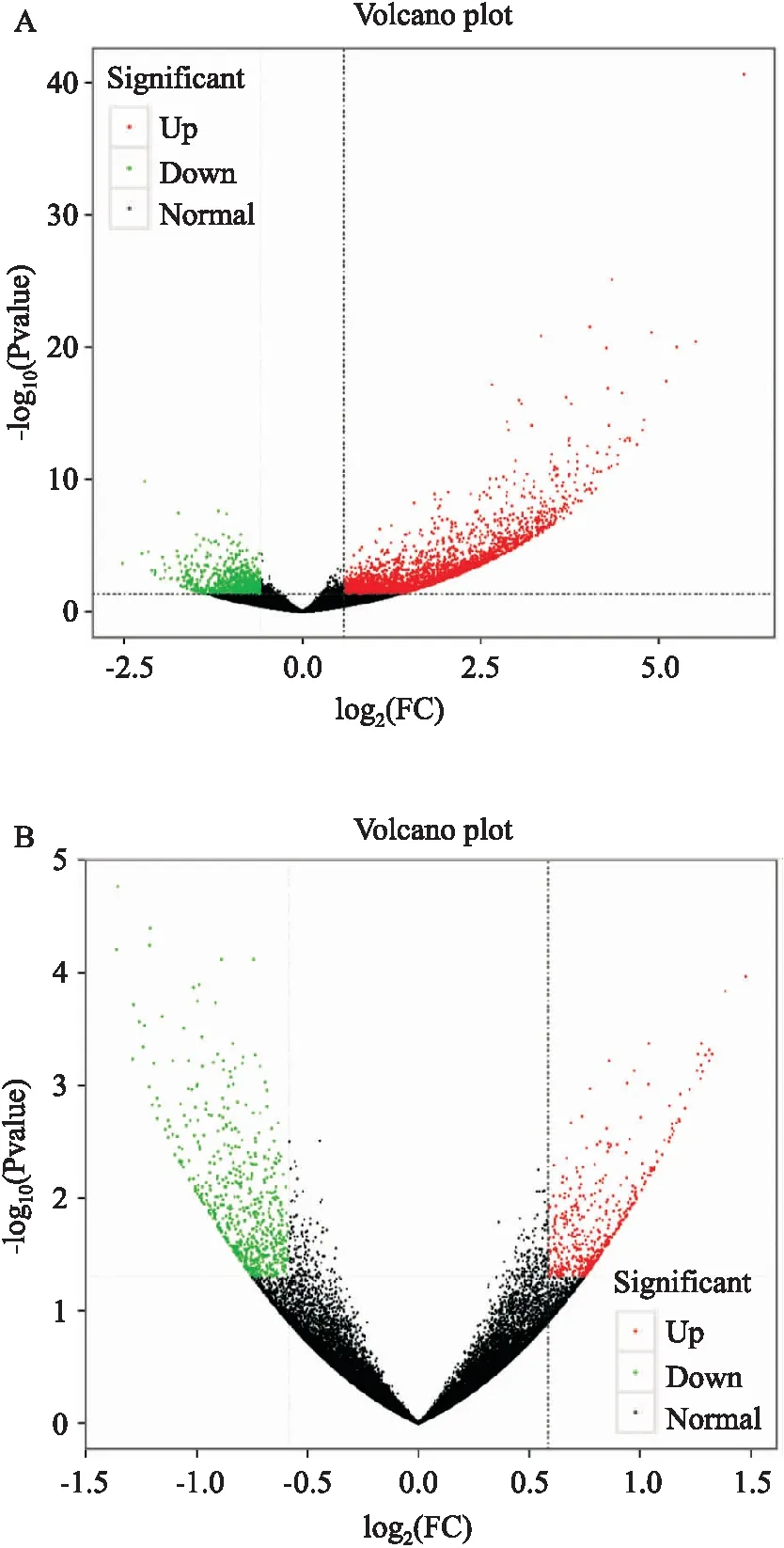
Fig 5 Volcano map of differentially expressed genes
这些DEGs进行GO富集分析(Fig 6)。与DMC组比较,DMG组的DEGs主要富集于细胞质(cytoplasm),中性粒细胞趋化性(neutrophil chemotaxis),趋化因子活性(chemokine activity),参与细胞凋亡执行阶段的半胱氨酸型内肽酶活性(cysteine-type endopeptidase activity involved in execution phase of apoptosis)等条目上。与DMG组比较,TMP治疗组的DEGs主要富集于炎症反应(inflammatory response),转录因子复合物(transcription factor complex),生长因子活性(growth factor activity)等生物学功能。
2.6.4差异表达基因KEGG注释分类及通路富集分析 利用KEGG数据库对DEGs进行功能注释分类、通路富集。与DMC组比较,DMG组DEGs主要注释及富集在MAPK信号通路(MAPK signaling pathway),细胞凋亡(apoptosis),NF-κB信号通路(NF-kappa B signaling pathway),p53信号通路(p53 signaling pathway),瞬时受体电位通道的炎症介质调节(inflammatory mediator regulation of TRP channels)等。
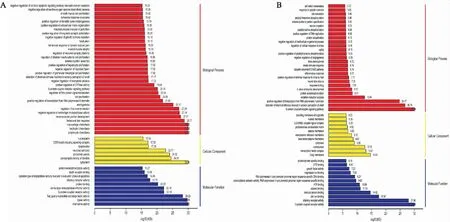
Fig 6 GO enrichment map of differentially expressed genes

Tab 5 KEGG pathway and up-regulated genes of DMC vs DMG

Tab 6 KEGG pathway and down-regulated genes of DMG vs TMP
与DMG组相比较,给予TMP治疗后显示出的DEGs主要注释及富集在细胞因子-细胞因子受体相互作用(cytokine-cytokine receptor interaction),氧化磷酸化(oxidative phosphorylation),MAPK信号通路(MAPK signaling pathway),Toll样受体信号通路(Toll-like receptor signaling pathway),白细胞介素-17信号通路(IL-17 signaling pathway),细胞凋亡-多物种(apoptosis -multiple species)。
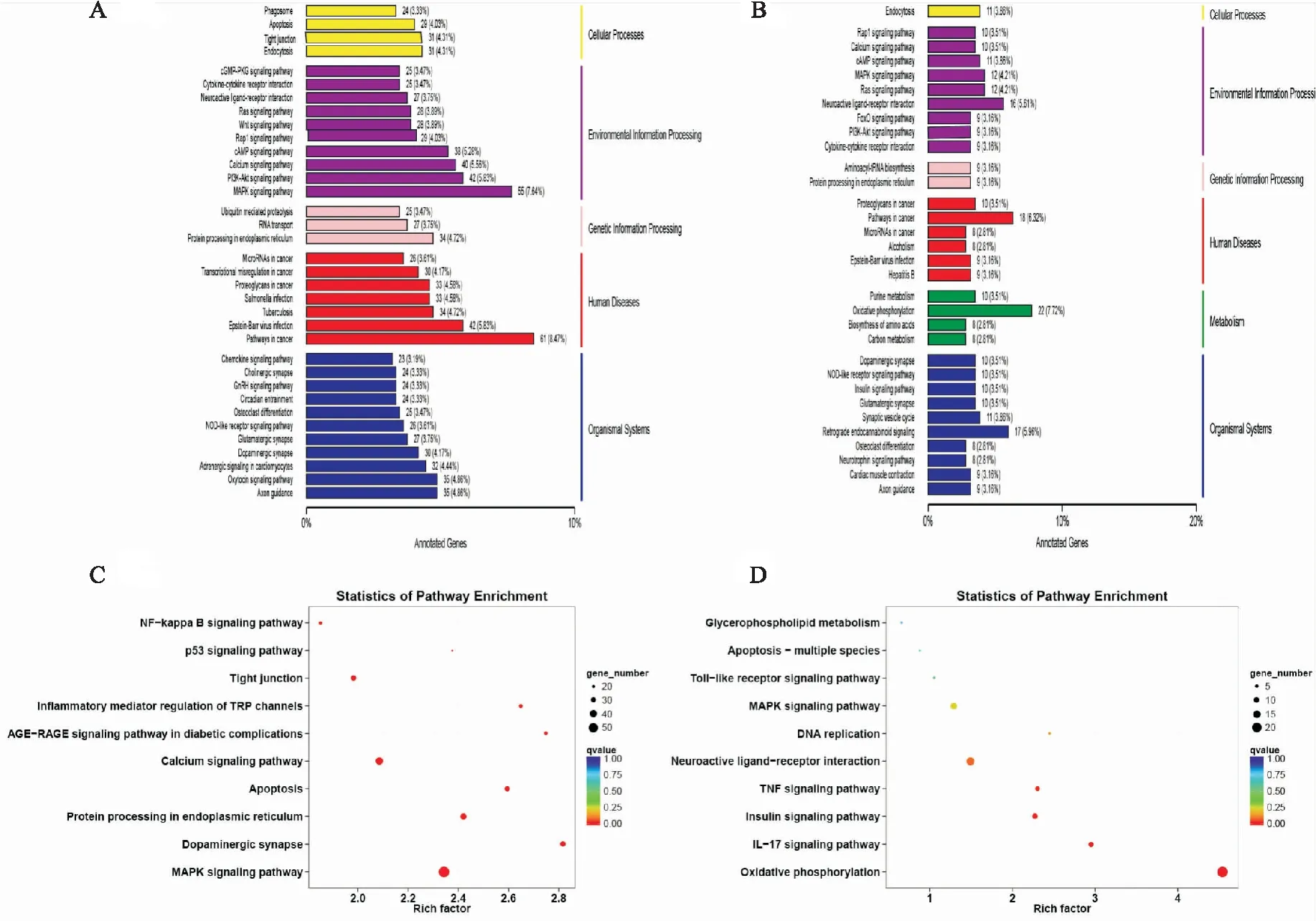
Fig 7 KEGG annotation classification and pathway enrichment map of differentially expressed genes
2.6.5小结 GO富集分析显示,DM脑I/R后DEGs主要富集于中性粒细胞趋化性、趋化因子活性、参与细胞凋亡执行阶段的半胱氨酸型内肽酶活性等条目上;KEGG通路注释及富集分析显示DEGs主要富集于MAPK、NF-κB、p53等炎症、凋亡相关信号通路,其中主要上调的基因有TLR2、MyD88、NF-κB、IL-1β、Caspase-3、CXCL1、CCL2、ICAM1等。提示我们,DM脑I/R后趋化因子、细胞间黏附分子1、炎症因子等炎症相关基因及凋亡基因表达上调。而在TMP治疗组,GO富集分析显示DEGs主要富集于炎症反应、转录因子复合物等条目上;KEGG通路注释及富集分析显示DEGs主要富集于Toll样受体、MAPK、IL-17、细胞凋亡-多物种等炎症、凋亡相关信号通路。其中主要下调的基因有TLR2、MyD88、IL-1β、Caspase-3、CXCL12、CCL27等基因。提示TMP治疗可以下调炎症相关的基因与凋亡基因的表达。以上结果提示,我们TMP抗DM脑I/R损伤的机制可能与其减轻炎症反应、细胞凋亡相关。因此我们对部分凋亡与炎症相关的基因进行了实验验证。
2.7 TMP对DM大鼠脑I/R损伤凋亡相关基因mRNA、蛋白表达的影响结果显示,与NC组比较,NG组Caspase-3 mRNA及蛋白表达明显上调,Bcl-2 mRNA、蛋白表达明显下调,差异具有统计学意义(P<0.05)。与NG组相比,DMG组Caspase-3 mRNA及蛋白表达明显升高,Bcl-2明显降低(P<0.05)。而TMP治疗后Caspase-3 mRNA及蛋白表达明显降低,Bcl-2明显升高(P<0.05)。
2.8 TMP对DM大鼠脑I/R损伤炎症相关基因mRNA、蛋白表达的影响结果显示,与NC组比较,NG组TLR2、MyD88、NF-κB p65、IL-1β、IL-6 mRNA及蛋白表达明显上调,差异均具有统计学意义(P<0.05)。与NG组相比,DMG组TLR2、MyD88、NF-κB p65、IL-1β、IL-6 mRNA及蛋白表达进一步上调(P<0.01)。而TMP治疗后明显逆转上述基因mRNA、蛋白表达的上调(P<0.01)。
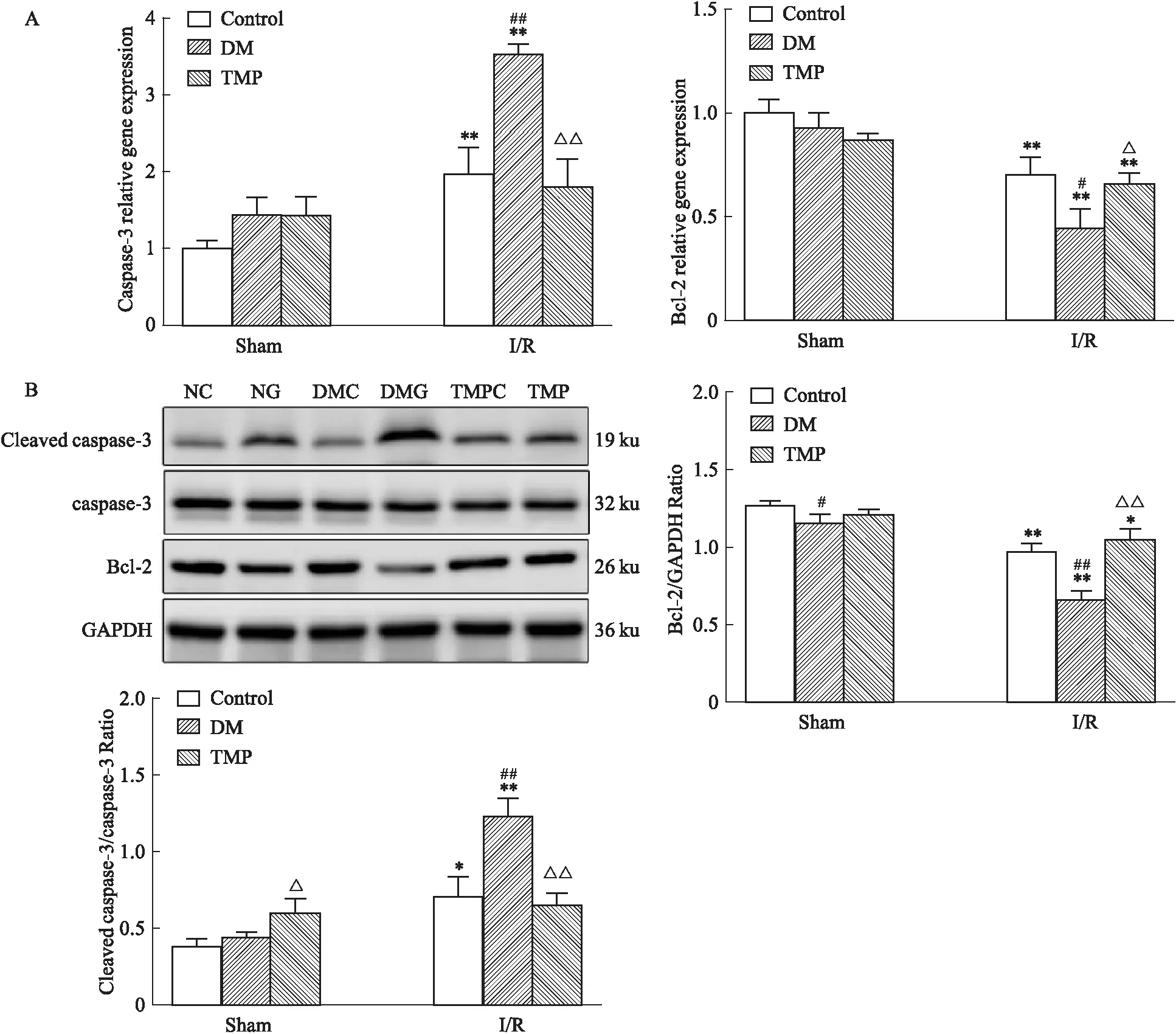
Fig 8 Detection of mRNA and protein expression

A:RT-qPCR to detect the expression of Caspase-3,Bcl-2 mRNA in rats;B:Western blot to detect the expression of Cleaved caspase-3,Bcl-2 protein in rats.*P<0.05,**P<0.01vsSham group;#P<0.05,##P<0.01 DMvsControl group;△P<0.05,△△P<0.01 TMPvsDM group..
3 讨论
多项研究报道,中药川芎提取物TMP能够改善脑I/R损伤[5-6]。本研究发现,在经历脑缺血后,DM组大鼠较正常血糖组大鼠神经损伤明显加重,表现在脑水肿增加,神经元、尼氏体数目减少,细胞坏死率、凋亡率增高,而TMP治疗可减轻其脑水肿程度,增加神经元、尼氏体数目,并且显著减少细胞坏死和凋亡,显示出良好的抗DM脑缺血作用。
细胞凋亡是一种相对有序的能量依赖性的程序性细胞死亡过程。细胞凋亡的激活一般有内在和外在两种途径。无论哪种途径,最终都会激活凋亡反应最为关键的执行者Caspase-3[7-8]。Zhong等[9]的研究表明,TMP通过抑制JNK/MARK信号通路介导的细胞凋亡保护海马神经元免受缺氧/复氧损伤。本研究中,DM大鼠脑I/R后及TMP治疗后DEGs亦主要富集于细胞凋亡相关的生物学过程与信号通路。如DM大鼠脑I/R皮层Caspase-3表达上调,而TMP治疗后其表达下调。RT-qPCR与Western blot验证结果同样显示:DM大鼠脑I/R后皮层Caspase-3 mRNA及蛋白表达明显增强,Bcl-2 mRNA及蛋白表达明显减弱;TMP治疗后Caspase-3 mRNA及蛋白表达明显减弱,Bcl-2 mRNA及蛋白表达明显增强,与转录组测序结果基本一致。结合TUNEL染色结果,我们认为DM通过加重大鼠脑I/R后的细胞凋亡加重了缺血脑组织的损伤,而TMP可能通过抑制凋亡减轻了DM大鼠脑I/R后的病理损伤。
炎症级联反应在脑I/R损伤机制中占据关键地位。此外,全身和脑血管炎症增加是DM及其血管并发症主要的病理生理特征之一[10]。DM合并脑缺血时,脑组织受到高血糖与缺血缺氧双重因素影响,其炎症反应可能会大大加重。过量的炎症反应会引发神经细胞凋亡,形成恶性循环,加剧组织损伤。本研究中,GO富集分析显示DM大鼠脑I/R后及TMP治疗后DEGs主要富集于炎症反应等条目上。
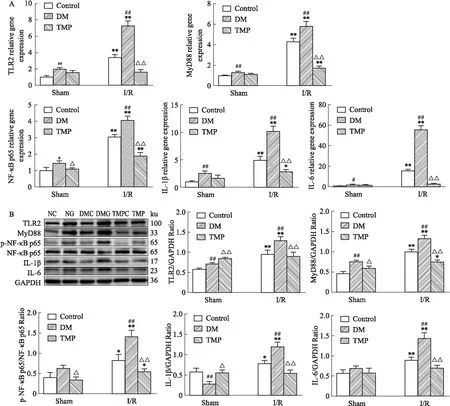
Fig 9 Detection of mRNA and protein expression of inflammation-related genes in rats by RT-qPCR and Western
KEGG分析提示,DM脑I/R后IL-1β基因上调,TMP治疗后IL-1β基因下调,进一步做RT-qPCR与WB结果显示DM大鼠脑I/R后大脑皮质IL-1β、IL-6 mRNA及蛋白表达较正常血糖大鼠脑I/R明显增强,而TMP治疗后,IL-1β、IL-6 mRNA及蛋白表达明显减弱。提示我们DM可能通过加重炎症反应加重脑I/R损伤,TMP治疗减轻了DM加重的脑I/R损伤的炎性反应。
DM能够通过诱导慢性炎症促进动脉粥样硬化斑块形成从而加重卒中风险,其发生的关键机制包括依赖NF-κB的促炎细胞因子产生、Toll样受体(toll like receptors,TLRs)的表达、氧化应激的增加和炎症小体的激活[10-11]。TLRs是一个在先天免疫系统中扮演重要角色的分子家族。在TLRs家族中,TLR2与TLR4在脑I/R损伤炎症反应中占据主要地位。细胞外信号主要通过依赖MyD88和不依赖MyD88的途径传递到下游模块。而TLR2主要通过依赖MyD88的途径传递信号。MyD88可激活白细胞介素-1受体相关激酶4、白细胞介素-1受体相关激酶1从而进一步刺激下游NF-κB信号通路的激活[12]。激活后的NF-κB通路促进大量促炎基因表达,如IL-1β、IL-6、趋化因子等从而加重脑缺血后的炎症反应。实验发现,丹酚酸A通过抑制TLR2的激活减轻急性脑I/R时小胶质细胞介导的炎症反应[13]。此外,研究报道TMP可以通过减轻炎症反应改善脑I/R损伤[14]。本研究中,GO与KEGG分析显示TMP治疗后,DEGs主要富集于Toll样受体、IL-17等炎症相关生物学过程与信号通路上,且TMP下调了TLR2、MyD88的表达。RT-qPCR与WB验证结果显示,TMP治疗明显降低了DM大鼠脑I/R后大脑皮质TLR2、MyD88、NF-κB mRNA和蛋白的高表达,进一步证实了TMP对DM大鼠脑I/R损伤的抗炎作用,其机制可能是通过抑制TLR2/MyD88/NF-κB信号通路来实现的。
综上所述,本研究发现TMP可以有效减轻DM脑I/R损伤,其机制可能与抑制TLR2/MyD88/NF-κB信号通路减轻炎症反应、细胞凋亡相关。以上结果为DM加重脑I/R损伤的机制研究提供了依据,也为运用转录组学及蛋白质组学、代谢组学等组学技术深入、深化中医药药理机制提供了思路。