芒果苷对MKR小鼠肥胖症合并2型糖尿病的作用
刘 旭,谭丹妮,向 琴,苏丽清,刘 秀,喻 嵘,
(1.湖南中医药大学中医学院,2.中医方证研究转化医学湖南省重点实验室,湖南 长沙 410208)
随着生活水平的提高,肥胖症人群日益增加,肥胖症是诱发多种疾病,如2型糖尿病(type 2 diabetes mellitus,T2DM)、高血压、心脏病、脂肪肝、中风与某些恶性肿瘤的基础疾病[1]。肥胖症与T2DM都容易导致心血管异常,二者同时出现使心血管并发症、心力衰竭的风险进一步增加[2],因此研究治疗肥胖症合并T2DM,对提高患者生存质量、改善机体代谢功能、降低心血管事件带来的死亡风险,具有临床价值。肥胖症与T2DM具有共同的病理基础——胰岛素抵抗(insulin resistance,IR),研究发现,肥胖症患者的脂肪组织,尤其是内脏脂肪组织中发生的炎症反应,导致脂肪组织自身与肝脏等胰岛素敏感器官对胰岛素敏感性降低产生IR[3-5],最终导致T2DM的发生。芒果苷(mangiferin,MGF)提取自百合科植物知母(AnemarrhenaasphodeloidesBge.),是中药知母中重要的有效成分。自1960年首次报道了对MGF的研究,目前MGF已被证实影响多个生物学过程,包括线粒体生物能学、糖酵解、脂肪生成等,还具有抗氧化、抗炎、抗高脂血症、抗高血糖和抗癌作用[6]。骨骼肌特异性胰岛素样生长因子-1受体功能缺失(loss of skeletal muscle-specific insulin-like growth factor-1 receptor function,MKR)鼠是一种以FVB/N鼠为背景的转基因糖尿病小鼠,是研究T2DM的成熟的模型动物[7-8]。本实验采取高脂饮食(high fat diet,HFD)喂养结合链脲佐菌素(streptozotocin,STZ)干预的方式作用于MKR小鼠,诱导形成肥胖症合并T2DM的疾病模型,探讨芒果苷对该复合型疾病模型的作用,为芒果苷的临床研究提供依据。
1 材料与方法
1.1 动物MKR小鼠由美国国立卫生研究院糖尿病研究中心提供,饲养于湖南中医药大学SPF级实验动物中心[SYXK(湘)2013-0005]。FVB/N小鼠购自北京斯贝福生物技术公司[SCXK(京)2019-0010]。小鼠被安置于控温、通风、标准化的动物房,可自由获取食物(啮齿动物饲料)和水。所有小鼠均按照湖南中医药大学实验动物中心《实验动物饲养使用指南》的标准进行饲养。涉及活体动物的实验方案于2020年12月29日获得湖南中医药大学实验动物中心许可,伦理审查批号[ZYFY20201229]。
1.2 药品与试剂芒果苷(CAS号:4773-96-0,批号:2473,HPLC≥98%)购于上海诗丹德标准技术服务有限公司;盐酸二甲双胍片(深圳市中联制药有限公司,国药准字:H44024853,批号2012008,0.25 g/片),门冬胰岛素(北京诺和诺德公司,批号21047),购自湖南中医药大学第一附属医院门诊西药房;STZ(批号20210316)购自北京索莱宝公司;小鼠胰岛素酶联免疫吸附检测试剂盒(批号210415)购自上海碧云天公司;白介素-6(interleukin-6,IL-6)检测试剂盒(批号F26031595)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)检测试剂盒(批号F27031596)、白介素-1β(interleukin-1β,IL-1β)检测试剂盒(批号G13031594)购自武汉华美生物公司;TNF-α抗体(批号17590-1-AP)、IL-6抗体(批号66146-1-Ig)、IL-1β抗体(批号26048-1-AP)、GAPDH抗体(批号10494-1-AP)、山羊抗小鼠IgG(批号SA00001-1)、山羊抗兔IgG(批号SA00001-2)购自美国ProteinTech公司;二甲基亚砜(Dimethyl sulfoxide,DMSO)购自美国Sigma Aldrich公司;脂肪固定液购自武汉赛维尔生物公司;高脂饲料XTHF60(含60%脂肪20%蛋白质)购自江苏协同生物公司。
1.3 仪器GA-3型血糖仪(三诺生物公司);高速冷冻离心机(湖南湘仪实验室仪器开发有限公司);全自动酶标洗板机、多功能酶标分析仪(深圳市汇松科技发展有限公司);电热恒温培养箱(北京市永光明医疗仪器有限公司);电泳及转膜系统(北京六一公司);电子天平(美国双杰);显微镜(日本Olympus公司)。
1.4 方法
1.4.1分组、造模与给药 如实验流程示意图(Fig 1)所示,40只4周龄MKR小鼠,雌雄对半,给予高脂饮食4周,腹腔注射STZ溶液(40 mg·kg-1,用pH 4.0柠檬酸-柠檬酸钠缓冲液制备,现用现配),连续5 d。尾静脉采血测量空腹血糖(fasting blood glucose,FBG),以空腹血糖≥11.1 mmol·L-1视为造模成功。40只MKR小鼠随机分为5组,分别为模型组(Model)、二甲双胍组(metformin,MET)、芒果苷低剂量组(mangiferin low-dose,MGF-L)、芒果苷中剂量组(mangiferin medium-dose,MGF-M)、芒果苷高剂量组(mangiferin high-dose,MGF-H),每组8只。按小鼠与人体表面积等效剂量折算法,折算MET临床等效剂量为0.11 g·kg-1。MGF低、中、高剂量组分别给予25、50、100 mg·kg-1。8只7周龄FVB/N小鼠购入后,以普通饲料适应性喂养2周,作为对照组(Control)。MGF溶于10% DMSO(PBS缓冲液稀释),配制成质量浓度为2.5、5、10 g·L-1的溶液,对应MGF低、中、高剂量组,临用前在水浴超声锅内超声15 s以使其充分溶解,按照每只小鼠给药体积200 μL取药。实验过程中,对照组采用普通饲料喂养,其余各组全程保持高脂饲料喂养;各治疗组ig相应剂量药物,对照组和模型组ig 200 μL 10% DMSO,每天1次,连续5周。
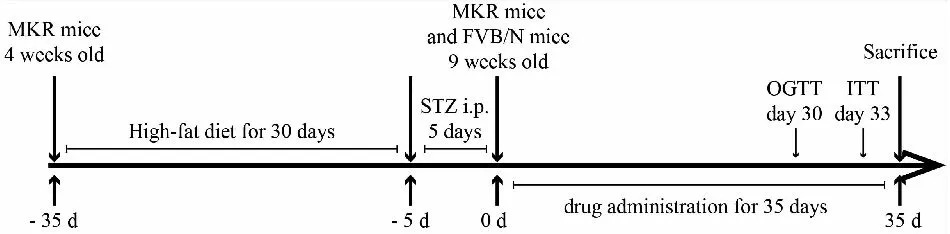
Fig 1 Scheme of treatment of obesity and T2DM using MKR mice as models and FVB/N mice as controls
1.4.2芒果苷对MKR小鼠体质量的影响 给药过程中,每周使用小动物体质量秤记录空腹体质量,直至给药结束。
1.4.3芒果苷对MKR小鼠糖代谢的影响 给药过程中,使用血糖仪,经尾静脉采血,每周测量一次空腹血糖;给药d 30进行口服糖耐量试验(oral glucose tolerance test,OGTT),禁食不禁水12 h,测量空腹血糖水平后,ig葡萄糖溶液(2 g·kg-1),在初始糖负荷后于15、30、60、120 min等时间点测量血糖,并计算120 min 曲线下面积 (area under the curve,AUC)。于给药d 33,进行胰岛素耐量试验(insulin tolerance test,ITT),小鼠禁食3 h,测量空腹血糖水平后,腹腔注射胰岛素(0.5 U·kg-1),然后在15、30、45、60 min等时间点测量血糖,并计算各组AUC。胰岛素用生理盐水稀释,现用现配;末次给药后,通过眼眶采血,获得血清后按照试剂盒说明书操作测定小鼠血清胰岛素水平。
1.4.4芒果苷对MKR小鼠脂代谢的影响 末次给药结束后,通过眼眶采血获得血清,进行血脂4项分析,包括总胆固醇(total cholesterol,CHOl)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)。以上生化分析均在湖南中医药大学第一附属医院医学检验中心完成。
1.4.5芒果苷对MKR小鼠全身性炎症水平的影响 末次给药结束后,通过眼眶采血获得血清,按照试剂盒操作说明测定小鼠血清中TNF-α、IL-1β、IL-6等炎性因子的水平。
1.4.6芒果苷对MKR小鼠肝脏组织病理变化的影响 将获得的新鲜肝脏组织置于4%多聚甲醛中固定,脱水、透明后,用石蜡包埋。切片和烘干后,用二甲苯与一系列梯度浓度的乙醇(100%、95%、75%)脱蜡,然后将组织切片进行HE染色、Masson染色。一部分经4%多聚甲醛固定后的肝脏组织,置于15%蔗糖水中,4 ℃浸泡至沉底,转移入30%蔗糖水浸泡至沉底,然后用樱花冷冻切片包埋剂包埋。用冷冻切片机切成6~8 μm厚度切片后进行油红O染色。最后在显微镜下观察并拍照。
1.4.7芒果苷对MKR小鼠肝脏损伤水平的影响 由湖南中医药大学第一附属医院医学检验中心检测分析小鼠血清中谷氨酸转氨酶(alanine transaminase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)的水平。
1.4.8芒果苷对MKR小鼠脂肪组织病理变化的影响 收集小鼠腹腔内性腺组织附属的脂肪组织,置于脂肪组织固定液中固定24 h以上,脱水、透明后,用石蜡包埋。切片和烘干后,用二甲苯与一系列梯度浓度的乙醇(100%、95%、75%)脱蜡,然后将脂肪组织切片进行HE染色。最后在显微镜下观察并拍照。
1.4.9芒果苷对MKR小鼠脂肪组织TNF-α、IL-1β、IL-6蛋白表达的影响 剪取适量脂肪组织,用SDS裂解液在生物样品均质仪中碾磨裂解脂肪组织,提取总蛋白。蛋白上清与loading buffer混匀并煮沸,制备变性蛋白待用。电泳2.5 h,转膜后用5%脱脂奶粉封闭,4 ℃过夜。加入一抗TNF-α(1 ∶1 000)、IL-1β(1 ∶1 000)、IL-6(1 ∶3 000)、GAPDH(1 ∶3 000)孵育90 min,用PBST洗涤3次,加入二抗HRP goat anti-mouse IgG(1 ∶5 000)、HRP goat anti-rabbit IgG(1 ∶6 000)孵育90 min。最后用ECL化学发光液显色,在化学发光成像系统仪内拍照。

2 结果
2.1 芒果苷对MKR小鼠体质量的影响与对照组比较,模型组小鼠体质量明显增加(P<0.01);与模型组比较,在给药d 28,MET组小鼠体质量出现明显减轻(P<0.05),给药d 35,MET组与MGF高剂量组小鼠体质量均明显减轻(P<0.05),MGF低、中剂量组小鼠体质量变化无统计学差异;与MET组比较,MGF低、中、高剂量组小鼠体质量变化均无统计学差异(Tab 1)。
2.2 芒果苷对MKR小鼠糖代谢的影响与对照组比较,模型组小鼠在实验中全程处于高血糖状态(P<0.01);给药d 28,与对照组比较,MGF低剂量组小鼠血糖呈明显高水平(P<0.01),MGF中剂量组小鼠血糖有所下降(P<0.05),MET组与MGF高剂量组小鼠空腹血糖水平与对照组间无统计学差异;给药d 35,与对照组比较,除MGF低剂量组小鼠呈明显的高血糖状态(P<0.05),其余治疗组小鼠空腹血糖与对照组间无统计学差异。与模型组比较,给药d 7 MET组小鼠空腹血糖水平下降(P<0.05),给药d 14至实验结束时,各治疗组小鼠空腹血糖均显著下降(P<0.01)。MGF各剂量治疗组与MET组比较,无统计学差异(Tab 2)。
OGTT试验中,于0 min检测各组小鼠空腹血糖,与对照组比较,模型组与MGF低剂量组小鼠呈显著高血糖水平(P<0.01或P<0.05);与模型组比较,各治疗组小鼠空腹血糖均明显下降(P<0.01);与MET组比较,MGF各剂量组小鼠血糖无统计学差异。糖负荷30 min,与对照组比较,模型组与各治疗组小鼠血糖均明显上升(P<0.01);与模型组比较,各治疗组小鼠血糖水平低于模型组(P<0.01);与MET组比较,MGF低、中剂量组小鼠血糖升高明显(P<0.01),MGF高剂量组小鼠血糖与MET组无统计学差异。糖负荷60 min,与对照组比较,MET组小鼠血糖下降(P<0.05),模型组与其余各治疗组小鼠血糖呈较高水平(P<0.01);与模型组比较,各治疗组小鼠血糖均明显下降(P<0.01);与MET组比较,MGF低剂量组小鼠血糖水平较高(P<0.05),MGF中、高剂量组小鼠血糖与MET组间无统计学差异。糖负荷120 min,与对照组比较,模型组与MGF低剂量组小鼠呈高血糖状态(P<0.01),MGF中剂量组小鼠血糖较高(P<0.05),MET组与MGF高剂量组小鼠血糖回落与对照组间无统计学差异;与模型组比较,所有治疗组小鼠血糖均明显回落(P<0.01);MGF低、中、高剂量组小鼠血糖水平与MET组比较无统计学差异(Fig 2A)。计算并比较各组AUC,与对照组比较,模型组AUC明显增加(P<0.01),各治疗组AUC接近对照组,无统计学差异;与模型组比较,各治疗组AUC均显著降低(P<0.01);与MET组比较,MGF低剂量组与中剂量组AUC较高(P<0.01或P<0.05),MGF高剂量组AUC与MET组接近,无统计学差异(Fig 2B)。
ITT试验中,对照组小鼠注射胰岛素后血糖迅速下降,30 min处血糖约为0 min处血糖的52%,然后血糖逐渐回升至注射前的70%;模型组小鼠血糖虽有下降,但整体趋势平缓,30 min处血糖降幅不足20%,并且快速回升至0 min处水平;MET组与MGF高剂量组在注射胰岛素后血糖下降明显,30 min处MET组与MGF高剂量组血糖水平较0 min处下降35%左右,MET组较MGF高剂量组下降更为明显,然后缓慢上升,45 min处MGF高剂量组血糖回升幅度较MET组略低,60 min处MGF高剂量组血糖回升至0 min处的87%,MET组血糖回升低于MGF高剂量组;MGF低、中剂量组血糖在30 min处下降约25%,60 min时基本回升至0 min时的血糖水平(Fig 2C)。与对照组比较,模型组AUC显著增加(P<0.01);与模型组比较,各治疗组AUC明显减少(P<0.01);与MET组比较,MGF低剂量组AUC较高(P<0.05),MGF中、高剂量组AUC接近MET组无统计学差异(Fig 2D)。
Tab 1 Effects of MGF on body weight of MKR mice
给药35 d后,检测各组血清胰岛素含量。与对照组比较,模型组小鼠血清胰岛素含量明显下降(P<0.01);与模型组比较,MET组与MGF高剂量组小鼠血清胰岛素含量明显增加(P<0.01),MGF中剂量组小鼠胰岛素含量增加(P<0.05),MGF低剂量组与模型组间无统计学差异;与MET组比较,MGF低、中剂量组小鼠血清胰岛素含量低(P<0.01),MGF高剂量组胰岛素含量与MET组间无统计学差异(Tab 2)。
2.3 芒果苷对MKR小鼠脂代谢的影响给药35 d后,与对照组比较,模型组小鼠血清TG含量明显升高(P<0.01);与模型组比较,各治疗组小鼠血清TG含量明显降低(P<0.01);与MET组比较,MGF各剂量组小鼠血清TG含量不具有统计学差异。此外,除模型组小鼠LDL-C含量较对照组显著升高(P<0.01),其余各组LDL-C含量无统计学差异。比较各组间小鼠血清CHOl、HDL-C含量差异,不具有统计学差异(Fig 3)。
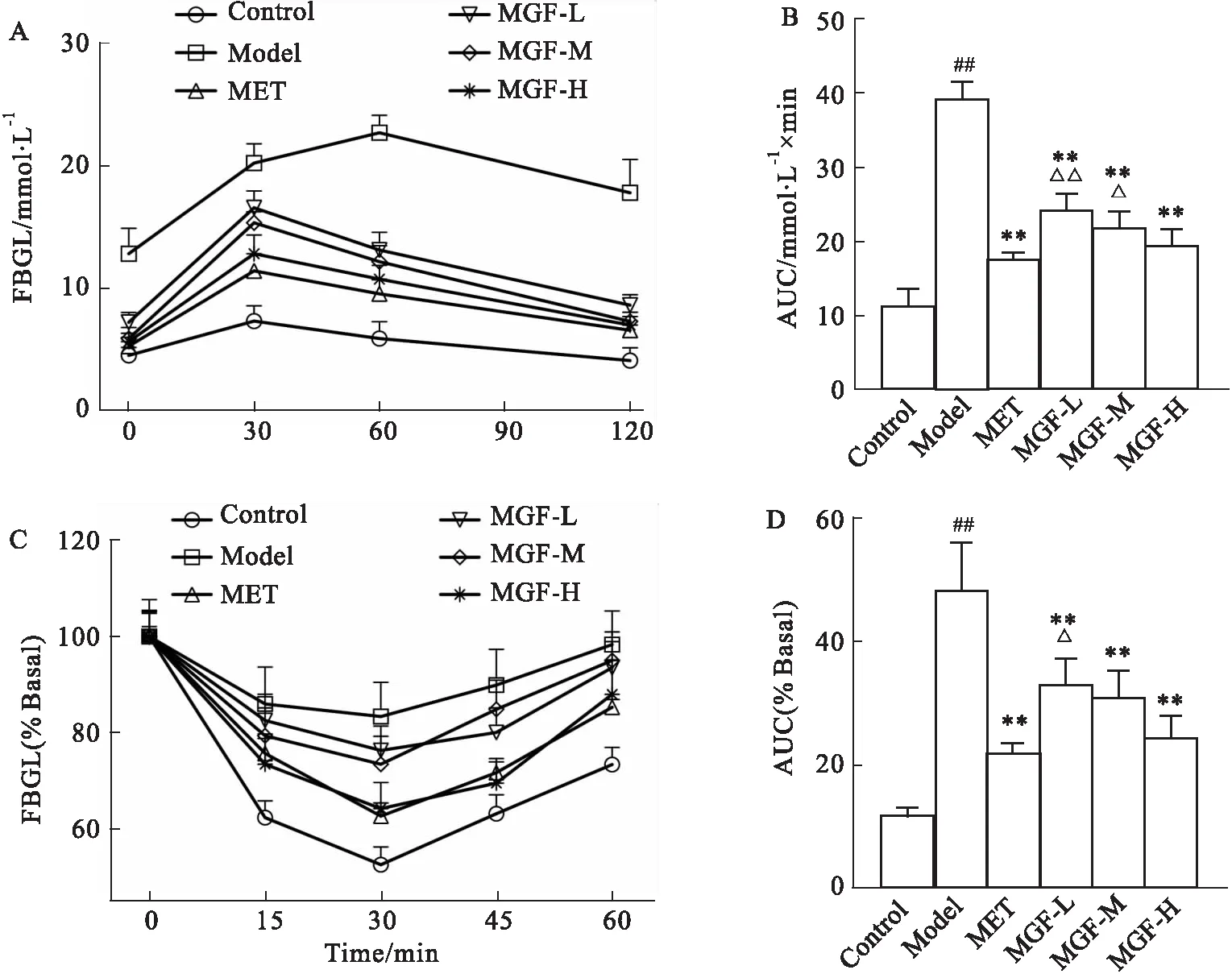
Fig 2 Effect of MGF on OGTT and ITT in MKR
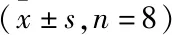
Tab 2 Effects of MGF on serum insulin and FBG in MKR mice

Fig 3 Effects of MGF on lipid metabolism
^
2.4 芒果苷对MKR小鼠全身性炎症水平的影响给药35 d后,与对照组比较,模型组小鼠血清TNF-α、IL-6含量上升(P<0.05或P<0.01);与模型组比较,MET组与MGF高剂量组小鼠血清TNF-α、IL-6含量下降(P<0.05或P<0.01),MGF中剂量组小鼠血清IL-6含量下降(P<0.05);与MET组比较,MGF各剂量组小鼠血清TNF-α与IL-6含量不具有统计学差异(Fig 4)。
2.5 芒果苷对MKR小鼠肝脏组织病理变化的影响给药35 d后,病理切片图显示,对照组小鼠肝脏组织质地致密,肝小叶、肝索结构清晰、排列规则,肝细胞形态正常,细胞核完整、均匀。模型组HE染色可见肝脏质地疏松,肝小叶、肝索结构不清晰、排列不规则,肝细胞发生细胞核漂移,并可见小疱性脂肪变性;肝脏油红O染色显示细胞质中存在广泛且过量的脂质蓄积;Masson染色可见肝窦周围出现纤维结缔组织增生。与模型组比较,各治疗组小鼠肝脏组织病理改变均得到一定程度的改善(Fig 5)。
2.6 芒果苷对MKR小鼠肝脏损伤水平的影响给药35 d后,与对照组比较,模型组小鼠血清ALT、AST含量均明显上升(P<0.01);与模型组比较,各治疗组小鼠血清ALT含量均明显下降(P<0.01),MET组与MGF高剂量组小鼠血清AST含量明显下降(P<0.01或P<0.05),MGF低、中剂量组AST含量较模型组无统计学差异;与MET组比较,MGF低剂量组小鼠血清ALT、AST含量高(P<0.01),MGF中剂量组小鼠血清ALT含量较高(P<0.05),MGF高剂量组与MET组间无统计学差异(Fig 6)。
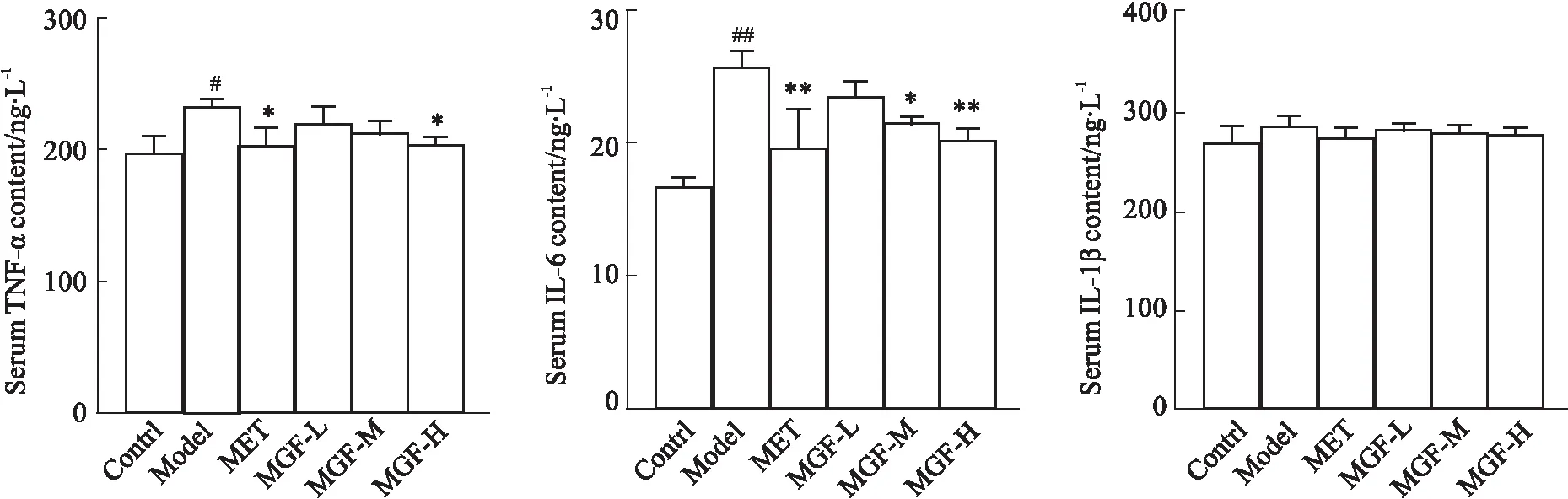
Fig 4 Effects of MGF on inflammation in MKR
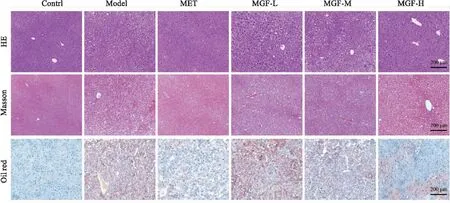
Fig 5 Effects of MGF on liver pathological changes in MKR mice(100×)
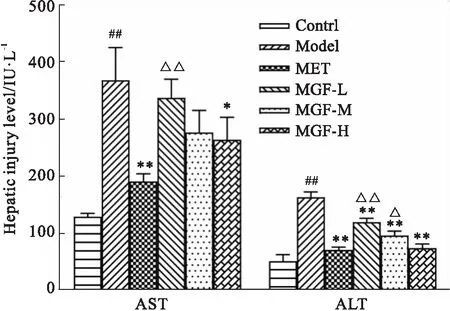
Fig 6 Effects of MGF on hepatic injury in MKR
2.7 芒果苷对MKR小鼠脂肪组织病理变化的影响给药35 d后,HE染色显示,对照组小鼠的脂肪组织中以脂肪细胞为主,脂肪细胞大小均等、排列整齐、质地致密;模型组小鼠的脂肪细胞大小不一,排列紊乱、质地稀松,并且可见大量簇集的促炎型巨噬细胞形成冠状结构(crown-like structures,CLS)包围在凋亡的脂肪细胞周围;与模型组比较,MGF低、中剂量组小鼠的脂肪组织中仍见较多凋亡的脂肪细胞与不同程度的炎性细胞浸润,脂肪细胞大小不一、排列不齐、质地较为疏松;与模型组比较,MET组与MGF高剂量组小鼠的脂肪细胞形态明显改善,大小趋于均等、排列有序,凋亡的脂肪细胞明显减少、炎性浸润明显缓解,但是相较于对照组,MET组与MGF高剂量组受高脂饮食导致的肥胖症影响,单个脂肪细胞体积较大、脂肪组织质地偏疏松(Fig 7)。
2.8 芒果苷对MKR小鼠脂肪组织TNF-α、IL-6、IL-1β蛋白表达的影响给药35 d后,Western blot结果显示,与对照组比较,模型组小鼠脂肪组织中TNF-α、IL-6、IL-1β蛋白表达均明显升高(P<0.01);与模型组比较,MET组与MGF高剂量组小鼠脂肪组织的TNF-α、IL-6、IL-1β蛋白表达均明显下降(P<0.01)(Fig 8)。
3 讨论
肥胖增加了许多疾病的发生风险,虽然其根本机制尚未完全清晰,但是在过去的研究中,科研人员已认识到肥胖与其他各种组织的慢性低度炎症密切相关,包括脂肪组织(adipose tissue,AT)、骨骼肌、肝脏、胰岛、肠道甚至大脑[9]。巨噬细胞存在于AT中,巨噬细胞的数量与脂肪细胞大小和机体体质量呈正相关,大量的巨噬细胞围绕在凋亡或垂死的脂肪细胞周围,形成CLS,并且分泌多种炎性因子,如TNF-α、IL-1β、IL-6,使其自身表型由抗炎M2型极化为促炎M1型[10]。众多研究结论表明,炎症在IR的发生发展中扮演关键角色,肥胖一旦发生,肥胖相关的炎症与IR相互影响促使对方进一步恶化。AT中的炎症一方面作用于脂肪细胞的胰岛素信号与代谢;另一方面作用于其他胰岛素敏感器官,例如肝脏与骨骼肌,从而诱发AT自身性与机体全身性的IR。同时,炎症可加速脂肪从AT中溢出,最终导致肝脏等胰岛素敏感器官发生脂肪异位沉积与IR,从而在加速全身性IR和诱发T2DM中发挥重要作用[3-5]。实验表明减少小鼠AT中的炎性因子可有效改善IR[11]。
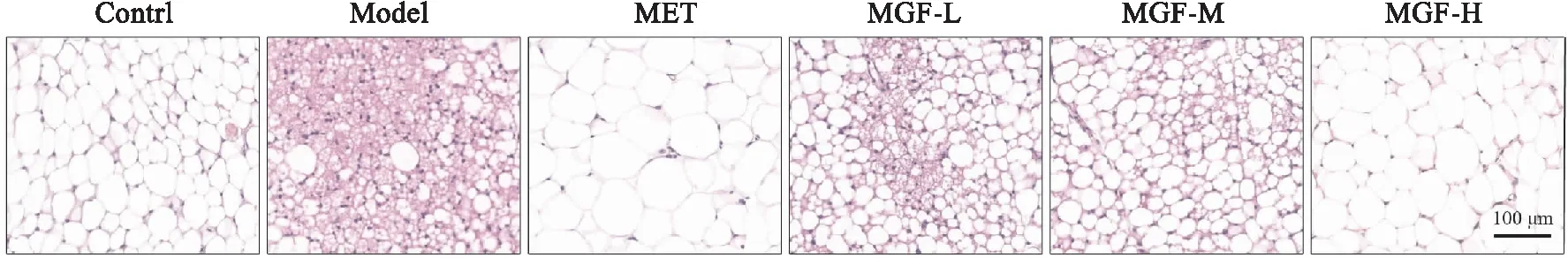
Fig 7 Effects of MGF on adipose pathological changes in MKR mice (200×)
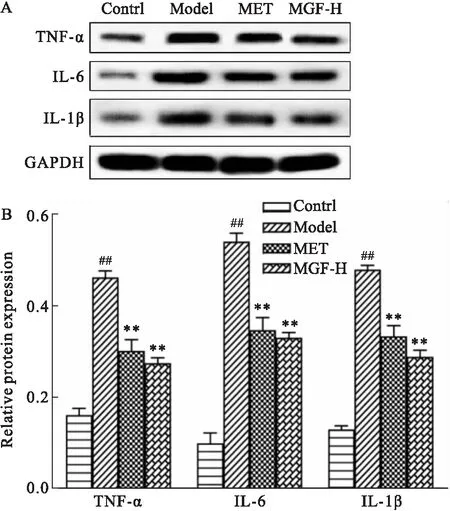
Fig 8 Effects of MGF on expression of inflammatory factors in adipose tissues of MKR mice
由于炎症在肥胖症及T2DM中的重要作用,靶向作用于炎症成为治疗肥胖症合并T2DM的一项新疗法。在测试抗炎药物对IR和T2DM治疗效果的前期临床实验中已经出现一些有希望的结果[12],同时,抗炎药物的新应用仍然存在着巨大挑战,在一些具有T2DM或代谢综合征病史的患者中出现较多不良事件[13],以及这些抗炎药物的肝肾毒性进一步损害肝脏的胰岛素敏感性与代谢功能。中医药治疗糖尿病历史悠久,疗效显著,在中药中探索、寻找可从抗炎角度调节、改善肥胖症与T2DM的中药化合物具有重要意义。
MGF为双苯吡酮类化合物,是中药知母中的主要有效成分之一,在知母的根茎中含量约为0.7%[14]。众多实验研究表明,MGF具有抗炎、抗氧化、抗糖尿病,改善胰岛素抵抗、降低血脂等作用[15-16]。实验结果显示,与FVB/N对照组相比,MKR模型组小鼠体质量明显升高、糖脂代谢异常、肝脏损伤明显、全身性及脂肪组织中的炎性表达升高。与模型组比较,各治疗组有不同程度的改善,MGF高剂量组的表现尤为突出。脂肪组织病理学观察及Western blot结果显示,高剂量的MGF明显减轻脂肪细胞的凋亡与炎性浸润,显著抑制脂肪组织中的炎性因子表达,从而有效减少脂肪外溢、缓解机体的胰岛素抵抗。因此,MGF高剂量组小鼠体质量明显减轻,空腹血糖显著下降,糖耐量与胰岛素耐量得到显著改善。同时,MGF显著下调小鼠血清甘油三酯含量,因脂质过度沉积引发的肝损伤得到显著缓解,血生化检验与肝脏组织病理学观察结果支持这一结论。MGF高剂量组小鼠血清AST、ALT含量显著下降,肝脏的脂肪变性、脂质蓄积与纤维化变性得到明显改善,这同样有利于肝胰岛素抵抗的缓解,促进糖耐量的改善。相较于其他已有研究报道的药物[12-13],MGF在肥胖症合并T2DM的治疗中,有效靶向脂肪组织中的炎症,调节糖脂代谢、缓解胰岛素抵抗,具有综合治疗的作用,尤其是MGF对肝损伤的修复与肝功能的保护,更是其有效性、安全性、优越性的体现。但由于MGF的溶解度极低,微溶于乙醇、水,在水中的溶解度仅为0.111 g·L-1[17],同时,MGF在肠道中的生物利用度非常低,仅为1.2%,据此推测这可能是MGF低、中剂量组的效果不稳定不理想,而高剂量的MGF治疗效果最为明显的重要原因。
综上所述,本研究发现芒果苷能够通过减轻MKR小鼠脂肪组织中的炎症反应综合治疗肥胖症合并T2DM,为芒果苷的应用研究提供了证据,也为思考、探索如何提高芒果苷的生物利用率打下基础。