脊髓背角星形胶质细胞Cx43组成的半通道在大鼠急性切口痛中的作用
颜茹芳,李佳璟,查 进,黄焕森,汪灵芝
(广州医科大学附属第二医院麻醉科,广东 广州 510260)
研究表明,大约有86%的患者在接受手术治疗后会明显感受到疼痛。尽管多模式镇痛在临床广泛应用,但患者对手术后急性疼痛的一般治疗手段满意度仍旧低于47%~75%[1]。另有研究显示,约10%~50%的术后急性疼痛在不经恰当的临床治疗后可发展为慢性疼痛[2]。而应用药物或者康复治疗有效地控制术后急性疼痛,可以极大地加快患者的康复并提高患者满意度,已然成为加速康复外科在围术期应用的重要组成部分。因此,探讨术后急性疼痛的发生机制将具有重要的意义。
细胞缝隙连接通道(gap junction,GJ)在20世纪60年代首次发现,其由连接蛋白(connexin,Cx)组成。目前已知Cx有21个亚型,所有已知的Cx亚型在结构上相似,均有4个跨膜域(TM),2个细胞外环(EL),1个细胞内环(CL),1个氨基端(NT)和1个C末端(CT)。6个环绕在一起的Cx蛋白在细胞膜上形成单一膜通道称为半通道(hemichannel)。两个相邻细胞膜上的半通道对接形成GJ。细胞胞浆中分子量<1 ku的小分子物质或者信号分子通过GJ扩散,是细胞之间信号传递的一种重要方式[3]。除此之外,Cx 组成的半通道(hemichannel)本身也具有极其重要的功能,可通过旁分泌或者自分泌方式释放活性物质,如释放ATP、ADP等作用于周围细胞产生作用[4]。
既往研究显示,脊髓星形胶质细胞通过其表达的Cx43及其组成的半通道在慢性神经病理性疼痛的发生和后续维持阶段发挥极其重要的作用[5]。我们通过前期研究发现,Cx43在急性切口痛大鼠脊髓背角中的表达在术后24 h内增加[6]。另有研究表明,通过使用非特异性缝隙连接通道抑制剂CBX可以缓解大鼠急性痛[7],但Cx43半通道在急性痛中是否发挥作用仍未知。因此,本研究拟在急性切口痛大鼠通过鞘内给予特异性Cx43半通道抑制剂Gap19观察Cx43半通道对大鼠急性切口痛的影响及可能的机制。
1 材料与方法
1.1 材料
1.1.1实验动物 SPF级雄性SD大鼠60只,体质量(120~140)g,由广东省医学实验动物中心,生产许可证号:SCXK(粤)2018-0002提供。所有实验操作均遵循美国国立卫生研究院(NIH)的动物实验指南,且通过广州医科大学附属第二医院动物伦理委员会批准。
1.1.2 实验药物与试剂Gap19购于美国TopScience公司;GFAP鼠单克隆抗体(MAB360)购于美国Millipore 公司;Cx43兔多克隆抗体 (ab11370),荧光二抗(ab150113,ab150080)购于美国Abcam公司;TNF-α兔多克隆抗体(17590-1-AP),山羊抗兔二抗(SA00001-2),山羊抗鼠二抗(SA00001-15)购于武汉三鹰;大鼠TNF-α ELISA试剂盒(RTA00)购于美国R&D公司;大鼠IL-1β ELISA试剂盒(1310122),大鼠IL-6 ELISA试剂盒(1310602)购于达科为公司。
1.1.3主要仪器 电泳仪(BIO-RAD,美国),倒置荧光共聚焦显微镜(Leica DM4100,德国),冰冻切片机(Leica DM1600,德国),台式低温离心机(Eppendorf,德国)等。
1.2 实验方法
1.2.1实验分组及干预 取雄性SD大鼠60只,根据随机数字表法分为3组,每组20只,C组:对照-生理盐水组;I组:切口痛-生理盐水组;Gap19组:切口痛+Gap19组。I组和Gap19组均制备趾部急性切口痛模型;C组、I组均于造模手术前30 min鞘内注射生理盐水10 μL,Gap19组则于术前30 min鞘内注射Gap19 10 μL(10 g·L-1)。
1.2.2大鼠趾部切口模型 急性切口痛大鼠模型参考Brennan等[8]的方法制备。采用5%异氟烷诱导大鼠,待大鼠进入麻醉状态后,2%~3%异氟烷维持麻醉,将大鼠固定于恒温动物手术台,固定左后肢,消毒。自大鼠左后跟约0.5 cm处,向远端做一纵行切口,长约1 cm;眼科镊钝性分离肌肉筋膜组织并挑起足底肌肉,再行一次纵向切割(注意不损伤附近血管神经),纱球轻压止血后用5-0尼龙线缝合肌肉皮肤并消毒。术后大鼠干净单笼饲养,保暖,待大鼠苏醒后行后续实验。模型的制备由熟悉模型操作的同一人完成。
1.2.3行为学测定 在造模前1 d、造模后2 h、6 h、24 h、48 h、3 d、7 d随机抽取6只大鼠进行机械缩足反应阈值(mechanical paw withdrawal threshold,MPWT)测定。测定开始前30 min,将大鼠置于金属网上的有机透明玻璃盒内适应实验环境,随后使用一系列标准化的纤维丝(Von Frey纤维丝),采用“up and down”法,用8根不同力度的纤维丝(1.4、2、4、6、8、10、15、26 g)刺激大鼠腓侧即外侧皮肤直至纤维丝弯成S形,保持5~8 s并观察是否出现缩足、舔足等阳性反应。每次刺激间隔30 s。给予大鼠的疼痛刺激从中等力度6 g开始,当该力度无法引起上述阳性反应时,30 s后采用大一级力度的纤维丝继续予以疼痛刺激;如出现阳性反应,则间隔30 s后采用小一级力度的纤维丝,如此反复直到出现第一次骑跨,即阳性和阴性(或阴性和阳性)反应交替时,再连续测量4次。根据Dixon[9]的方法将数据转换为50%PWT[50%PWT(g)=10Xf+κδ,其中Xf=log(f),δ为各纤维丝力度取log后的均差]。
1.2.4Western blot蛋白印迹分析 各组随机抽取4只大鼠,称体质量,腹腔注射1%戊巴比妥钠麻醉,剂量为50 mg·kg-1,颈椎脱臼处理后快速剥离出L4~6节段脊髓组织,在立体显微镜下分离出脊髓背角,称质量裂解后冰上静置20 min,随后离心10 min(4 ℃ 12 000 r·min-1),收集上清液,应用BCA法测定各蛋白样品浓度,随后加入缓冲液配置成同一浓度,99 ℃金属浴10 min后得到蛋白样品。上样电泳,湿转法转膜;5%脱脂牛奶(2.5 g/50 mL)室温封闭1 h,分别加入兔来源Cx43(1 ∶8 000,abcam ab11370)、鼠来源 GFAP(1 ∶2 000,18 Millipore MAB360)、兔来源TNF-α(1 ∶1 000,proteintech 17590-1-AP)和鼠来源β-actin (1 ∶20 000,proteintech 66009-1-Ig),4 ℃过夜;洗去多余一抗,加入HRP标记的山羊抗兔(1 ∶1 0000,proteintech SA00001-2)和山羊抗鼠(1 ∶2 000,CST 7076)于室温孵育1 h。暗室内用ECL全自动凝胶成像仪(勤翔)显像,采用ImageJ软件计算灰度值。
1.2.5免疫荧光染色 各组于术后6 h和7 d随机选取3只大鼠,麻醉后暴露心脏,从心尖穿刺将20ml注射针头插管到达升主动脉,依次灌注预冷后的PBS溶液和4%多聚甲醛,切开背部皮肤,暴露脊柱,并切取脊髓L4~6节段,小心剥除硬脊膜等膜样组织,获得脊髓组织,浸入4%多聚甲醛进行后固定,然后依次浸入10%、20%、30%蔗糖溶液于4 ℃进行浓度梯度脱水。冰冻切片,每片厚30 μm。荧光染色(漂片法):PBST 洗片3次,每次5 min。加入10%山羊血清/0.3%TritonX-100室温轻摇2 h,进行封闭及破膜。弃去封闭液,加入一抗GFAP(1 ∶800,Millipore MAB360)、Cx43(1 ∶500,abcam ab11370)4 ℃孵育过夜。PBST 洗片 3次,每次5 min,加入Alexa Fluor 488标记山羊抗鼠IgG (1 ∶800,abcam ab150113),Alexa Fluor 594 标记山羊抗兔IgG (1 ∶800,abcam ab150080),室温轻摇2h,进行荧光双标染色,注意避光;PBST洗片3次,每次5min,滴加 DAPI及防猝灭剂(abcam,ab104139),室温静置 5min,盖上盖玻片。置于倒置荧光显微镜观察并拍摄图像。使用Image J软件分析测量各组大鼠脊髓背角组织切片在相同倍数视野下红色荧光(代表Cx43)阳性信号及绿色荧光(代表GFAP)阳性信号平均荧光强度Mean gray value。
1.2.6ELISA检测炎症因子含量 随机选取各组术后6 h的3只大鼠,麻醉后暴露脊柱,于立体显微镜下快速剥离脊髓L4~6节段背角组织,称质量后按1 ∶9加入预冷PBS,冰上研磨匀浆,4 ℃ 12 000 r·min-1,离心10 min,吸取上清,使用大鼠TNF-α ELISA Kit(RD,RTA00)、大鼠IL-1β ELISA Kit(达科为,1310122)及大鼠IL-6 ELISA kit(达科为,1310602),试剂恢复至室温,按照各试剂盒说明书,96孔板内每孔加入50 μL稀释液,随后分别加入50 μL标准品、样品,混匀,贴封口膜,室温孵育2 h。弃去孔中液体,洗板5次,随后每孔加入100 μL耦联物,室温孵育2 h。再次弃去孔中液体,洗板5次,每孔加入100 μL显色剂,室温避光孵育30 min。随后每孔加入100 μL终止液,在30 min内尽快读数,设置波长为450 nm,矫正波长为540 nm或570 nm。根据标准品的浓度及OD值做出标准曲线,将样品OD值读数代入曲线,分别得到L4-6脊髓背角组织中TNF-α、IL-1β及IL-6的浓度。

2 结果
2.1 Cx43在急性切口痛大鼠脊髓背角的表达Western blot观察急性切口痛大鼠6 h、3 d和7 d的脊髓背角Cx43蛋白及星形胶质细胞GFAP蛋白的表达情况。Fig 1结果显示,与C组相比,I组大鼠脊髓背角Cx43和GFAP的表达在术后6 h明显增加,其差异有统计学意义;而术后3 d和7 d脊髓背角Cx43和GFAP的表达逐渐减少,其变化与对照组相比无统计学意义。
2.2 Cx43特异性半通道抑制剂对急性切口痛大鼠急性疼痛的影响通过鞘内应用Cx43半通道特异性抑制剂Gap19,观察脊髓背角Cx43半通道在大鼠趾部切口痛中的作用。各组大鼠的术前基础MPWT
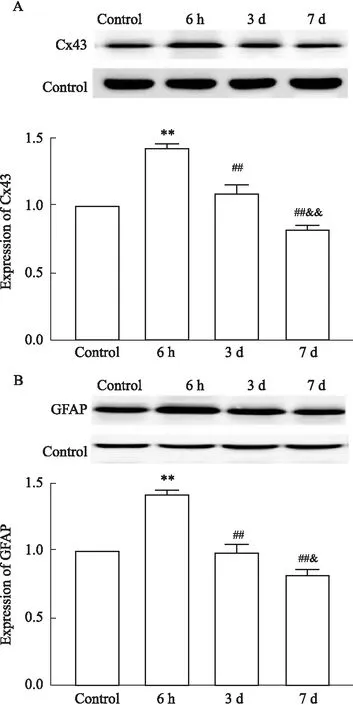
Fig 1 Expression of connexin43 and GFAP in astrocytes of rat spinal cord dorsal horn after incision
间的差值无统计学意义。与术前相比,模型组和鞘内应用Cx43特异性抑制剂Gap19组大鼠在切口建立后2 h、6 h、24 h、3 d的MPWT明显降低(P<0.01),术后7d的MPWT与术前相比无改变。与模型组相比,应用特异性抑制剂Gap19后大鼠的MPWT在术后2、6、24 h明显增加,但术后3 d和7 d,鞘内应用Gap19并未改变大鼠的缩足反应阈值(P<0.01),见Tab 1。
2.3 术后不同时间点Cx43特异性半通道抑制剂对大鼠脊髓背角Cx43表达的影响急性切口痛术后6 h,Fig 2免疫荧光结果显示,相较于C组GFAP平均荧光强度为49.196±2.347,I组大鼠脊髓背角GFAP表达明显增加,平均荧光强度上升至66.893±4.256,两组相比有统计学意义(P<0.01)。C组Cx43为39.831±8.093,I组上升至70.134±2.764%,两组相比差异有统计学意义(P<0.01)。
Tab 1 Change of MPWT at different time points in each
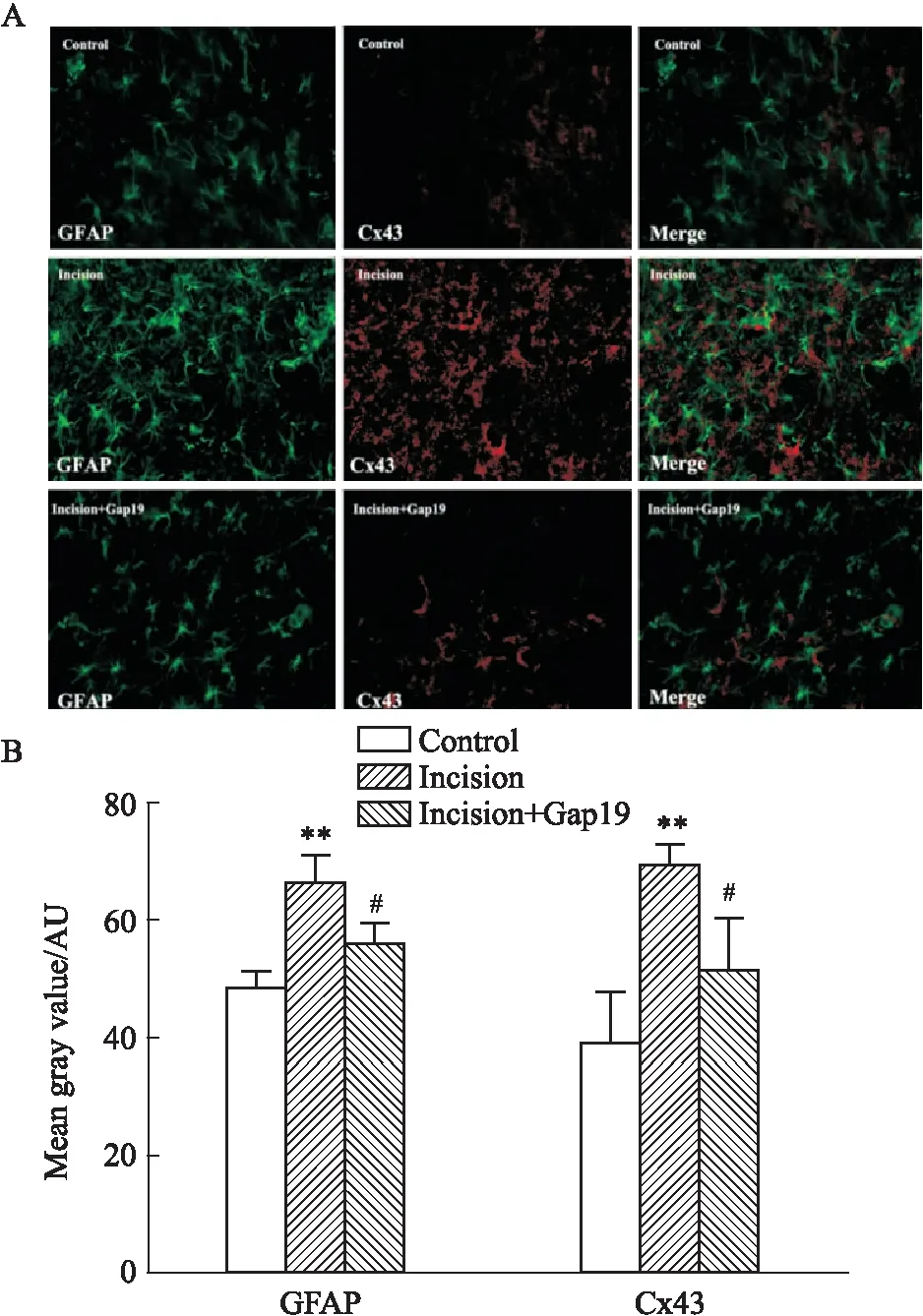
Fig 2 Effect of Gap19 on expression of Cx43 and GFAP in astrocytes of rat spinal cord dorsal horn 6 h
与I组相比,鞘内应用Cx43半通道抑制剂Gap19能够明显抑制星形胶质细胞标志性蛋白GFAP的表达,减少至56.412 ± 3.123,同时胶质细胞上Cx43的表达也明显下降至51.816±8.809,差异具有统计学意义(P<0.05)。
在术后7 d的免疫荧光结果中,C组GFAP和Cx43的平均荧光强度分别为126.477 ± 6.120和104.563 ± 3.883。I组荧光GFAP和Cx43分别为147.764±11.396和97.059±4.003,两组相比均无统计学意义。鞘内应用Cx43半通道抑制剂Gap19荧光后GFAP和Cx43分别为140.737±7.242和107.550±4.655,与I组相比,鞘内应用Cx43半通道抑制剂Gap19对GFAP和Cx43的荧光表达变化无统计学意义。
2.4 Cx43半通道特异性抑制剂抑制脊髓炎症因子的表达切口痛大鼠于术后6 h取脊髓背角组织进行ELISA检测炎症因子表达。Fig 3结果表明,与C组相比,I组大鼠脊髓背角炎症因子IL-1β,IL-6以及TNF-α的表达明显增多(P<0.05);与I组相比,鞘内应用Cx43半通道特异性抑制剂能明显抑制3种炎症因子的表达(P<0.05)。
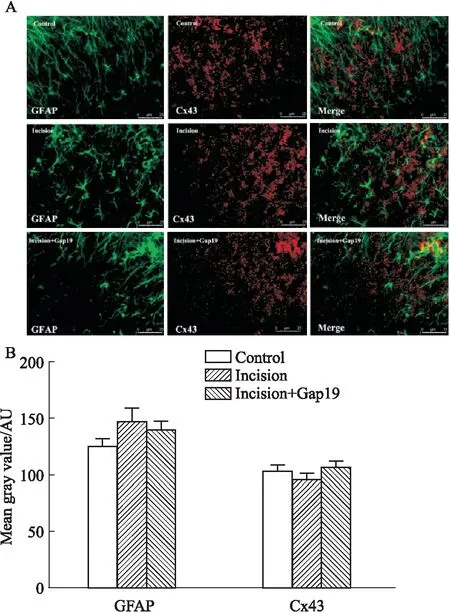
Fig 3 Effect of Gap19 on expression of Cx43 and GFAP in astrocytes of rat spinal cord dorsal horn on 7 d after incision
3 讨论
术后疼痛是指在承受手术应激后外科患者表现的一种生理、心理及行为改变等综合反应。术后急性疼痛控制不佳将使患者承受巨大的痛苦,严重时将引起一系列器官功能受损,同时也将延长住院时间,增加社会负担[10]。本研究采用经典的Brennan建立的大鼠趾部切口急性痛模型,术后大鼠表现为自发痛和痛觉过敏,不同程度的舔足或抬足行为,其与临床上的术后疼痛相似。本研究表明,大鼠切口建立后的2 h、6 h、24 h、3 d的机械缩足反应阈值明显降低,以2 h和6 h表现最为显著,而术后7 d的机械缩足阈值回复到正常水平。这与他人以及我们之前的研究结果相吻合[6]。
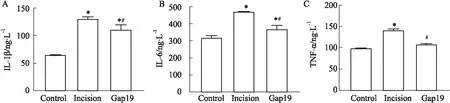
Fig 4 Effect of Gap19 on expression of inflammation factors in rat spinal cord dorsal horn 6 h after incision
星形胶质细胞是中枢神经系统内数量最多的胶质细胞,主要表达的细胞缝隙连接蛋白是Cx43[11]。近来越来越多的研究发现,星形胶质细胞不仅对神经元起着支持及营养作用,同时还参与细胞间生物信号传递功能。大量研究表明,脊髓背角的星形胶质细胞与中枢痛觉过敏的产生和维持密切相关[12]。通过脊髓损伤模型发现 Cx43/Cx30 双基因敲除后大鼠的机械性痛阈和温度敏感阈值明显提高,而Cx30单基因敲除的大鼠痛阈未见明显变化,因此认为Cx43而非 Cx30参与了中枢神经损伤导致的慢性神经病理性疼痛[13]。另有研究发现,在神经损伤性病理性疼痛、炎性痛和癌痛等慢性疼痛中都伴随有脊髓星形胶质细胞Cx43表达的改变,而抑制星形胶质细胞Cx43组成的通道功能能明显抑制痛觉过敏的发生[14]。在急性切口痛中,我们之前的研究曾首次报道Cx43的表达在24 h内增加明显[6],本研究在此基础上进一步明确在术后3d和7 d脊髓星形胶质细胞GFAP和Cx43的表达无变化。另有研究也发现,切口痛大鼠脊髓星形胶质细胞在24 h内激活,GFAP表达量增多,而小胶质细胞活化在术后3 d才明显增加[15]。结合前人研究,我们推测急性疼痛中外周伤害信号导致脊髓神经元敏化,继而星形胶质细胞Cx增多并活化,进一步促进脊髓神经元兴奋性发生改变。
Gap19是来源于Cx43胞浆端的模拟九肽,能够通过与Cx43蛋白C末端结合,从而阻止Cx43蛋白分子内胞浆端与C末端的交互作用。Gap26和Gap29等Cx43半通道抑制剂,在抑制半通道的同时会抑制GJ,而Gap19在抑制Cx43半通道功能时并不影响GJ功能,是一种公认的针对Cx43半通道的特异性抑制剂,广泛应用于多种疾病发生的病理生理机制研究[16]。本研究采用鞘内给药法,Gap19的给药剂量参考他人的研究中的常用剂量[16]。我们的结果显示,在大鼠急性切口痛模型中特异性抑制Cx43组成的半通道能明显减轻大鼠术后24 h内的大鼠痛觉过敏,而对术后3 d和7 d大鼠痛觉无影响。我们还发现,Gap19能明显抑制星形胶质细胞标志性蛋白GFAP和Cx43的表达。因此,这提示我们脊髓星形胶质细胞Cx43在大鼠趾部切口急性痛中的作用与其半通道功能有关。研究表明,Cx43组成的半通道可直接释放ATP、谷氨酸、前列腺素等信号分子从而产生作用[11]。在慢性疼痛中,Chen等[5]还发现脊髓星形胶质细胞Cx43组成的半通道可通过释放细胞因子,参与炎症因子介导的神经元敏化。研究表明在包括慢性疼痛在内的神经系统疾病发生机制中发现炎症因子在介导胶质细胞-神经元相互作用中具有至关重要的作用[10]。最近研究者发现,化疗药物紫杉醇引起胶质细胞释放炎症因子TNF-α是其导致急性痛的可能机制[17],而且IL-1β在其发生机制中也扮演重要的角色[18]。本研究在急性切口痛大鼠脊髓中发现IL-1β、IL-6以及TNF-α促炎因子的表达明显增多,而应用Gap19能明显减少3种炎症因子的表达。尽管炎症因子在急性切口痛中发挥作用的机体机制尚待进一步明确,但我们的研究结果说明星形胶质细胞Cx43半通道可能通过调控炎症介质参与大鼠急性切口痛的发生。
综上所述,鞘内半通道抑制剂可明显抑制脊髓背角Cx43表达和星形胶质细胞活化和炎症因子释放,同时显著提高切口痛大鼠的痛阈。这些研究结果表明,星形胶质细胞缝隙连接蛋白Cx43可能通过调控胶质细胞的激活和炎症微环境参与术后早期急性疼痛的发生。尽管Cx43半通道参与急性切口痛大鼠痛觉过敏的深入机制还有待进一步研究,但这些研究结果将为探寻术后急性痛新的治疗靶点提供新的线索。