盐酸阿霉素通过DRP1/FUNDC1信号通路调节线粒体动力学诱导大鼠慢性心力衰竭
夏 冉,朱国旗,高 兵,汪 恒,朱 梦,李凌基,王 祝,王 茎,戴小华
(安徽中医药大学 1.中医学院、2.针炙推拿学院、3.新安医学教育部实验室,安徽 合肥 230038;4.安徽中医药大学第一附属医院,安徽 合肥 230031)
癌症的发病率、住院率及死亡率逐年上升,全球估计13.1亿人将于2030年死于癌症[1]。盐酸阿霉素(doxorubicin hydrochloride,DOX)是一种非选择性Ⅰ类强效蒽环类抗生素,具有广谱抗肿瘤活性作用,但因其心脏毒性作用,使用过程中易造成不可逆的充血性心力衰竭,导致临床使用受限[2]。
研究发现,DOX是一种线粒体毒素,线粒体损伤是DOX诱导的心脏功能障碍和细胞死亡的核心[3-4]。线粒体依赖于动力蛋白家族GT Pases调节,正常情况下,线粒体通过融合产生能量;而在应激条件下,线粒体通过分裂将受损的线粒体分离出来进行自噬清除[5]。因此,线粒体的融合与分裂对于维持心肌细胞稳态和心脏健康至关重要。然而,过度的分裂会损害心肌细胞,导致心室重构[6]。在课题组前期研究中发现,阿霉素在复制大鼠模型时,心肌细胞凋亡及自噬水平均有所上升[7-8]。因此,我们猜测DOX可能通过线粒体动力学导致心肌细胞死亡引发心力衰竭。
临床表明,心力衰竭的严重程度与抗癌治疗过程中累积的DOX剂量相关[9]。为了避免实验误差,本研究采用DOX腹腔注射不同剂量构建大鼠心衰模型[10],通过超声心动图、B型脑钠肽(B-type natriuretic peptide,BNP)及心肌病理检测判定心衰发展程度,并选出最优剂量组。再联用线粒体分裂抑制剂Mdivi-1,通过Western blot检测大鼠相关动力学蛋白指标及涉及的相关信号通路分子改变,探索DOX诱导心衰的发生机制,为临床治疗提供思路。
1 材料与方法
1.1 材料动物:SPF级SD ♂大鼠(200~250) g,84只,购于山东省实验动物中心,生产许可证号:SCXK(鲁)20190003。饲养于安徽中医药经络研究所大学动物房(清洁级),所有实验均根据实验动物护理指南进行。本研究获得安徽中医药大学动物伦理委员会批准,批准号为AHUCM-rats-2020026。
1.2 药品与试剂注射用盐酸阿霉素(10 mg/支,山西普德药业股份有限公司),Mdivi-1(25 mg/支,上海碧云天生物技术有限公司);兔多抗DRP1(ab184247,英国Abcam公司);兔多抗OPA1(bs-11764R,北京博奥森生物技术有限公司),兔多抗FUNDC1(A16318,武汉爱博泰克生物科技有限公司);大鼠B型脑钠肽(BNP)酶联免疫吸附测定试剂盒(武汉华美生物工程有限公司),SDS-PAGE凝胶制备试剂盒、BCA蛋白浓度测定试剂盒、ECL底物液(武汉赛维尔生物有限公司)。
1.3 仪器电子天秤:梅特勒-托利多仪器(上海有限公司);酶标检测仪(美国伯腾仪器有限公司);离心机(湖南湘仪实验室仪器开发公司);电泳仪电源(北京六一仪器厂);脱色摇床(武汉赛维尔生物科技有限公司);磁力搅拌器(武汉赛维尔生物科技有限公司);转印电泳仪(武汉赛维尔生物科技有限公司);双垂直电泳仪(北京六一仪器厂);感光胶片(爱普生有限公司),Philips SONOS 5500超声仪(荷兰Philips公司)。
2 方法
2.1 分组与干预实验一:SD大鼠适应性饲养1周后,将大鼠随机分为Control组(n=12)、DOX 1组(n=12)、DOX 2组(n=12)、DOX 3组(n=12)。Control组等体积腹腔注射生理盐水;DOX各组均采用DOX交替腹腔注射,将阿霉素与0.9% 氯化钠溶液制备成注射液(1 mg·mL-1),根据大鼠体质量,DOX 1组以2 mg·kg-1注射DOX,1次/周,共6周,累计剂量达到12 mg·kg-1;DOX 2组以2.5 mg·kg-1注射DOX,1次/周,共6周,累计剂量达到15 mg·kg-1;DOX 3组以3 mg·kg-1注射DOX,1次/周,共6周,累计剂量达到18 mg·kg-1[11]。实验二:SD大鼠适应性饲养1周后,将大鼠随机分为Control组(n=12)、DOX 2组(n=12)、DOX 2+Mdivi-1组(n=12),Control、DOX 2组实验方法同前,DOX 2+Mdivi-1组在累计剂量达到15 mg·kg-1后,予以每日交替腹腔注射Mdivi-1(1 mg·kg-1),干预3周。
2.2 超声心动图检查实验一结束后,以生理盐水制备3%戊巴比妥钠溶液,按30 mg·kg-1给予大鼠腹腔注射麻醉,待大鼠完全麻醉后,将大鼠仰卧位固定于鼠架板,胸部脱毛处理并涂抹超声偶合剂,采用Philips SONOS 5500超声仪,探头频率为12 MHz进行超声心动图检查。以M型超声心动图进行测量各组大鼠左心室舒张末期内径(left ventricular internal diameter at end-diastole,LVIDd)、左心室收缩末期内径(left ventricular internal diameter at end-systole,LVIDs)、左心室射血分数(left ventricular ejection fraction,LVEF)、左心室缩短分数(left ventricular ejection fractional shortening,LVFS)。
2.3 ELISA法检测各组大鼠血清BNP含量超声心动图检测后,将大鼠腹主动脉取血,经离心后,取得血清学样本。加适当稀释的待检样品100 μL于包被的反应孔中,用封板膜封板后置37 ℃孵育,洗涤后于各孔中加入抗体100 μL,温育洗涤后,在各孔加入酶结合物工作液100 μL,重复温育洗涤,再于各孔加入TMB底物溶液100 μL,37 ℃避光反应20 min,待终止反应后,在酶标仪上450 nm处,检测出各孔OD值。
2.4 HE染色检测各组大鼠心肌细胞病理变化腹主动脉取血后,大鼠开胸,剥离并取出心脏组织,固定于4%组织固定液中,切片。依次将切片放入二甲苯Ⅰ 20 min二甲苯Ⅱ 20 min无水乙醇Ⅰ 5 min无水乙醇Ⅱ 5 min 75%乙醇5 min,再将切片入苏木素染液染5 min,入伊红染液中染色5 min,脱水封片。随后用显微镜镜检,并进行图像采集分析。
2.5 WB法检测各组大鼠心肌线粒体动力学及相关信号通路分子蛋白表达水平实验二结束后,取各组大鼠心脏左心室部分组织,将组织用PBS洗涤后置于匀浆管中,匀浆后裂解组织,12 000×g离心10 min,收集上清,用BCA蛋白浓度测定试剂盒检测蛋白浓度。沸水水浴变性15 min后电泳、转膜、封闭,稀释一抗,4 ℃孵育过夜,于脱色摇床上洗3次,将二抗用TBST稀释3 000倍,室温孵育30 min。将PVDF膜的蛋白加入ECL溶液充分反应,1~2 min后曝光,将胶片扫描,photoshop整理去色,Alpha软件处理系统分析目标带的光密度值。

3 结果
3.1 DOX大鼠一般情况变化实验6周后,Control组大鼠体质量增长正常,DOX各组大鼠精神状态变差,食欲减退,毛发脱落,体质量下降,活动缓慢,部分大鼠出现腹泻。实验后DOX各组体质量与对照组相比,均有所下降,差异有统计学意义,且DOX 3组比DOX1组和DOX 2组体质量下降更明显,如Fig 1E所示。此外,DOX的累积剂量与大鼠的死亡率呈正相关,DOX 1组大鼠死亡率17%(n=10),DOX 2组大鼠死亡率25%(n=9),DOX 3组大鼠死亡率42%(n=7),对照组无死亡。
3.2 DOX大鼠心脏结构及心功能改变为了评估DOX大鼠心脏结构及心功能变化,在实验6周后,对大鼠进行超声心动图检测。DOX各组大鼠与Control组相比,大鼠均出现左心室扩大,心功能降低(Fig 1A),且差异有统计学意义;与DOX 1组相比,DOX 2组、DOX 3组LVIDd,LVIDs值升高,EF、FS值下降,差异有统计学意义;与DOX 2组相比,DOX 3组EF、FS值下降,差异有统计学意义(Fig 1B、C)。我们进一步检测了心衰定量标志物BNP,结果表明,相比于Control组大鼠,DOX各组大鼠BNP均有所升高(Fig 1D,P<0.01);与DOX 1组相比,DOX 2组、DOX 3组BNP值升高(Fig 1D,P<0.01);与DOX 2组相比,DOX 3组BNP值升高(Fig 1D,P<0.01)。
3.3 DOX大鼠心肌病理变化为了明确大鼠心肌病理变化,取大鼠心脏组织进行HE染色。Control组大鼠心肌细胞排列有序,细胞结构规则,无细胞肥大、增生,无炎性浸润;DOX各组大鼠心肌细胞排列松散,形态不规则,间质增生,心肌纤维染色不均,伴有肥大细胞和炎性细胞浸润,且DOX 3组较DOX 1组、DOX 2组心肌细胞损伤更严重(Fig 2)。
3.4 DOX大鼠线粒体动力学及相关通路信号分子的变化 通过实验一数据对比,选取了DOX 2组为最优剂量。设立Control组、DOX 2组、DOX 2+Mdivi-1组,进一步检测心肌组织内心肌线粒体分裂蛋白1(dynamin-related protein 1,DRP1)、线粒体融合蛋白1(optic atrophy 1,OPA1)及相关信号通路蛋白(FUN14 domain containing 1,FUNDC1)(Fig 3A)。与Control组相比,DOX 2组及DOX 2+Mdivi-1组FUNDC1信号通路相关的线粒体分裂蛋白DRP1表达增强,融合蛋白OPA1表达降低;与DOX 2组相比,DOX 2+Mdivi-1组FUNDC1、DRP1蛋白表达量降低,OPA1表达增强,差异有统计学意义(Fig 3B)。4 讨论
实验的病理结果显示,DOX具有明显的心肌细胞损害作用,DOX各组大鼠表现为心功能障碍,且DOX导致的心衰程度与DOX累计剂量呈正相关,随着DOX累计剂量的上升,大鼠的心衰发展及死亡率均有所上升。在进一步探讨DOX心衰机制中发现,DOX导致大鼠心肌内DRP1、FUNDC1蛋白表达量增加、OPA1蛋白表达降低。说明一定剂量的DOX诱导慢性心衰发生,其机制可能与DRP1/FUNDC1介导的心肌线粒体发生过度分裂、减少线粒体融合有关。
既往研究表明,大鼠在腹腔注射DOX累计剂量达到12 ~18 mg·kg-1时,可发生CHF[12]。在实验一中发现,大鼠腹腔注射DOX累积剂量达到12 mg·kg-1时,超声心动图显示大鼠射血分数保留或下降,BNP含量上升;当累积剂量越大时,大鼠精神状态更差,体质量降低明显,部分伴有腹水发生,超声心动图显示大鼠的LVIDd、LVIDs更高,LVEF、LVFS值更低。BNP是诊断心衰的重要标志物,在左心室超负荷状态下,BNP分泌增高,并随着疾病的严重程度而递增,对于评估心衰的严重程度及预后具有重要价值。实验结果证实,剂量的累积导致大鼠BNP进一步升高,心功能更差。考虑到DOX 1组存在极少数射血分数保留情况,DOX 2组死亡率小于DOX 3组,且DOX 2组同DOX 3组比较LVIDd与LVIDs差异无统计学意义,因此,选取了DOX 2组作为最优剂量进行实验二。
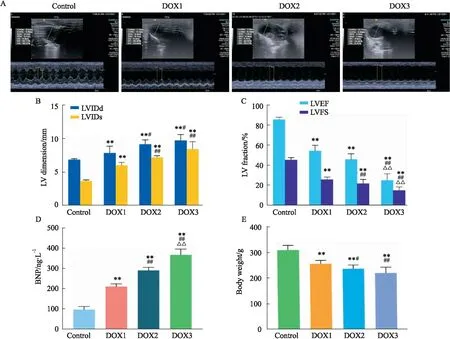
Fig 1 Effect of DOX on cardiac structure,cardiac function and body weight of

Fig 2 The morphological changes of heart tissues in four groups(200×)
FUNDC1(FUN14 domain containing 1)是位于线粒体外膜的蛋白质,通过参与线粒体的融合及分裂,维持心脏功能,FUNDC1的缺失会导致心力衰竭[13]。在正常情况下,FUNDC1与位于线粒体内膜(IMM)上的线粒体融合蛋白:视神经萎缩蛋白1(optic atrophy 1,OPA1)相互作用,为心肌细胞提供能量;而在应激条件下,FUNDC1能够促进线粒体动力相关蛋白1(dynamin-related protein 1,DRP1)易位至线粒体外膜(OMM)进而诱导线粒体分裂[14]。在实验中发现,DOX诱导的大鼠发生心衰时,FUNDC1、DRP1蛋白表达量增强,而OPA1蛋白表达量下降。OPA1对线粒体嵴结构的控制发挥重要作用,能够阻止细胞色素C的释放,减少细胞凋亡发生[15]。OPA1的降低表明DOX导致心肌线粒体受损,心肌线粒体融合减少,能量供应降低,心肌细胞死亡风险增加。DRP1是线粒体分裂的关键枢纽,主要位于细胞质中[16]。在DOX诱发的大鼠心衰中,FUNDC1、DRP1蛋白表达量增强,表明DOX增强了线粒体的分裂,且两蛋白趋势相同提示DOX可能通过FUNDC1通路招募了DRP1蛋白。为了继续验证FUNDC1与DRP1蛋白的关联性,我们使用了线粒体分裂抑制剂(Mdivi-1)。Mdivi-1作为Drp1的选择性抑制剂,在DOX诱导的心脏毒性中具有保护作用[17]。结果表明,在联用了Mdivi-1之后,DRP1、FUNDC1的蛋白均有所降低,OPA1蛋白表达增强。由此可见,DOX诱导的心衰可能与其通过DRP1/FUNDC1信号通路促进了线粒体过度分裂、减少了线粒体融合有关。但本实验只对涉及的通路及机制做了初步探讨,后续可通过基因敲除及检测蛋白间相互作用,做进一步深入研究。
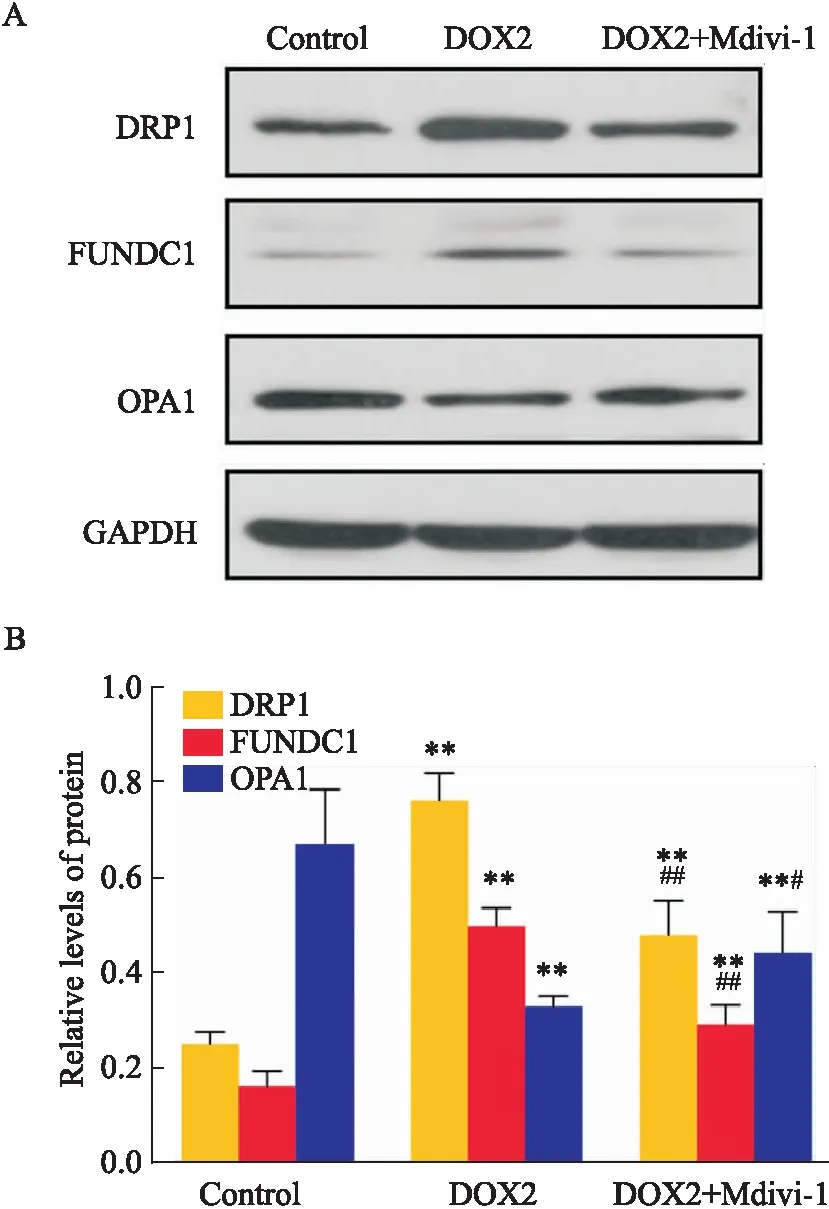
Fig 3 Effect of DOX on mitochondrial dynamics and
**P<0.01vsControl group;#P<0.05vsDOX 2 group;##P<0.01vsDOX 2 group