蓝色半导体激光和近红外激光对牙龈卟啉单胞菌杀菌作用的体内研究
司薇杭,朱家禛,张千千,陈 悦*
(1西安交通大学口腔医院牙周病科,西安 710004;2西安交通大学口腔医院;*通讯作者,E-mail:dentistcy@126.com)
菌斑生物膜是牙周病的始动因子,牙周病的预防和治疗最重要的是控制菌斑,消除炎症,通常牙周炎传统的治疗方法有龈上洁治术、龈下刮治和根面平整术、局部用药、全身用药等,但使用中也存在一些不足,如刮治器械难以进入清除根分叉以及窄而深的牙周袋的菌斑,也难以清除入侵牙周组织的细菌,而长期用药易产生耐药性和副作用等。而激光可以到达刮治器械无法到达的位置,利用散射效应、光热效应对牙周致病菌起到杀菌作用,并且同时避免了药物治疗的副作用和耐药性等问题。
目前牙周领域常用的激光有Nd:YAG激光、Er:YAG激光、CO2激光、半导体激光等[1]。其中,半导体激光波长通常在800~980 nm之间,属于近红外激光,能量被水和硬组织吸收少,大部分被黑色素和血红蛋白吸收,可杀灭牙周袋内致病菌,尤其是牙龈卟啉单胞菌(Porphyromonasgingivalis,Pg)等含黑色素细菌[2,3]。蓝色半导体激光(蓝激光)是一种新研发的半导体激光,其在牙周炎治疗中的杀菌效果和安全性有待研究。本实验将建立牙周炎大鼠模型,使用不同功率的蓝激光和近红外激光照射牙周袋杀菌,通过对照实验探究蓝激光和近红外激光对Pg的杀菌效果和安全性,为蓝激光应用于临床提供实验依据。
1 材料与方法
1.1 主要试剂与仪器
PgATCC33277型标准菌株(四川大学华西口腔实验中心),EDTA脱钙液(武汉博士德生物工程有限公司),细菌gDNA提取试剂盒(日本TaKaRa公司),microCT扫描系统(美国PerkiElmer公司),组织切片机(德国Leica公司),光学显微镜(德国Leica公司),细菌gDNA提取试剂盒(日本TaKaRa公司),PCR扩增试剂盒(北京索莱宝科技有限公司),DNA凝胶回收试剂盒(美国Omega公司),荧光定量PCR试剂盒(日本TaKaRa公司),PCR仪(美国ABI公司),光学显微镜(德国Leica公司),microCT扫描系统(美国PerkinElmer公司),波长450 nm蓝激光样机(西安蓝极医疗电子科技有限公司),波长810 nm近红外激光仪(德国A.R.C公司)。
1.2 实验动物
4周龄雄性SD大鼠35只,体质量(140±10)g,购于西安交通大学医学部SPF动物实验中心,许可证号:SCXK(陕)2007-001。饲养于西安交通大学医学部动物实验中心,温度为(22±1)℃、相对湿度为(60±5)%、通风干燥。实验前标准化饮食适应性饲养1周。
1.3 牙周炎大鼠模型的建立
室温下取PgATCC33277型标准菌株快速解冻,吸取100 μl菌液,按四区划线法在BHI血平板上涂布。将涂布好的血平板和厌氧产气袋一并放入密封饭盒中,37 ℃恒温培养箱培养7 d。第7天后挑取形态饱满的单菌落转种,平板分区划线涂布,继续培养48 h,形成黑色带有金属光泽的单克隆菌落。配置初始菌液不同浓度,并测定吸光度值,绘制浓度-吸光度标准曲线,配得浓度为109CFU/ml的Pg菌液。
雄性SD大鼠35只,随机分配为对照组(5只)和牙周炎模型组(30只)。对模型组大鼠进行10%水合氯醛腹腔注射,麻醉后用鼠板固定,4-0丝线结扎双侧上颌第二磨牙(M2),使丝线尽量进入龈沟中,然后用小毛刷在结扎部位的牙龈涂布浓度为109CFU/ml的Pg菌液。每2 d检查结扎情况,同时涂布菌液,如丝线断裂脱落,标记大鼠并重新结扎,连续两次脱落的大鼠剔除,持续建模6周。
1.4 CT三维重建法测量牙周炎大鼠模型的牙槽骨吸收
建模6周,随机挑选模型组大鼠5只和对照组大鼠5只,行10%水合氯醛腹腔注射麻醉,剪取大鼠双侧上颌牙槽骨,适当修剪,放入MicroCT的检测管,进行扫描。使用Mimics 21.0软件包重建牙槽骨的三维模型,分别测量第二磨牙(M2)近中腭尖(mesio-palatal cusp,MPC)、腭沟(palatal groove,PG)、远腭尖(disto-palatal cusp,DPC)三处对应的釉牙骨质界到牙槽嵴顶距离(cementoenamel junction to the alveolar bone crest,CEJ-ABC),将3个值求平均,作为M2骨吸收高度。
1.5 牙周炎大鼠模型牙周组织的组织学观察
大鼠上颌骨标本室温下用EDTA脱钙液脱钙4周,探针轻力能刺入牙和牙槽骨时为脱钙完全。梯度乙醇脱水,二甲苯溶液中浸泡至透亮,浸蜡,石蜡包埋,切片(厚度为5 μm),收集M2腭侧近中、远中牙槽嵴顶的切片,常规HE染色,显微镜下观察牙周组织的组织学变化。
1.6 牙周炎大鼠激光处理
25只模型组大鼠实验当天(第0天),用10%水合氯醛(0.3 ml/100 g)腹腔注射麻醉后,去除左、右侧M2的结扎丝。10只大鼠左侧M2牙周袋使用1 W蓝激光,右侧M2牙周袋使用1 W近红外激光;另外10只大鼠左侧M2牙周袋使用1.5 W蓝激光,右侧M2牙周袋使用1.5 W近红外激光,分别照射颊侧、舌侧、近中、远中牙周袋各10 s。剩余5只大鼠使用假激光,不开激光电源,将蓝激光光纤伸入左侧M2,近红外激光光纤伸入右侧M2的颊侧、舌侧、近中、远中牙周袋做提拉动作各10 s。分别在第3,7天进行相同的操作。
10只大鼠左侧M2牙周袋使用1 W蓝激光,右侧M2牙周袋使用1 W近红外激光;另外10只大鼠左侧M2牙周袋使用1.5 W蓝激光,右侧M2牙周袋使用1.5 W近红外激光。其余5只大鼠使用假激光,不开激光电源,左、右侧M2的牙周袋分别使用蓝激光和近红外激光的光纤伸入牙周袋做提拉动作。
1.7 荧光定量PCR测定龈下菌斑中Pg拷贝数
BHI血平板上接种Pg标准菌株ATCC33277,厌氧条件下37 ℃恒温培养7 d,用接种环挑取少许,制成2个样本,使用细菌gDNA提取试剂盒提取Pg的DNA,按Pg的16SrRNA基因特异性保守片段设计引物,进行PCR扩增。扩增完毕后1.5%琼脂糖电泳检测,并使用DNA凝胶回收试剂盒从凝胶中收集PCR产物送上海生工公司测序鉴定。
PCR产物和PMD18-载体进行连接反应,构建含目的基因片段的重组质粒。使用快速感受态细胞制备试剂盒将受体菌制备成感受态细胞,将构建成功的重组质粒转化到受体菌后进行培养。使用质粒DNA小量提取试剂盒提取重组质粒。使用nano分光光度计测定重组质粒OD260值及浓度,通过公式计算出拷贝数,并稀释配制成109,108,107,106,105,104,103,102copies/μl的质粒标准品。
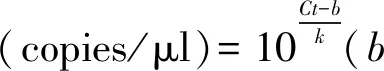
1.8 蓝激光、近红外激光及假激光照射牙周袋后组织学观察
1 W或1.5 W蓝激光和近红外激光在第0,7天照射M2牙周袋后各处死5只大鼠,假激光第7天照射后处死5只大鼠,10%水合氯醛麻醉后固定,取大鼠M2腭侧牙周组织以及上颌骨样本,室温下用EDTA脱钙液脱钙4周,梯度乙醇脱水,二甲苯溶液中浸泡至透亮,浸蜡,石蜡包埋,切片(厚度为5 μm),常规HE染色,显微镜下观察M2腭侧牙周组织的组织学变化。
1.9 统计学分析
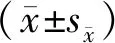
2 结果
2.1 牙周炎模型大鼠牙槽骨的吸收程度
模型组大鼠左侧与对照组大鼠左侧相比CEJ-ABC明显增大,差异有统计学意义(P<0.001),模型组的右侧与对照组右侧相比CEJ-ABC明显增大,差异有统计学意义(P<0.001,见图1),牙槽骨高度降低,表明出现骨吸收。对照组左侧与右侧的CEJ-ABC相比,差异无统计学意义(P>0.05)。模型组左侧与右侧CEJ-ABC相比,差异无统计学意义(P>0.05)。
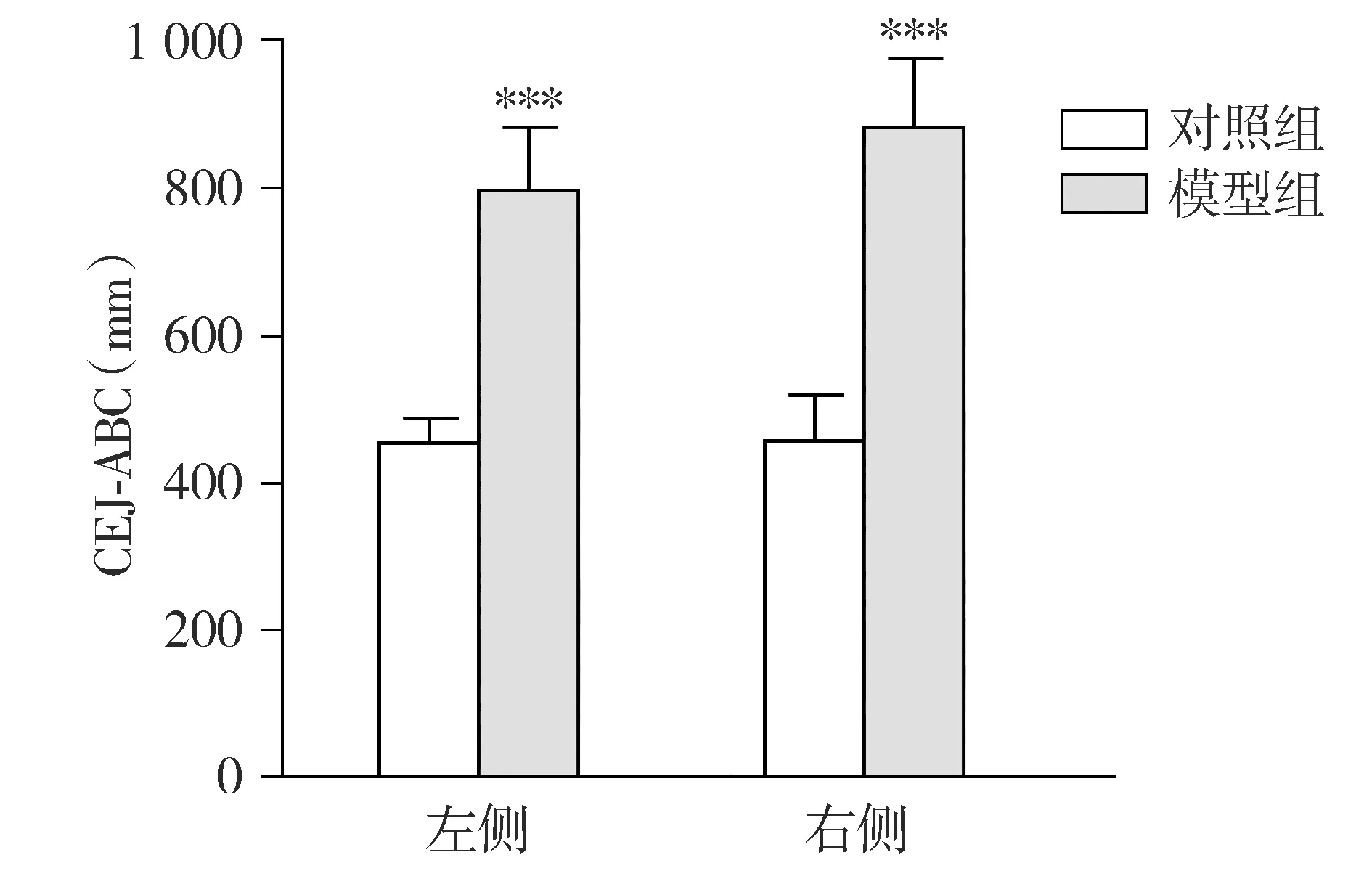
与对照组相比,***P<0.001图1 比较对照组和模型组牙槽骨吸收情况Figure 1 Comparison of alveolar bone resorption between control group and model group
2.2 牙周炎模型大鼠牙周组织的变化
对照组的沟内上皮和结合上皮完整连续,沟内上皮钉突增生,有少量炎症细胞浸润,上皮下结缔组织局部可见炎症细胞浸润。模型组沟内上皮和结合上皮钉突向结缔组织深部增生,沟内上皮出现糜烂、完整性缺失,结合上皮向根方增殖,形成牙周袋,上皮内和上皮下结缔组织内有较多炎症细胞浸润,呈活动性炎症的状态(见图2)。
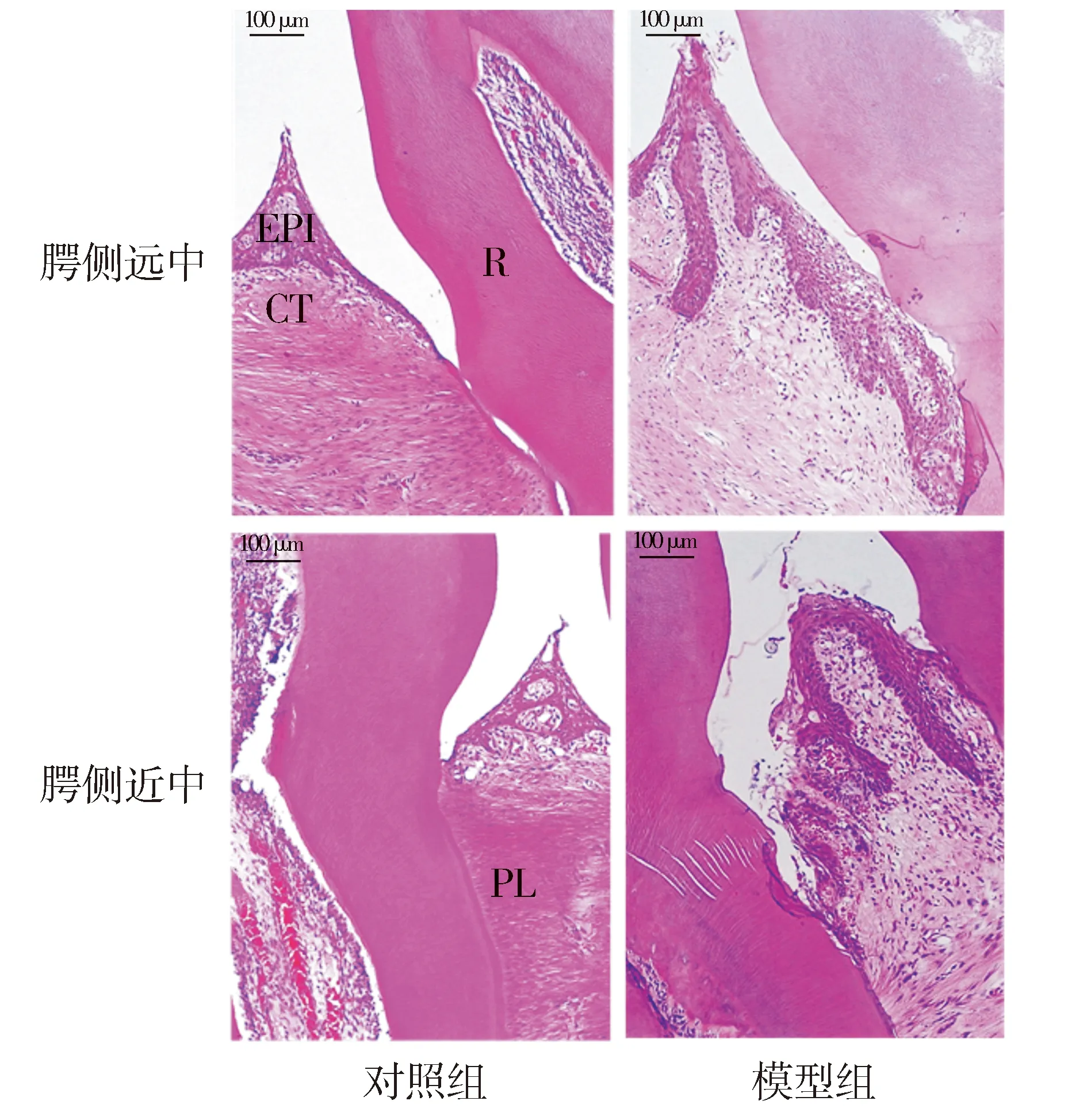
R:牙根;EPI:牙龈上皮;CT:结缔组织;PL:牙周韧带图2 HE染色检测对照组和模型组牙周组织 (标尺=100 μm)Figure 2 HE staining of the periodontal tissues in control group and model group (bar=100 μm)
2.3 PCR产物电泳检测及测序鉴定结果
2个Pg菌落样本进行PCR扩增,1.5%琼脂糖凝胶电泳检测PCR产物,两个样本(泳道1,2)中各含1条明亮条带,位于400 bp附近(见图3A),与404 bp预期产物相符,为Pg特异性目的片段。重新从凝胶中收集PCR产物并测序,测序结果和NCBI Genbank的PgATCC33277 16S rRNA基因的已知序列对比,相似度为100%(见图3B)。

A.电泳结果 B.测序结果图3 Pg的PCR产物电泳结果及测序比对结果Figure 3 Electrophoresis of Pg PCR product and its sequencing
2.4 龈下菌斑中Pg拷贝数检测结果
在第0,3,7天,与假激光比较,1 W蓝激光照射后Pg拷贝数明显下降,差异有统计学意义(P<0.05);与假激光比较,1.5 W的蓝激光照射后Pg拷贝数也明显下降,差异有统计学意义(P<0.05);与假激光比较,1 W的近红外激光Pg拷贝数明显下降,差异有统计学意义(P<0.05));与假激光比较,1.5 W的近红外激光照射后Pg拷贝数也明显下降,差异有统计学意义(P<0.05)。在第7天,与1.5 W蓝激光比较,功率1.5 W近红外激光照射后Pg拷贝数下降更明显,差异有统计学意义(P<0.05);在第7天功率为1 W,或其他相同时间点,相同照射功率下,蓝激光和近红外激光的Pg拷贝数相比,差异无统计学意义(P>0.05,见表1)。

表1 蓝激光和近红外激光第0,3,7天照射后Pg拷贝数 (copies/μl,n=5)
在第0,3,7天,功率1 W的蓝激光照射牙周袋杀菌率均达到90%左右;功率1 W的近红外激光第0天杀菌率达到80%~90%左右,第3,7天杀菌率均达到90%以上。功率1.5 W的蓝激光和近红外激光在不同时间点杀菌率均达到99%左右。不同时间点蓝激光或近红外激光功率1.5 W杀菌率较功率1 W相比更高,差异有统计学意义(P<0.05)。第0,3天在相同功率,蓝激光与近红外激光杀菌率相比,差异无统计学意义(P>0.05);第7天功率1 W的蓝激光与近红外激光杀菌率相比,差异无统计学意义(P>0.05),而与相同功率蓝激光相比,功率1.5 W的近红外激光杀菌率更高(P<0.05,见图4)。

同时间与1 W蓝激光比较,*P<0.05,**P<0.01;同时间与1 W近红外激光比较,#P<0.05,##P<0.01;同时间与1.5 W蓝激光比较,△P<0.05图4 蓝激光和近红外激光杀菌率比较Figure 4 Comparison of sterilization rate between blue laser and near-infrared laser
2.5 激光照射牙周袋后牙周组织变化
假激光照射牙周袋后牙周组织HE染色在低倍视野下显示牙龈上皮糜烂,丧失连续性,表面不平,钉突增生,结合上皮根向移行,形成深牙周袋;结缔组织内能够观察到大量炎症细胞浸润,伴牙周韧带破坏。高倍视野下可见龈上皮下方大量炎症细胞浸润,胶原纤维稀疏(见图5)。
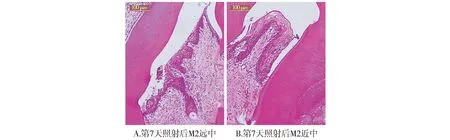
图5 假激光照射后牙周组织HE染色Figure 5 HE staining of periodontal tissue after sham laser irradiation
设置激光功率为1 W,蓝激光第0天照射牙周袋后,低倍视野下观察M2远中及近中可见牙根表面规则,未见明显形态变化,牙龈上皮未有明显损伤,部分区域上皮完整性丢失,出现溃疡,但未观察到明显热损伤区,如凝固层、炭化物等。结合上皮根向增殖,结缔组织内观察到大量炎症细胞浸润,微血管扩张,牙周韧带破坏(见图6)。蓝激光第7天照射牙周袋后牙根表面未见明显形态变化,牙龈上皮尚完整,部分区域有角化脱落物质,未观察到明显热损伤。结合上皮下方可见少量炎症细胞浸润,与第0天照射后对比,炎症有一定程度消退,牙周组织出现愈合(见图6)。
近红外激光第0天照射牙周袋后,低倍视野下观察M2远中及近中,可见部分牙龈上皮表面有糜烂、破损,细胞水肿,牙根表面未见明显形态变化,结合上皮根向移行,结缔组织内大量炎症细胞浸润,牙周韧带受到破坏(见图6)。第7天照射牙周袋后可见牙龈上皮完整,边缘龈上覆盖角化物,未观察到热损伤。牙根表面未见明显形态变化,结合上皮下方观察到少量炎症细胞浸润,与第0天照射牙周袋后对比,呈现炎症消退、组织愈合的趋势(见图6)。
设置激光功率为1.5 W,蓝激光第0天照射牙周袋后,低倍视野下观察M2远中及近中可见牙龈上皮受到一定程度损伤,上皮有一部分汽化消失,残留卷曲的组织坏死物,牙根表面未见明显形态变化。上皮下方结缔组织内可见中等量炎症细胞浸润(见图6)。第7天照射牙周袋后可见牙根表面稍粗糙,但无明显形态变化,大部分区域上皮完整性缺失,可见热损伤凝固区覆盖即将脱落的角化层。结缔组织内微血管破裂,可见炎症细胞及凝集的血细胞(见图6)。
近红外激光第0天照射牙周袋后,可见牙根表面无明显形态变化,观察到明显热损伤汽化区,牙龈上皮不完整,上皮表面残留部分坏死物质。结缔组织内胶原纤维稀疏,有大量炎细胞浸润(见图6)。第7天照射牙周袋后可见牙根表面粗糙,覆盖有零星黑色碳化物,牙龈上皮基本丢失,表面糜烂,热损伤范围大,剩余组织稀疏。结缔组织内见大量炎症细胞及血细胞(见图6)。
3 讨论
半导体激光已被广泛应用于牙周炎的治疗中,通过光热效应、生物学刺激等,作用于牙周袋内的菌斑,杀灭致病菌。蓝激光是诺贝尔物理学奖得主研发的一种新型半导体激光,相较于其他半导体激光,波长较短为430~488 nm,与软组织中血红蛋白和黑色素的吸收峰值(430 nm左右)非常接近。Pg等利用血红素作为铁源的含黑色素的细菌,在405 nm处有强烈的吸收峰,可被光激发产生激发态氧,从而氧化和破坏细菌的脂质、蛋白质和核酸,达到杀菌的目的[4]。另有研究表明蓝激光穿透深度小,可降低意外伤害的风险;散射少,从而周围组织吸收的激光能量较低,热损伤小[5-7]。蓝激光做为一种新型激光应用于牙周炎的治疗,其杀菌效果及安全性的研究十分重要。
本实验通过荧光定量PCR检测牙周炎大鼠模型龈下菌斑的Pg拷贝数,以探究蓝激光与已应用于临床的近红外激光在体内环境杀菌的效果,并比对其效果的差异。实验结果表明使用功率1 W蓝激光分别照射牙周袋3次,杀菌率均达到90%左右,与近红外激光杀菌效果相同。功率1.5 W蓝激光和近红外激光分别照射3次,杀菌率则均达到99%左右,提示功率1.5 W时达到了理想的杀菌效果。第0,3天蓝激光和近红外激光照射牙周袋杀菌效果相同;第7天照射后,虽然统计学分析显示两组剩余Pg拷贝数有差异,但此时两组Pg拷贝数极低,均小于60 copies/μl,已实现99%的高杀菌率。因此两种激光在相同功率(1 W或1.5 W),杀菌效果相同,均能有效杀菌,且功率1.5 W比1 W的杀菌率高。功率1 W时,两种激光短时间内两次照射即可达到最佳的杀菌效果。功率1.5 W时,两种激光单次照射即可达到最佳的杀菌效果,重复进行第二、三次照射并没有增强杀菌效果。
以往半导体激光治疗牙周炎的杀菌效果通过大量研究已经得到证明。有研究检测半导体激光辅助龈下刮治术和根面平整术(SRP)治疗后牙周袋内细菌总量明显减少[8,9]。也有学者发现半导体激光牙周治疗后1个月、3个月,能明显减少牙周致病菌红色复合体的数量[10,11]。另有研究评价了砷化铝镓(GaAlAs)半导体激光辅助SRP治疗慢性牙周炎,结果显示实验组的Pg拷贝数在激光照射后从80%降低到20%[12]。有研究通过体外实验也证明半导体激光对Pg有很好的抗菌作用,并且增加照射功率有助于抗菌效果增强[13]。但激光的功率应设置在合适的范围既保证抗菌效果,又保证治疗的安全性。
激光在牙周袋内瞬间产生的局部高热量可有效杀死细菌并灭活相关毒力因子,但过高的热量也可能对周边正常的牙周组织产生不利影响,如牙根表面炭化、牙龈上皮破坏、出血过多等,出现此类情况便无法保证牙周治疗的安全性[14,15]。本实验在显微镜下观察激光照射后牙周组织的变化,以探究蓝激光和近红外激光用于牙周袋杀菌的安全性。功率1 W蓝激光在照射一次后,牙周组织未受到明显热损伤,而近红外激光的部分区域出现一定热损伤。两种激光照射3次后,牙周组织均出现一定程度的愈合,未有明显热损伤。分析其原因,第1次治疗时牙周炎症明显,病变组织富含血红蛋白、细菌等,激光被吸收,使炎症上皮消融,并达到止血、杀菌的效果;而第3次治疗时已经去除结扎丝第7天,并且经过前两次的治疗,牙周炎症已经有明显改善,容易吸收激光能量的血液、细菌等大大减少,因此未引起热损伤。功率1.5 W两种激光照射1次、3次后,牙周组织均出现热损伤,蓝激光的热损伤较近红外激光轻。因为照射1次后已出现热损伤,短期内再进行2次照射,已有的热损伤未修复,使得局部炎症加重,牙周组织损伤更明显。研究证明相同功率下(1 W或1.5 W)蓝激光较近红外激光对牙周组织的热损伤小,安全性更高,且功率1.5 W较1 W更易出现热损伤,说明低功率1 W更安全。
有体外研究显示半导体激光功率1 W或1.5 W,照射时间10 s,被认为是安全的[16]。也有学者在体内研究观察到810 nm半导体激光,功率小于1.5 W不破坏牙周袋中的牙齿结构[17]。本研究结果则证明低功率1 W较高功率1.5 W照射牙周袋对牙周组织更安全。此外,有结果显示半导体激光以功率1 W进行5 s为间隔的牙周袋内杀菌治疗,不会造成明显的微血管破裂和过多的出血,不破坏上皮的完整性、连续性,更不会对结缔组织造成损伤[18],提示今后激光照射牙周袋杀菌时功率设置为1 W,并进行间断式的照射,以提高安全性,并可进一步探讨合适的间隔时间。
综上所述,在相同功率(1 W或1.5 W)蓝激光具有与近红外激光相同的杀菌效果,且安全性更高。本研究为蓝激光的临床应用提供了一定的实验基础,但也存在一定的局限性,如只评价了蓝激光对单一菌种Pg的杀菌作用,而临床中牙周炎的菌斑生物膜往往包含多种细菌且具备更加复杂的结构,因此仍需进一步明确蓝激光对其他牙周致病菌的杀菌效果;此外,应该从更多角度完善对蓝激光的安全性检测,如照射过程中组织温度以及牙根表面形态的变化等,以期为后续相关临床试验的开展提供更加全面的实验依据。

