LKB1在甲状腺癌中的表达及其对甲状腺癌细胞血管生成的影响
寇 博,石玉晗,刘 伟
(1西安交通大学医学部第一附属医院耳鼻咽喉头颈外科,西安 710061;2汕头大学医学院第一附属医院甲乳外科;3西安交通大学医学部第一附属医院血管外科;*通讯作者,E-mail:lizhang1988617@163.com)
甲状腺癌是世界上最为常见的内分泌恶性肿瘤之一,2021年美国新增甲状腺癌人数约44 280人,新增死亡人数约2 200人。而在发展中国家,该病的发病率和死亡率亦呈显著上升趋势[1]。部分学者认为新型的生物靶向可能为甲状腺癌患者的治疗提供新的思路。肝激酶B1(liver kinase B1,LKB1),又称丝氨酸/苏氨酸激酶11,是一种细胞内广泛分布的蛋白激酶,最早在黑斑息肉综合征中被发现[2]。研究显示,LKB1参与细胞自我更新、代谢、极性等一系列生物学行为[3-5]。也有文献报道LKB1在肺癌、胃癌等多种肿瘤中发挥抑癌作用[6,7]。而在甲状腺癌中,黄志强等[8]学者研究显示LKB1能够抑制甲状腺癌K1细胞的增殖和转移能力。但LKB1对甲状腺癌血管生成的影响尚未见报道。本研究利用免疫组化实验比较p-LKB1在甲状腺癌组织和癌旁正常组织中的表达情况,以及甲状腺癌患者临床病理指标不同亚型间p-LKB1的表达差异;并构建过表达LKB1的甲状腺癌细胞模型,探究LKB1过表达对甲状腺癌K1细胞血管生成的影响。
1 材料与方法
1.1 实验标本
收集2020年1月至2021年6月西安交通大学第一附属医院病理科确诊为甲状腺乳头状癌患者的甲状腺癌组织及癌旁正常组织标本各50例。其中男性12例,女性38例;年龄28~73岁,平均(44.48±13.46)岁。除年龄、性别外,还收集了甲状腺癌患者的肿瘤大小、肿瘤包膜侵犯与否、淋巴结转移与否、临床分期以及肿物多中心性5个临床病理指标信息。本研究经西安交通大学第一附属医院伦理委员会审核批准(文号G-209),患者签署知情同意书。
1.2 纳入及排除标准
纳入标准:①均为首次甲状腺手术患者,并同期行中央区淋巴结清扫或颈部淋巴结清扫术;②术中快速冰冻切片及术后病理HE染色确诊为甲状腺癌;③术前无化疗、放疗及免疫治疗史;④年龄为18~80岁。
排除标准:①复发性甲状腺癌;②合并其他恶性肿瘤疾病;③妊娠期或者哺乳期孕妇。
1.3 主要试剂与细胞培养
DMEM培养基,胎牛血清、0.25%胰酶购自美国Gibco公司,BCA蛋白检测试剂盒购自上海Beyotime公司,磷酸化LKB1(p-LKB1)、VEGFA和β-actin单克隆抗体购自武汉三鹰生物公司,过表达质粒、ELISA检测试剂盒以及免疫组化试剂盒购自北京擎科生物公司,Trizol试剂、逆转录试剂盒、荧光定量试剂购自美国Biosystems公司,PCR Master Mix购自美国Roche公司。
甲状腺乳头状癌K1细胞株以及人脐静脉血管内皮细胞(HUVEC)均来自西安交通大学第一附属医院转化医学中心实验室。上述细胞均用DMEM培养基培养,培养基内含10%胎牛血清和1%青-链霉素,细胞置于37 ℃含5%CO2培养箱中培养。
1.4 免疫组化检测p-LKB1在甲状腺组织中的蛋白表达
采用免疫组化SP法染色检测p-LKB1在甲状腺癌组织中的蛋白表达:所有标本均经甲醛溶液固定,常规石蜡包埋后连续切片,切片厚度为4 μm,具体步骤参照试剂盒说明书操作。其中一抗为鼠抗人p-LKB1单克隆抗体(工作液稀释为1 ∶50)。高倍显微镜下p-LKB1阳性表达定位于细胞浆和细胞核,阴性表达定位于细胞核内。单个标本随机选取10个视野,于倒置显微镜下观察,镜下判断标准[9]:①显色程度,按细胞着色强度计分:未着色为0分,淡黄色为1分,黄色为2分,紫褐色为3分;②显色细胞数,按p-LKB1定位于胞浆的细胞着色面积计分:无着色为0分,1%~25%为1分,26%~50%为2分,大于50%为3分;③表达阳性以着色强度与着色面积积分之和进行判断:0~1分判定为阴性,≥2分判定为阳性(2分为弱阳性,3~4分为中阳性,5~6分为强阳性)。
1.5 过表达LKB1的甲状腺细胞系构建
取生长状态良好的甲状腺癌K1细胞进行实验。于两个无RNA酶的EP管内,各加入100 μl不含血清的培养基。于其中一个EP管内加入2 μg过表达LKB1质粒或NC质粒,于另一个EP管内加入8 μl X-tremeGENE DNA转染试剂,各静置5 min。随后将两管混液进一步混合并静置15 min,后加入甲状腺癌K1细胞内继续孵育48 h,从而构建过表达LKB1的甲状腺癌K1/OE-LKB1以及对照组K1/NC细胞系。最后提取上述两组细胞系的蛋白或RNA为后续的Western blot和实时定量PCR等细胞学实验做前期准备;并以这两种细胞系为基础,利用ELISA实验、小管形成实验和HUVEC迁移实验探究LKB1对甲状腺癌血管生成的影响。
1.6 Western blot检测p-LKB1在甲状腺癌细胞内的蛋白表达
细胞培养皿内的甲状腺癌K1/OE-LKB1和K1/NC细胞,经PBS缓冲液清洗后,用RIPA蛋白裂解液裂解10 min,离心后提取上清液。随后利用BCA蛋白检测试剂盒进行蛋白定量,即通过酶标仪器测量570 nm处吸光度值(OD值),绘制标准曲线,利用标准曲线计算各组蛋白浓度。然后配制10%SDS-PAGE分离胶、5%SDS-PAGE浓缩胶,每个泳道取25 μg变性蛋白作聚丙烯酰胺凝胶电泳。用PVDF膜转膜2 h,条带用10%脱脂牛奶封闭1 h,加入p-LKB1、β-actin抗体(稀释度均为1 ∶1 000),4 ℃摇床孵育过夜。PBST洗膜后加入HRP标记的相应二抗(稀释度为1 ∶1 000),室温孵育约1 h,PBST再次洗膜。后用化学发光仪进行发光显影。
1.7 实时定量PCR检测LKB1在甲状腺癌细胞内的mRNA表达
1.8 ELISA实验检测甲状腺K1细胞内VEGFA含量
甲状腺癌对照组及过表达LKB1组的细胞株(K1/NC组和K1/OE-LKB1组)置于75 cm2的培养瓶,长满至瓶底面积80%~90%,PBS洗涤2次,无血清培养基继续培养24 h,吸取细胞培养液至无菌离心管,离心后取上清液,即条件培养基,置于EP管中保存备用。对于ELISA实验,则通过ELISA检测试剂盒检测上述条件培养基内VEGFA的含量。
取出VEGFA ELISA试剂盒,室温下放置30 min。取出96孔板,分别设置标准品组(6个浓度)、空白孔、待测样品组。依照标准品的顺序分别加入100 μl的标准品溶液于96孔板内;空白对照孔加入100 μl水;其余微孔中加入100 μl待测样本。随后在标准品组、待测样本组各孔中加入50 μl酶标溶液,空白孔除外。37 ℃温育1 h,弃液甩干,用稀释后的洗涤液注满各孔,静置30 s,用吸水纸彻底拍干,重复清洗5次。各孔加入显色剂A液50 μl,再加入显色剂B液50 μl。37 ℃避光显色15 min,随后各孔加入50 μl终止液。最后在450 nm波长下读取各孔吸光度值(OD值)。
1.9 小管形成实验检测过表达LKB1对甲状腺癌K1细胞血管形成的影响
预先在冰上将基质胶铺于96孔板,每孔50 μl,置于37 ℃细胞培养箱孵育4 h。将消化离心的人脐静脉血管内皮细胞HUVEC分别用上述甲状腺癌K1/NC和K1/OE-LKB1细胞获取的条件培养基重悬,混匀的HUVEC细胞和条件培养基均匀铺于基质胶上,于细胞培养箱继续孵育4 h,镜下观察小管形成情况。
1.10 HUVEC迁移实验检测过表达LKB1对HUVEC细胞迁移能力的影响
在96孔板内,HUVEC细胞以每孔200 μl无血清培养基,含2×104细胞数的细胞密度接种于Transwell小室的上室,随后在96孔板内每孔接种800 μl条件培养基。96孔板置于细胞培养箱内孵育24 h,用棉签去除Transwell上室的细胞,并将Transwell小室下表面用4%多聚甲醛固定,0.1%结晶紫染色。倒置显微镜计数Transwell小室表面的细胞数,观察HUVEC细胞的迁移情况。
1.11 统计学分析
2 结果
2.1 LKB1在甲状腺癌及癌旁正常组织中的表达
免疫组化结果显示,p-LKB1蛋白阳性表达主要定位于细胞浆和细胞核,阴性表达定位于细胞核内,为棕色颗粒(见图1)。甲状腺癌组织p-LKB1蛋白的阳性表达率低于其在癌旁正常组织内的阳性表达率,差异有统计学意义(26.0%vs78.0%,P<0.05,见图1和表1)。
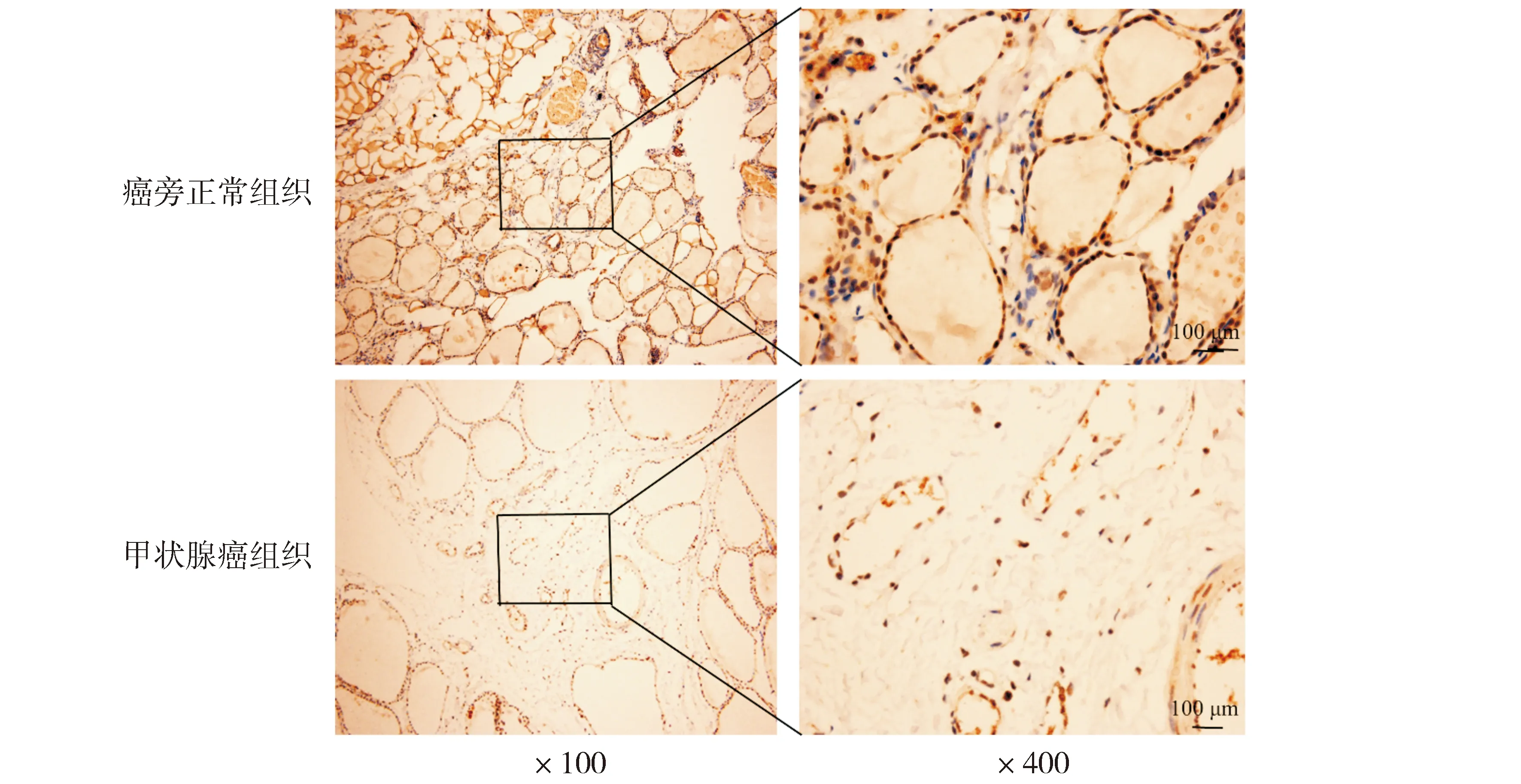
图1 p-LKB1在甲状腺癌组织及癌旁正常组织中的表达Figure 1 The expression of p-LKB1 in thyroid carcinoma and adjacent normal tissues

表1 甲状腺癌和癌旁正常组织中p-LKB1的表达
2.2 甲状腺癌组织中p-LKB1的表达与临床病理特征的关系
通过纳入年龄、性别、肿瘤大小、肿瘤包膜侵犯、淋巴结转移、临床分期以及肿物多中心性7个不同指标,探究甲状腺癌组织中p-LKB1的表达与其临床病理指标不同亚型间的关系。结果显示,p-LKB1的表达与甲状腺癌的肿瘤大小、包膜侵犯与否、是否淋巴结转移相关,差异有统计学意义(P<0.05),而与甲状腺癌患者的年龄、性别、临床分期及肿瘤是否多中心性无关(P>0.05,见表2)。

表2 甲状腺癌组织中p-LKB1表达与临床病理特征间的关系 (例)
2.3 LKB1过表达细胞系的成功构建
为开展后续实验,首先构建过表达LKB1的甲状腺癌细胞体系,即K1/NC(K1/negative control)和K1/OE-LKB1(K1/LKB1 overexpression)。Western blot结果显示,过表达LKB1的甲状腺癌细胞内p-LKB1蛋白表达显著高于其在NC组的表达(见图2A);且随后的PCR实验也验证了LKB1在甲状腺癌K1/OE-LKB1组内的高表达(见图2B)。这些提示成功构建LKB1过表达的甲状腺癌细胞模型。
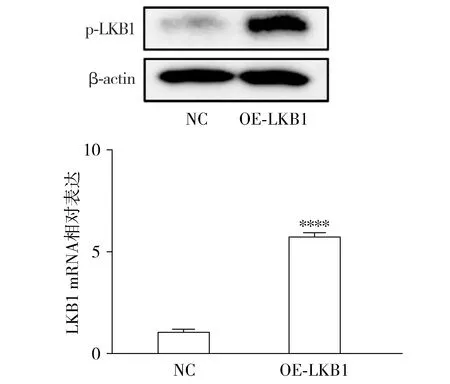
与NC组比较,****P<0.000 1图2 过表达LKB1甲状腺癌细胞系的构建及验证Figure 2 Construction and validation of thyroid carcinoma cells with LKB1 overexpression
2.4 LKB1在甲状腺癌中对VEGFA的影响
Western blot实验结果显示,过表达LKB1可以下调甲状腺癌K1细胞内VEGFA的蛋白表达水平(见图3A)。随后的ELISA结果显示过表达LKB1能够抑制K1细胞内VEGFA的分泌(见图3B)。这些结果提示LKB1抑制甲状腺癌K1细胞内VEGFA的表达。
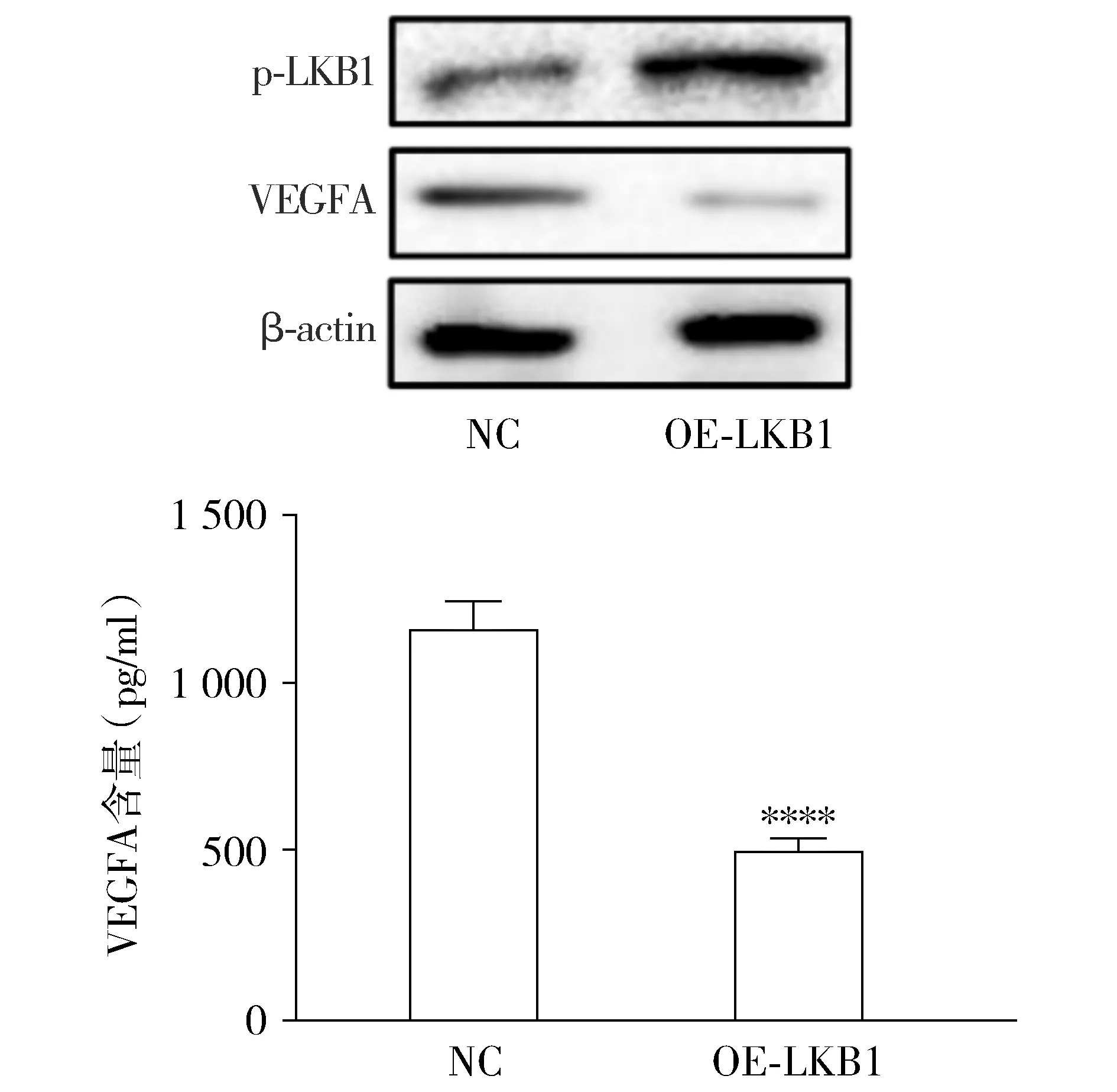
与NC组比较,****P<0.000 1图3 LKB1对甲状腺癌细胞内VEGFA的影响Figure 3 Effects of LKB1 on VEGFA in thyroid carcinoma cells
2.5 LKB1对甲状腺癌细胞血管形成和HUVEC招募的影响
为了明确LKB1对甲状腺癌新生血管形成的影响,小管形成实验结果显示,过表达LKB1细胞系的条件培养基能够抑制甲状腺癌细胞内小管的生成(见图4A)。随后的HUVEC细胞迁移实验显示,甲状腺癌K1细胞内LKB1的过表达能够抑制HUVEC细胞的迁移(见图4B)。这说明LKB1的过表达能够在体外抑制甲状腺癌的血管生成。

与NC组比较,**P<0.01,****P<0.000 1图4 LKB1过表达对甲状腺癌血管生成和HUVEC招募的影响 (×100)Figure 4 Effects of LKB1 overexpression on angiogenesis and HUVEC recruitment in thyroid carcinoma (×100)
3 讨论
LKB1基因位于人类染色体19p13.3,主要编码一个丝氨酸/苏氨酸蛋白激酶。研究显示LKB1的失活与多种肿瘤的发生发展密切相关[10]。但关于LKB1在甲状腺组织中的表达仅有初步报道[11]。鉴于此现状,本研究以甲状腺癌组织中LKB1的表达作为切入点,结果显示甲状腺癌组织中p-LKB1的阳性表达率显著低于癌旁正常组织。临床病理特征能够从多个不同方面、较为客观地反映患者的病情严重与否,因此分析蛋白表达与患者临床病理特征的关系可以间接地说明该蛋白对病情的影响[12]。本研究比较了甲状腺癌7个临床病理指标的不同亚型间LKB1蛋白的表达差异,结果显示癌组织LKB1在肿瘤大于1 cm、有包膜侵犯以及合并淋巴结转移的甲状腺癌患者中呈低表达,说明低表达的LKB1可视作甲状腺癌恶性程度高的标志之一,这与既往研究所述LKB1在肿瘤进程中的作用相符[13,14]。
文献报道LKB1的过表达对甲状腺癌K1细胞增殖与迁移能力有显著的抑制作用[8]。另有研究显示(V600E)BRAF的抑制能够通过LKB1-AMPK信号通路诱导甲状腺癌保护性自噬过程[15]。但目前LKB1对肿瘤血管生成的研究相对较少。早期的文献报道,LKB1的过表达可减缓乳腺癌的血管生成和侵袭转移能力[16]。本研究通过细胞生物学实验揭示过表达LKB1不仅能够抑制甲状腺癌K1细胞内VEGFA的表达及分泌,而且可以抑制K1细胞的血管新生及对HUVEC细胞的迁移。
综上所述,甲状腺癌组织中LKB1表达阳性率低于癌旁组织,且肿瘤大于1 cm有包膜侵犯以及合并淋巴结转移的甲状腺患者LKB1阳性表达率较低。此外LKB1的过表达可以抑制甲状腺癌K1细胞的血管生成。这些提示LKB1可能是影响甲状腺癌复发转移的重要指标,且LKB1有可能为临床抗甲状腺癌治疗提供新的潜在靶点。

