HMGB1/TLR4通路在白蛋白结合型紫杉醇致神经病理性疼痛大鼠脊髓的表达
魏 星,马 莉,李维妙,周雅卿,赵永林*
(1西安交通大学第二附属医院妇产科,西安 710004;2西安交通大学第二附属医院肿瘤科;*通讯作者,E-mail:zhaoyonglinlin@163.com)
神经毒性是紫杉类药物的主要剂量限制性副作用,常见有外周感觉性的痛觉过敏、灼痛、刺痛和麻木等不适症状。白蛋白结合型紫杉醇是紫杉醇与人血白蛋白结合制成的纳米微粒,与传统剂型紫杉醇相比,白蛋白结合型紫杉醇的使用剂量更大,提高了疗效,但同时也加重了紫杉醇药物的不良反应[1]。部分患者因无法耐受神经毒性而选择减量或者更换药物,治疗效果下降,因此阐明紫杉醇诱导神经病理性疼痛的机制显得尤为重要。
高迁移率族蛋白B1(high-mobility group protein B1,HMGB1)是主要存在于细胞核的内源性危险性信号分子。Toll样受体4(Toll-like receptor4,TLR4)是一种参与非特异性免疫反应的蛋白质分子[2]。HMGB1是TLR4的内源性配体之一,以HMGB1/TLR4通路为靶点可减轻脊神经损伤所致的神经性疼痛,HMGB1/TLR4通路也与紫杉醇所致的神经性疼痛有关,但是其机制尚不清楚,且HMGB1/TLR4通路在白蛋白结合型紫杉醇所致的神经毒性中的作用也不明确[3]。本研究通过建立白蛋白结合型紫杉醇所致的神经病理性疼痛大鼠模型,研究HMGB1/TLR4通路相关蛋白及下游炎性因子的表达变化,为揭示紫杉醇所致的神经性病理痛的病理生理机制提供理论依据。
1 材料与方法
1.1 动物分组
8~10周龄SPF级雄性SD大鼠36只,体质量250~300 g,购自西安交通大学实验动物中心,生产许可证号SCXK(陕西)2006-001。大鼠于25 ℃的环境中适应性喂养1周,被随机分为对照组和紫杉醇组,每组18只,每组6只用于形态学及免疫组化检测,6只用于Western blot检测,6只用于ELISA检测炎性因子水平。
1.2 主要仪器与试剂
白蛋白结合型紫杉醇(粉剂,规格:100 mg,纯度:99%,生产批号:B04190425)购自石药集团欧意药业有限公司,Von Frey细丝购自美国Stoelting公司,热痛刺激仪BME2410A购自中国医学科学院生物工程研究所,TNF-α、IL-1β和IL-6 ELISA试剂盒购自美国R&D Systems公司,内参抗体β-actin、MyD88、TRIF、IRF3、GFAP抗体购自美国Cell Signaling Technology公司,Iba-1抗体购自日本Wako公司,HMGB1、TLR4抗体购自英国Abcam公司,山羊抗兔SP试剂盒(IgG抗体)、DAB显色盒购自北京中杉金桥公司,RIPA裂解液、蛋白含量检测试剂盒、Western blot相关试剂购自上海碧云天生物技术有限公司。
1.3 动物模型制备
本研究中,白蛋白结合型紫杉醇经生理盐水溶解(0.5 mg/ml)后,以2.47 mg/kg的剂量隔日腹腔给药,共进行4次注射(第1,3,5,7天),最终累积剂量为9.9 mg/kg,经白蛋白结合型紫杉醇处理的大鼠为紫杉醇组[4]。对照组腹腔注射同剂量的生理盐水。实验第8天水合氯醛麻醉大鼠,暴露胸腔,生理盐水和多聚甲醛灌注固定脊髓。
1.4 行为学测定
采用Von Frey细丝和热痛刺激仪分别测定大鼠实验前(day 0)、白蛋白结合型紫杉醇或生理盐水注射后第4天(day 4)和第8天(day 8)的机械刺激缩足反射阈值(mechanical withdrawal threshold,MWT)和热刺激缩足反射潜伏期(thermal withdrawal latency,TWL)作为痛阈观察指标。
热刺激缩足反射潜伏期测定:用左后足TWL作为反映大鼠热痛阈的指标。将大鼠置于透明的有机玻璃箱中,待其处于安静状态时,将红外辐射热刺激发生器的加热中心对准大鼠后足跖面进行连续辐射,待大鼠出现抬腿动作时,仪器可以自动记录此时间点(s),即为大鼠的TWL。每只大鼠试验5次,每次间隔5 min。
机械刺激缩足反射阈值测定:将大鼠置于底部为铁丝网的塑料笼中,适应30 min,用代表不同压力(最小0.4 g,最大26.0 g)的Von Frey探针刺激大鼠右后足10次,每次持续3~5 s,每次刺激间隔大于2 min。观察大鼠的缩足反应次数,根据公式计算大鼠的MWT(g),作为反映大鼠机械痛阈指标。
1.5 Western blot检测TLR4通路相关蛋白MyD88、TRIF、IRF3的表达
腹腔注射10%水合氯醛麻醉大鼠。心脏灌注4 ℃生理盐水后,快速取出L4-6脊髓组织,液氮速冻,-80 ℃保存。取冻存脊髓组织加入蛋白裂解液,15 000 r/min离心10 min,收集上清,即为细胞总蛋白。BCA试剂盒测定蛋白质样品浓度。按照每孔30 μg加样,蛋白质样品通过凝胶电泳分离,电泳结束后利用湿转法使蛋白转移到PVDF膜上,脱脂奶粉室温封闭1 h,加入一抗:β-actin(1 ∶1 000)、髓样分化初反应蛋白88(myeloid differentiation primary response protein 88,MyD88)(1 ∶500)、含有TIR结构能诱导干扰素β的接头分子(TIR-domain-containing adapter-inducing interferon-β,TRIF)(1 ∶500)、干扰素调节因子3(interferon regulatory factor 3,IRF3)(1 ∶500),4 ℃孵育过夜,TBST漂洗,加入HRP标记的山羊抗鼠二抗(1 ∶5 000)室温孵育2 h,化学发光法显色,拍照,Image J软件定量分析。
1.6 HE染色观察脊髓病理改变
10%的水合氯醛溶液麻醉大鼠,经左心室灌注生理盐水,并继续快速推注4%多聚甲醛约150 ml,最后4%多聚甲醛缓慢滴注15 min,大鼠肢体僵硬后,快速取出L4-6脊髓组织。常规石蜡包埋脊髓组织,5 μm厚度切片。HE染色,常规脱蜡、水化、染色、冲洗、中性树胶封片,光镜观察脊髓组织细胞形态。
1.7 免疫组化染色检测脊髓组织中GFAP、Iba-1、HMGB1及TLR4的表达
取石蜡切片,脱蜡、水化如前,过氧化氢消除内源性过氧化物酶,高压抗原修复,血清室温封闭30 min,分别加HMGB1抗体(1 ∶300)、TLR4抗体(1 ∶200)、Iba-1抗体(1 ∶400)或、GFAP抗体(1 ∶200),4 ℃过夜。生物素化二抗37 ℃孵育30 min,辣根酶标记链霉卵白素37 ℃孵育30 min。DAB显色、苏木素溶液复染,常规脱水、封片。光镜观察,显微镜成像系统采集图片,生物医学图像分析系统分析结果。GFAP为星形胶质细胞活化标志物,Iba-1为小胶质细胞活化标志物,GFAP及Iba-1表达升高提示胶质细胞活化增强。
免疫组化结果判定[5]:每张切片随机选取3个有代表性的高倍视野,免疫组化评分采用染色强度与阳性细胞数相结合的综合评价,二者评分乘积为最终结果。染色强度评分:无染色0分,轻度黄染1分,中度黄染2分,重度黄染3分。阳性细胞数百分比评分:无染色0分,1%~10%细胞染色1分,11%~50%为2分;51%~80%为3分,81%~100%为4分。
1.8 ELISA检测脊髓组织中TNF-α、IL-6、IL-1β的水平
称取各组大鼠脊髓组织,加入生理盐水后用电动匀浆器匀浆成匀浆液。采用ELISA试剂盒按照说明书步骤检测各组大鼠脊髓匀浆液中TNF-α、IL-1β和IL-6含量,二抗浓度1 ∶5 000,用酶标仪在450 nm波长下测定吸光度,计算样品浓度。
1.9 统计学分析
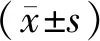
2 结果
2.1 白蛋白结合型紫杉醇成功构建大鼠神经病理性疼痛模型
在开始给药后第4天及第8天,紫杉醇组MWT、TWL较对照组均明显降低,差异均有统计学意义(P<0.05,见图1),提示白蛋白结合型紫杉醇致神经病理性疼痛大鼠模型成功建立。
与对照组相比,*P<0.05图1 白蛋白结合型紫杉醇对大鼠MWT、TWL的影响Figure 1 Effects of nab-paclitaxel on MWT and TWL of rats
2.2 大鼠脊髓的病理学改变及HMGB1、TLR4的表达变化
HE染色结果表明:对照组大鼠L4-6脊髓组织中,神经元结构完整,核膜结构清晰,核仁明显,染色质分布均匀,细胞无水肿;而紫杉醇组大鼠L4-6脊髓组织中,神经细胞层次排列紊乱,神经元固缩、扭曲,细胞体变形,部分细胞可见水肿(见图2)。免疫组化结果表明:与对照组相比,紫杉醇组大鼠L4-6脊髓组织中HMGB1及TLR4的表达明显升高,差异均有统计学意义(P<0.05,见图3)。
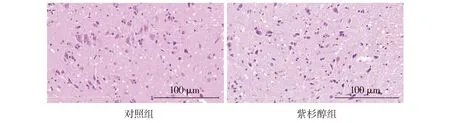
图2 HE染色观察大鼠脊髓的病理学改变Figure 2 Pathological changes of spinal cord in rats by HE staining
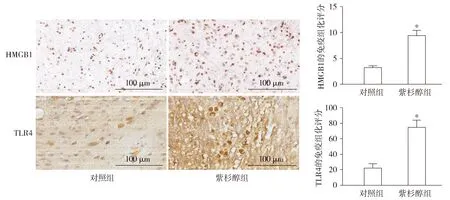
与对照组相比,*P<0.05图3 免疫组化检测大鼠脊髓HMGB1、TLR4的表达变化Figure 3 The expression of HMGB1 and TLR4 in the rat spinal cord by immumohistochemical staining
2.3 白蛋白结合型紫杉醇对大鼠L4-6脊髓胶质细胞活化的影响
免疫组化结果表明:与对照组相比,紫杉醇组大鼠L4-6脊髓组织中GFAP及Iba-1的表达明显升高,差异均有统计学意义(P<0.05,见图4),提示白蛋白结合型紫杉醇可介导大鼠脊髓组织中的胶质细胞活化。
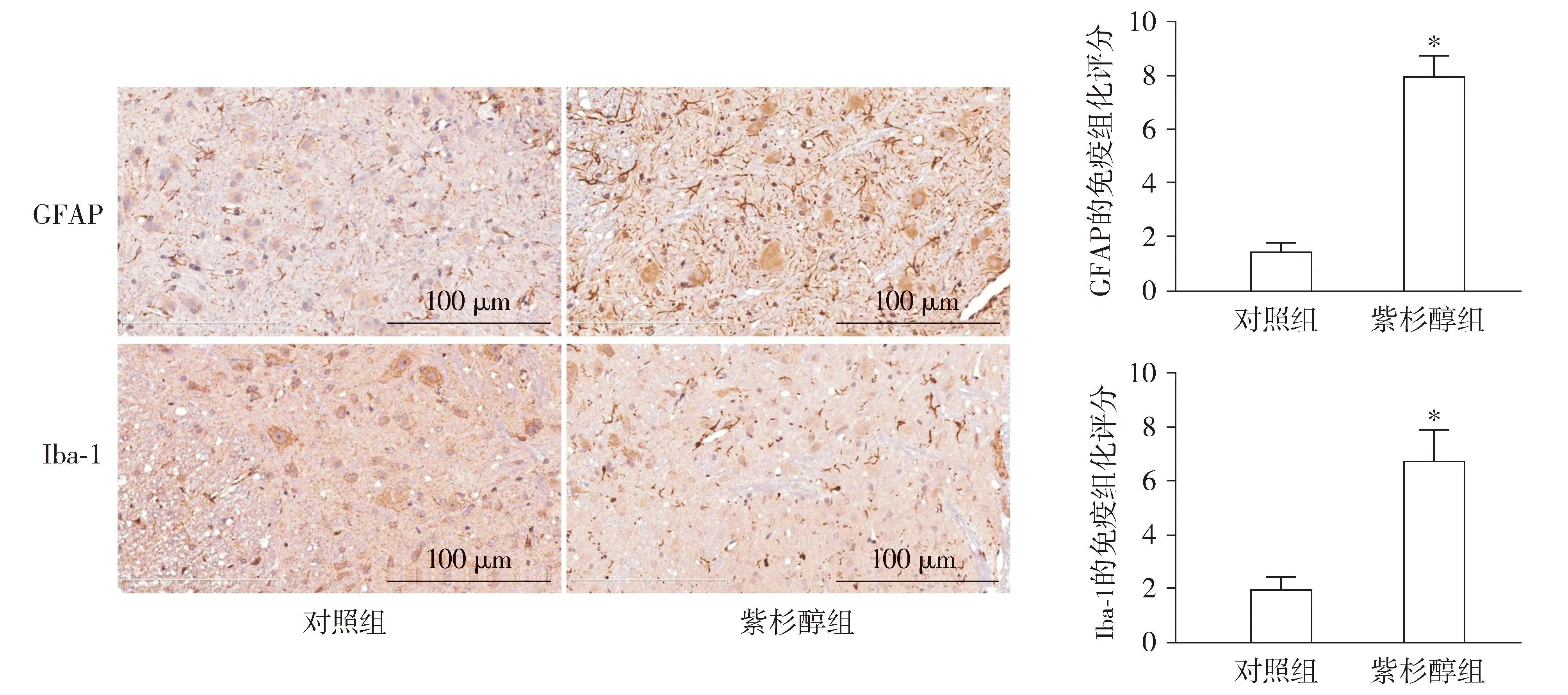
与对照组相比,*P<0.05图4 白蛋白结合型紫杉醇诱导大鼠L4-6脊髓中胶质细胞活化Figure 4 Nab-paclitaxel promotes glial cell activation in L4-6 rat spinal cord by immumohistochemical staining
2.4 白蛋白结合型紫杉醇可激活大鼠脊髓组织中的TLR4通路
Western blot结果显示,与对照组相比,紫杉醇组TLR4通路相关蛋白MyD88、TRIF、IRF3的表达明显增加,差异有统计学意义(P<0.05,见图5),提示TLR4通路可能参与白蛋白结合型紫杉醇诱导的神经病理性疼痛。

与对照组相比,*P<0.05图5 Western blot检测白蛋白结合型紫杉醇对大鼠脊髓组织中的TLR4通路的影响Figure 5 Effect of nab-paclitaxel on the TLR4 pathway in rat spinal cord by Western blot
2.5 白蛋白结合型紫杉醇升高大鼠脊髓组织中的炎性因子水平
ELISA结果表明:与对照组相比,紫杉醇组大鼠L4-6脊髓组织中TNF-α、IL-1β和IL-6的含量明显升高(P<0.05,见图6),结果提示白蛋白结合型紫杉醇诱导的神经病理性疼痛可能与炎性因子水平升高有关。
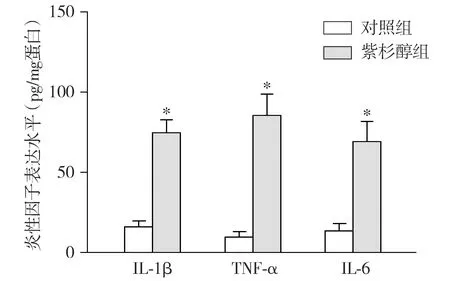
与对照组相比,*P<0.05图6 ELISA检测白蛋白结合型紫杉醇对大鼠脊髓组织中的炎性因子水平的影响Figure 6 Effect of nab-paclitaxel on the levels of inflammatory factors in the spinal cord of rats by ELISA
3 讨论
由于白蛋白结合型紫杉醇避免了有毒溶剂产生的不良反应,增加了紫杉醇的安全使用剂量,大幅提高了治疗的有效率,且中性粒细胞减少等不良反应更轻,但是神经病理性疼痛的发生率略有增加,而采用抗炎药、阿片类药物、抗抑郁药等并不能明显缓解此类型的疼痛。既往文献表明紫杉醇导致的病理性疼痛可能与脊髓及背根神经节的免疫调节、线粒体功能障碍、离子通道表达异常等有关,但具体机制仍不明确[6]。
生理状况下HMGB1主要存在于细胞核,释放到胞外则具有促炎症作用。在应激状态、机体损伤、炎症等过程中都可以引起HMGB1的释放[7]。既往研究发现HMGB1及其受体在脊髓背角及背根神经节中都有表达,在脊神经结扎所致的外周神经损伤模型中,脊髓背根神经节中的HMGB1主要表达于神经元、星形胶质细胞及小胶质细胞[8]。HMGB1与病理性疼痛的发生密切相关,在大鼠的坐骨神经或脊髓注射外源性的HMGB1可以诱导机械性痛觉超敏;给神经痛的大鼠注射HMGB1特异性中和抗体,则能减轻大鼠的机械性痛觉超敏[9,10]。本研究结果提示白蛋白结合型紫杉醇作用大鼠后可成功诱导大鼠的痛觉过敏,同时L4-6脊髓中HMGB1的表达较对照组明显升高,提示HMGB1可能也参与紫杉醇导致的神经病理性疼痛的发生。
HMGB1被释放到细胞外后可以激活相关的细胞信号转导受体,比如Toll样受体家族、RAGE受体家族、JNK受体家族等。TLR4可通过MyD88依赖及MyD88非依赖途径激活下游通路,TLR4的激活还依赖于一些接头蛋白TRIF、IRF3等的参与。研究表明TLR4是HMGB1的下游信号,上调HMGB1可促进TLR4表达[2]。TLR4能够引发巨噬细胞胞内信号流,激活NF-κB、PI3K等信号通路,最终导致炎症因子TNF-α、IL-6等的释放[11]。此外,炎性因子TNF-α和IL-6也能引起HMGB1的释放,血浆中或者神经组织中的HMGB1又可调节致敏性损伤、诱导炎性因子的释放,进而形成正反馈循环[12,13]。在术后慢性疼痛模型、脊髓损伤导致的慢性疼痛模型及普通剂型紫杉醇导致的神经病理性疼痛模型中,TLR4通路均被激活,而抑制TLR4通路能一定程度缓解疼痛[14-16]。本研究也表明白蛋白结合型紫杉醇可导致大鼠L4-6脊髓TLR4的表达明显升高,且TLR4通路的相关蛋白MyD88、TRIF、IRF3的表达及下游炎症细胞因子TNF-α、IL-1β及IL-6的水平也升高,表明TLR4信号通路可能与神经病理性疼痛有关,且HMGB1是TLR4的重要配体之一,白蛋白结合型紫杉醇可能通过释放HMGB1,激活TLR4通路介导疼痛的发生。
胶质细胞在脊髓中分布广泛,在疼痛等病理条件下,胶质细胞被激活,胶质细胞标志物GFAP、Iba-1的表达增强,炎性因子TNF-α、IL-1β、IL-6等大量释放[17]。本实验研究表明白蛋白结合型紫杉醇使大鼠脊髓内小胶质细胞及星形胶质细胞的标志物GFAP及Iba-1的表达升高,提示两种胶质细胞均被激活。既往研究发现,在神经病理性疼痛的形成过程中,小胶质细胞被激活,并激活星形胶质细胞,而星形胶质细胞可能在神经病理性疼痛的产生和维持中起着重要的作用[18,19]。
综上,白蛋白结合型紫杉醇可导致大鼠脊髓HMGB1/TLR4通路相关蛋白及下游炎性因子的表达增加,并促进胶质细胞活化,HMGB1/TLR4通路可能与白蛋白结合型紫杉醇导致的神经病理性疼痛有关。

