高迁移率族蛋白B1抑制剂对白蛋白结合型紫杉醇致神经病理性疼痛的抑制作用及其机制
王 力,马 莉,贾丽君,周雅卿,赵永林
(西安交通大学第二附属医院肿瘤科,西安 710004;*通讯作者,E-mail:zhaoyonglinlin@163.com)
较之于传统的溶剂型紫杉醇,白蛋白结合型紫杉醇剂量使用更高,过敏反应更少,用药前无需预处理。白蛋白结合型紫杉醇常见的不良反应是剂量限制性的神经毒性,表现为局部有灼热感、刺痛或肌肉痛等,也称为神经病理性疼痛,对患者的生活质量造成严重影响[1]。临床常用的止疼药物不能有效缓解紫杉醇导致的神经病理性疼痛,紫杉醇导致神经病理性疼痛的机制仍需进一步探讨。
高迁移率族蛋白B1(high mobility group box 1,HMGB1)主要参与DNA的修复、转录和基因组稳定,具有促进炎症、免疫、凋亡等作用[2]。既往发现HMGB1参与多种疼痛的发生、发展,在慢性炎性疼痛、慢性缩窄性损伤、糖尿病神经性疼痛等动物模型中,HMGB1的表达升高,而抑制HMGB1可以使疼痛缓解[3-5]。此外,HMGB1及其受体Toll样受体-4(Toll-like receptor 4,TLR4)也参与紫杉醇导致的神经病理性疼痛的发生,但HMGB1及其抑制剂Glycyrrhizin在白蛋白结合型紫杉醇导致的神经病理性疼痛的作用及机制尚不明确[6]。本研究通过建立白蛋白结合型紫杉醇所致的神经病理性疼痛模型,探究HMGB1抑制剂Glycyrrhizin是否可缓解白蛋白结合型紫杉醇导致的神经病理性疼痛,并探讨其潜在机制。
1 材料与方法
1.1 动物分组
8~10周龄SPF级雄性SD大鼠54只,体质量为250~300 g,购自西安交通大学实验动物中心,生产许可证号:SCXK(陕西)2006-001,大鼠饲养于24 ℃的恒温环境中,自由饮水。将大鼠随机分为对照组、紫杉醇组和紫杉醇+Glycyrrhizin(Gly)组,每组18只。
1.2 主要试剂与仪器
白蛋白结合型紫杉醇(粉剂,规格:100 mg,纯度:99%,生产批号:B04190425)购自石药集团欧意药业有限公司,Glycyrrhizin购自美国Sigma-Aldrich公司,HMGB1、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)、神经微丝轻链蛋白(neurofilament light,NF-L)、神经微丝中链蛋白(neurofilament medium,NF-M)抗体、核因子κB(nuclear factor kappa-B,NF-κB)购自美国Cell Signaling Technology公司,离子钙接头蛋白(ionized calcium bindingadaptor molecule-1,Iba-1)抗体购自日本Wako公司,TLR4抗体购自英国Abcam公司,肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)和白细胞介素6(interleukin-6,IL-6)ELISA试剂盒购自美国R&D Systems公司。免疫组化SP试剂盒、DAB显色盒购自北京中杉金桥公司,RIPA裂解液、蛋白含量检测试剂盒、Western blot相关试剂购自上海碧云天生物技术有限公司。电子Von-Frey测痛仪购自美国IITC公司。
1.3 神经病理性疼痛模型制备
生理盐水溶解白蛋白结合型紫杉醇,紫杉醇组大鼠实验开始第1,3,5,7天腹腔注射,单次给药剂量为2.47 mg/kg,共注射4次,紫杉醇最终累积剂量为9.9 mg/kg[7]。紫杉醇+Gly组:除了腹腔注射白蛋白结合型紫杉醇外(第1,3,5,7天腹腔注射,每次2.47 mg/kg),实验开始后每天腹腔注射Glycyrrhizin 50 mg/kg,连续7 d[8]。对照组第1,3,5,7天腹腔注射同剂量的生理盐水。实验第8天处死大鼠,取L4-6组脊髓。
1.4 大鼠神经痛的行为学检测
采用von Frey细丝和热刺激仪于实验开始前(day 0)、实验开始后第4天(day 4)和第8天(day 8)对大鼠进行行为学测试。将von Frey细丝实验测定的机械刺激缩足反射阈值(mechanical withdrawal threshold,MWT)和热刺激实验测定的热刺激缩足反射潜伏期(thermal withdrawal latency,TWL)作为行为学评价指标。
热刺激缩足反射潜伏期测定:将单只大鼠置于透明的玻璃箱中,使其在安静的环境中适应30 min,采用热痛刺激仪分别照射大鼠左后足底部,当大鼠出现特征性舔爪或提爪时为阳性反应,停止照射,记录大鼠响应热刺激的潜伏时间(s)即为TWL。每只大鼠测试5次,每次间隔5 min。
机械刺激缩足反射阈值测定:大鼠于塑料盒中适应30 min,用代表不同压力(最小0.4 g,最大26.0 g)的Von Frey探针刺激大鼠右后足,每次持续5 s,当大鼠出现快速缩足定义为阳性反应,记录此时刺激压力,计算大鼠的MWT(g),每只大鼠测试5次,每次刺激间隔大于2 min,取平均值。
1.5 Western blot检测TLR4及NF-κB的表达
取大鼠脊髓,匀浆后加入适量蛋白裂解液,BCA试剂盒测定蛋白浓度。蛋白经煮沸变性,用10% SDS-PAGE分离蛋白,将蛋白电转至PVDF膜。用5%脱脂奶粉在室温封闭1 h,加入相应一抗:β-actin(1 ∶1 000)、TLR4(1 ∶1 000)、NF-κB(1 ∶1 000),4 ℃孵育过夜,TBST漂洗,用相应的二抗在室温孵育PVDF膜1 h。化学发光成像系统显影、成像。采用Image J图像分析软件分析各条带。以TLR4、NF-κB蛋白条带灰度值与β-actin条带灰度值的比值表示TLR4、NF-κB蛋白的相对表达量。
1.6 免疫组化染色检测GFAP、Iba-1、NF-L、NF-M及HMGB1在脊髓组织中的表达
大鼠L4-6脊髓组织经常规石蜡包埋后切片,常规二甲苯脱蜡、梯度乙醇水化,用过氧化氢消除内源性过氧化物酶,高压修复抗原,室温封闭30 min,分别加入HMGB1抗体(1 ∶200)、NF-L抗体(1 ∶200)、NF-M抗体(1 ∶200)、Iba-1抗体(1 ∶400)、GFAP抗体(1 ∶200),4℃过夜。切片漂洗后二抗37 ℃孵育30 min,辣根酶标记链霉卵白素37 ℃孵育30 min。DAB显色、苏木素溶液复染,梯度乙醇脱水、封片。每张切片随机选取6个视野,Leica-Q550CW图像分析系统采集图像。结果用免疫组化评分表示,评分为染色强度与阳性细胞数的乘积。染色分为无染色、轻度、中度、重度,分值分别为0,1,2,3分。阳性细胞数百分比评分:无染色,0分;1%~10%细胞染色,1分;11%~50%,2分;51%~80%,3分,81%~100%,4分。故免疫组化评分最高为12分,最低0分。
1.7 ELISA检测炎性因子TNF-α、IL-6、IL-1β的水平
取-80 ℃保存的各组大鼠脊髓组织上清液,使用自动分光光度计,采用ELISA试剂盒按照说明书步骤检测脊髓组织上清液中TNF-α、IL-1β和IL-6的含量,二抗浓度1 ∶5 000,用酶标仪在450 nm波长下测定吸光度,计算样品浓度。
1.8 统计学分析
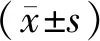
2 结果
2.1 抑制HMGB1对白蛋白结合型紫杉醇导致的神经病理性疼痛的影响
实验开始后第4,8天,与对照组相比,紫杉醇组MWT和TWL的值均明显降低(P<0.05),提示神经病理性疼痛模型构建成功;与紫杉醇组相比,紫杉醇+Gly组MWT、TWL的值均升高(P<0.05,见图1)。

与对照组相比,*P<0.05;与紫杉醇组相比,#P<0.05图1 Glycyrrhizin减轻大鼠的神经病理性疼痛FIgure 1 Glycyrrhizin alleviates neuropathic pain of rats
2.2 Glycyrrhizin对神经病理性疼痛大鼠脊髓神经微丝蛋白表达的影响
对照组脊髓NF-L、NF-M几乎不表达,HMGB1的表达较少;与对照组相比,紫杉醇组HMGB1及神经微丝蛋白NF-L、NF-M的表达均明显升高,差异有统计学意义(P<0.05);与紫杉醇组相比,紫杉醇+Gly组HMGB1、NF-L、NF-M的表达均减少,差异有统计学意义(P<0.05,见图2)。

HMGB1主要阳性表达于神经细胞的细胞核,少量在细胞质;NF-M及NF-L主要阳性表达于神经细胞轴突与对照组相比,*P<0.05;与紫杉醇组相比,#P<0.05图2 大鼠脊髓组织中HMGB1及神经微丝蛋白的表达变化FIgure 2 Expression of HMGB1 and neurofilament protein in spinal cord of rats
2.3 Glycyrrhizin对神经病理性疼痛大鼠脊髓中胶质细胞活化的影响
对照组大鼠脊髓GFAP及Iba-1的表达较少;与对照组相比,紫杉醇组大鼠脊髓组织中GFAP及Iba-1的表达明显升高;与紫杉醇组相比,紫杉醇+Gly组GFAP及Iba-1的表达降低,差异均有统计学意义(P<0.05,见图3),提示HMGB1抑制剂可抑制白蛋白结合型紫杉醇介导的胶质细胞活化。
GFAP主要阳性表达于星形胶质细胞胞质,Iba-1主要阳性表达于小胶质细胞胞质与对照组相比,*P<0.05;与紫杉醇组相比,#P<0.05图3 Glycyrrhizin抑制神经病理性疼痛大鼠脊髓中的胶质细胞活化FIgure 3 Glycyrrhizin inhibits glial response in the spinal cord of rat with neuropathic pain
2.4 Glycyrrhizin对神经病理性疼痛大鼠脊髓中TLR4/NF-κB通路的影响
与对照组相比,紫杉醇组大鼠L4-6脊髓组织中TLR4及NF-κB的表达明显升高;与紫杉醇组相比,紫杉醇+Gly组TLR4及NF-κB的表达降低,差异均有统计学意义(P<0.05,见图4),提示HMGB1可能通过TLR4/NF-κB通路参与白蛋白结合型紫杉醇介导的神经病理性疼痛。

与对照组相比,*P<0.05;与紫杉醇组相比,#P<0.05图4 大鼠脊髓TLR4及NF-κB的表达水平FIgure 4 The expression levels of TLR4 and NF-κB in the rat spinal cord
2.5 Glycyrrhizin对神经病理性疼痛大鼠脊髓组织中炎性因子水平的影响
ELISA结果显示,对照组中TNF-α、IL-1β和IL-6的含量均较低;与对照组相比,紫杉醇组大鼠L4-6脊髓组织中TNF-α、IL-1β和IL-6的含量升高(P<0.05);而与紫杉醇组相比,紫杉醇+Gly组炎性因子的水平则降低,差异均有统计学意义(P<0.05,见图5)。
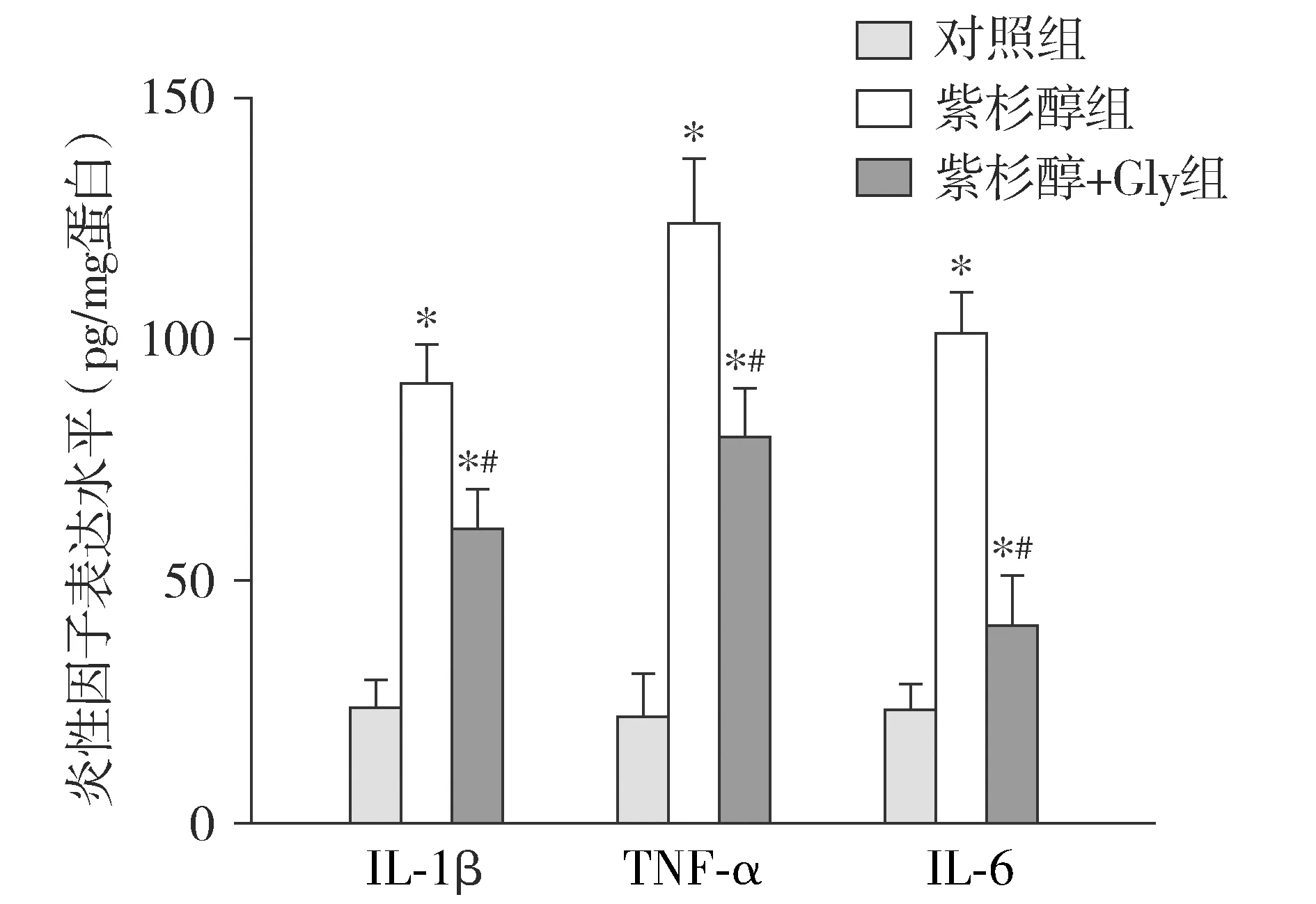
与对照组相比,*P<0.05;与紫杉醇组相比,#P<0.05图5 神经病理性疼痛大鼠脊髓组织中TNF-α、IL-1β和IL-6水平FIgure 5 Levels of TNF-α, IL-1β and IL-6 in the spinal cord of rats with neuropathic pain
3 讨论
神经毒性是紫杉醇药物常见的不良反应之一,尤其是白蛋白结合型紫杉醇的神经毒性发生率更高,且尚无有效的缓解方法,因此阐明紫杉醇所致神经毒性的潜在机制显得尤其重要。HMGB1是具有促炎作用的核蛋白,可与TLR4结合,激活下游的NF-κB等信号通路,促进炎性细胞因子释放,本研究探究了HMGB1/TLR4通路在白蛋白结合型紫杉醇导致的神经病理性疼痛中的作用。
本研究中给予大鼠腹腔注射白蛋白结合型紫杉醇后,能成功诱导神经病理性疼痛,L4-6脊髓组织中HMGB1的表达明显升高,而给予HMGB1的抑制剂后,HMGB1的表达减少,大鼠MWT、TWL等行为学改善,提示白蛋白结合型紫杉醇诱导的脊髓组织中HMGB1的升高可能与神经病理性疼痛相关。既往研究也发现HMGB1与多种类型的神经病理性疼痛有关[3-5,9-11]。在慢性炎性疼痛模型及慢性缩窄性损伤模型中,大鼠脊髓HMGB1被激活、释放,HMGB1被抑制后可以缓解疼痛[3,4,9]。在纤维肌痛及糖尿病神经性疼痛的模型中,HMGB1的表达也升高,且与疼痛的发生有关[5,10]。此外,在紫杉醇、奥沙利铂或长春新碱处理的啮齿动物中,抑制或降低HMGB1的水平可以减轻化疗导致的周围神经病变,HMGB1似乎是疼痛发生的共同启动因子[11]。
本研究中HMGB导致的神经病理性疼痛可能与其介导的脊髓神经微丝蛋白紊乱有关。神经微丝蛋白是特异性表达于中枢及外周神经系统中的神经元及其轴突中的细胞骨架主要结构单位。神经微丝蛋白由轻型(NF-L)、中型(NF-M)、重型(NF-H)蛋白和α-介连蛋白组成。神经微丝蛋白在神经元胞体或轴突的异常堆积是运动神经元疾病的标志,也被认为是神经元轴突降解的标志物。而本研究结果提示紫杉醇作用大鼠后,脊髓组织中NF-L、NF-M的表达明显升高,提示紫杉醇导致的轴突损伤可能与疼痛的发生有关,而抑制HMGB1的表达可降低NF-L、NF-M的表达,并缓解紫杉醇导致的神经病理性疼痛。最新研究也表明:在新型冠状病毒性肺炎康复后伴有慢性疼痛的患者血清中,NF-L的水平明显升高,NF-L可能作为COVID-19持续性神经性疼痛的潜在生物标志物[12]。在大鼠脊神经结扎构建的疼痛模型中,NF-L多肽的水平升高,而miR-7a可通过抑制NF-L多肽,阻断转录信号通路激活因子,改善神经性疼痛[13]。神经微丝蛋白在疼痛发生发展中的作用尚不明确,其参与疼痛发生的机制仍需进一步研究。
HMGB1是TLR4的配体之一,二者结合后可激活Toll-IL-1受体同源区,激活下游NF-κB相关信号通路,诱导多种炎症因子的表达及释放,导致热痛觉过敏,最终引起神经性疼痛[14]。既往研究也表明TLR4/NF-κB参与多种疼痛的病理过程,在术后疼痛、慢性收缩性损伤导致的疼痛、糖尿病神经性疼痛及化疗药物导致的神经病理性疼痛模型中,TLR4/NF-κB通路均过度激活,本研究结果与既往研究结果一致[15-18]。且本研究中减少HMGB1的表达则可通过抑制TLR4/NF-κB通路减轻白蛋白结合型紫杉醇导致的病理性疼痛。炎性因子TNF-α、IL-1β和IL-6可导致神经病理性疼痛,TNF-α、IL-1β和IL-6受体拮抗剂可有效缓解神经病理性疼痛动物模型的痛觉过敏[19,20],但是炎性因子导致疼痛发生的作用机制尚不明确,需进一步研究。
综上,白蛋白结合型紫杉醇作用大鼠后,可诱导脊髓HMGB1表达升高,HMGB1抑制剂可通过抑制TLR4/NF-κB通路、减少炎性因子TNF-α、IL-1β和IL-6的释放,减轻细胞骨架紊乱,缓解神经病理性疼痛。

