结直肠癌组织中lncRNA TUSC7与miR-1270表达的相关性及临床病理意义
姜 辉,任维聃,刘桂伟,冶浩鹏,郭庆金,耿学辰,姜国胜
(1.河北省沧州市人民医院肛肠外科,河北 沧州 061000 2.河北省沧州市中心医院结直肠肛门外科,河北 沧州 061000)
结直肠癌(colorectal cancer,CRC)是一种多发于40岁以上中老年人的癌症,由于饮食及生活习惯的改变,其发生率逐年上升[1]。因此,寻找与CRC相关,且可评估CRC患者预后的标志物尤为关键。微小RNA(microRNA,miRNA)和长链非编码RNA(long non-coding RNA,lncRNA)均是不能编码蛋白的RNA分子,两者均可能参与CRC发生发展[2,3]。近期报道显示,lncRNA肿瘤抑制候选基因7(lncRNA tumor suppressor candidate 7,lncRNA TUSC7)在CRC中呈低表达,与CRC患者预后密切相关[4];微小RNA-1270(microRNA-1270,miR-1270)在胃癌中表达上调,高表达miR-1270与患者不良预后相关,miR-1270可能是诊治胃癌的潜在靶标[5]。基于上述研究,本文检测了miR-1270在CRC组织中的表达情况,分析其与lncRNA TUSC7、CRC预后关系,为临床诊治CRC提供新参考。
1 资料与方法
1.1一般资料:选取2018年6月至2019年1月本院诊治的CRC患者130例进行研究,年龄42~70岁,平均年龄(58.07±10.66)岁,<60岁67例,≥60岁63例;低分化45例,中、高分化85例;男71例,女59例;浸润深度:T1~T2 78例,T3~T4 52例;病理类型:浸润型15例,隆起型26例,溃疡型89例;淋巴结转移48例,淋巴结未转移82例;肿瘤直径:< 5cm 61例,≥5cm 69例;TNM分期:Ⅲ~Ⅳ期54例,Ⅰ~Ⅱ期76例。本院伦理委员会批准本研究,受试者和家属对此研究知情同意。CRC患者纳入标准:①符合CRC诊断标准[6],经病理诊断为原发性CRC;②患者病例及检查资料齐全;③入院前未行放化疗、靶向治疗等抗肿瘤治疗;④除CRC外,不伴有其他原发性肿瘤。排除标准:①随访资料缺失、病理类型难以判定者;②合并严重脏器病变者。
1.2方 法
1.2.1lnCAR数据库检索:采用lnCAR数据库(https://lncar.renlab.org/#1st-screen)检索CRC和正常结直肠组织中lncRNA TUSC7表达情况。
1.2.2标本收集:收集130例CRC患者行根治性手术切除的CRC组织、癌旁组织(距肿瘤边缘≥5 cm),生理盐水清洗,立即放入液氮罐(冻存24h),移至-80℃冰箱。
1.2.3实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)法检测lncRNA TUSC7、miR-1270表达水平:取出-80℃冰箱储存的CRC和癌旁组织,无菌条件下,研钵中研碎,添加Trizol Reagent(简石生物技术有限公司,CT2001)以提取CRC和癌旁组织中的总RNA;使用MultiMACS(TM) cDNA Synthesis Kit(美国Miltenyi公司,130-094-410)将总RNA反转录成cDNA;最终,应用SYBR Green qPCR Master Mix(美国MCE公司,HY-K0501)、qRT-PCR仪(美国ABI公司,PRISM®7900HT)扩增cDNA,读取各基因循环阈值(CT值)。扩增参数:98.4℃预变性8min;97.6℃变性15s,64.5℃退火10s,68.2℃延伸15s,40个循环。GAPDH、U6分别是lncRNA TUSC7、miR-1270的内参基因(引物序列见表1)。lncRNA TUSC7、miR-1270相对表达量以2-△△CT法计算。

表1 lncRNA TUSC7 GAPDH miR-1270 U6引物序列
1.2.4生物信息学网站预测lncRNA TUSC7与miR-1270的关系:使用生物信息学网站(http://starbase.sysu.edu.cn/)预测lncRNA TUSC7与miR-1270间的关系。
1.3随访:以电话、入户等方式跟踪随访CRC患者6~36个月,以CRC患者手术后次日作为随访起点,随访截至CRC患者死亡或2022年1月。

2 结 果
2.1lnCAR数据库中CRC组织与正常结直肠组织lncRNA TUSC7表达水平比较:lnCAR数据库分析显示,CRC组织lncRNA TUSC7表达水平较正常结直肠组织降低(P<0.05)。见图1。
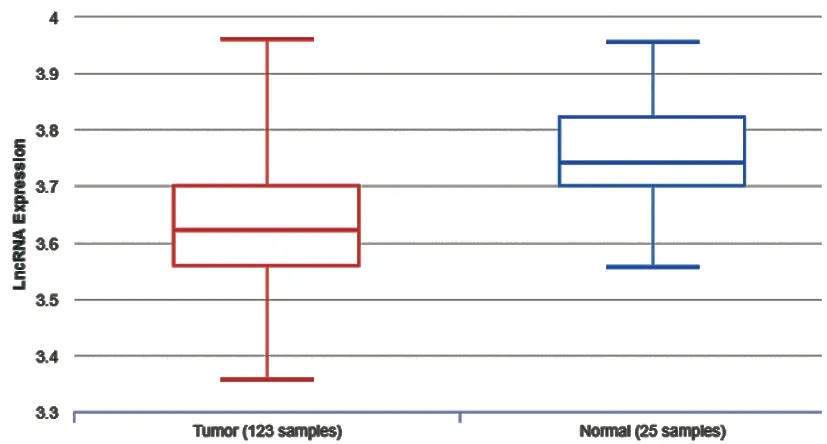
图1 lnCAR数据库中CRC和正常结直肠组织中lncRNA TUSC7表达水平比较
2.2癌旁和CRC组织中lncRNA TUSC7、miR-1270表达水平比较:CRC组织中lncRNA TUSC7表达水平较癌旁组织降低(P<0.05),miR-1270表达水平较癌旁组织升高(P<0.05)。见表2。

表2 癌旁/CRC组织中lncRNA TUSC7 miR-1270表达水平比较
2.3CRC组织lncRNA TUSC7、miR-1270表达水平与临床病理特征的关系:以CRC组织lncRNA TUSC7、miR-1270表达水平的中位数(0.39、2.67)为界值,以低于lncRNA TUSC7、miR-1270表达水平中位数的CRC患者为lncRNA TUSC7低表达组(66例)、miR-1270低表达组(62例),以高于或等于lncRNA TUSC7、miR-1270表达水平中位数的CRC患者为lncRNA TUSC7高表达组(64例)、miR-1270高表达组(68例)。结果显示,CRC组织lncRNA TUSC7、miR-1270表达水平与年龄、病理类型、性别、肿瘤直径无关(P>0.05),与肿瘤淋巴结转移、浸润深度、分化程度、TNM分期相关(P<0.05)。见表3。
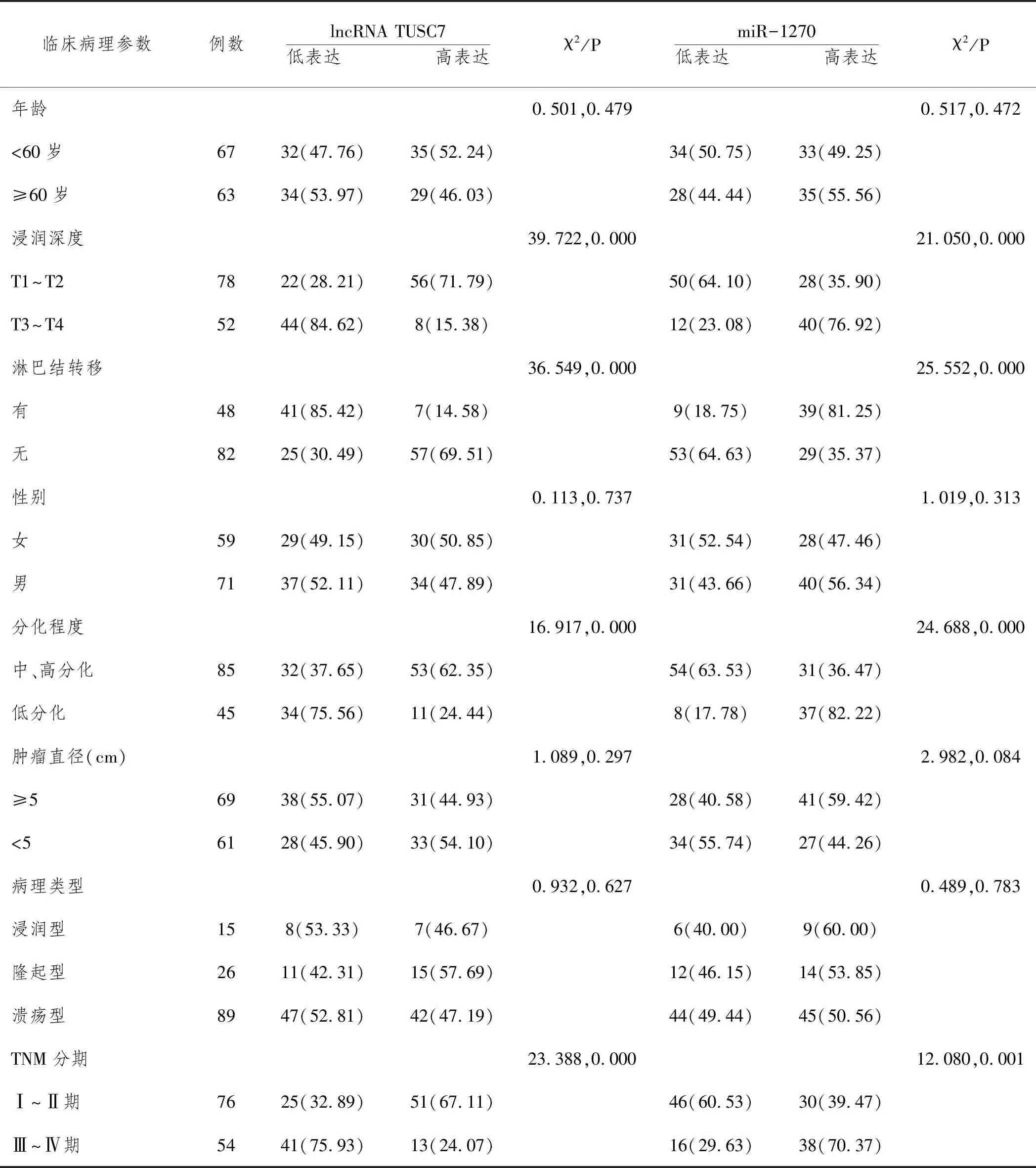
表3 CRC组织lncRNA TUSC7 miR-1270表达水平与临床病理特征关系n(%)
2.4CRC组织中lncRNA TUSC7表达水平与miR-1270的相关性:Pearson法分析显示,CRC组织中lncRNA TUSC7表达水平与miR-1270呈负相关(r=-0.578,P<0.05),见图2;生物信息学分析显示,lncRNA TUSC7与miR-1270存在靶向结合位点,见图3。
2.5CRC组织lncRNA TUSC7、miR-1270表达水平与CRC患者预后的关系:跟踪随访CRC患者6~36个月,死亡45例,生存85例。Kaplan-Meier生存曲线分析显示,lncRNA TUSC7低表达组平均生存时间为27.77个月(95%CI:25.53~30.02),短于lncRNA TUSC7高表达组平均生存时间34.34个月(95%CI:23.10~35.59),log-rank检验结果显示,lncRNA TUSC7低表达组、lncRNA TUSC7高表达组累积生存率比较,差异有统计学意义(χ2=30.459,P=0.000),见图4;miR-1270低表达组平均生存时间为33.90个月(95%CI:32.54~35.27),长于miR-1270高表达组平均生存时间28.37个月(95%CI:26.15~30.58),log-rank检验结果显示,miR-1270低表达组与miR-1270高表达组累积生存率相比,差异有统计学意义(χ2=18.172,P=0.000),见图5。
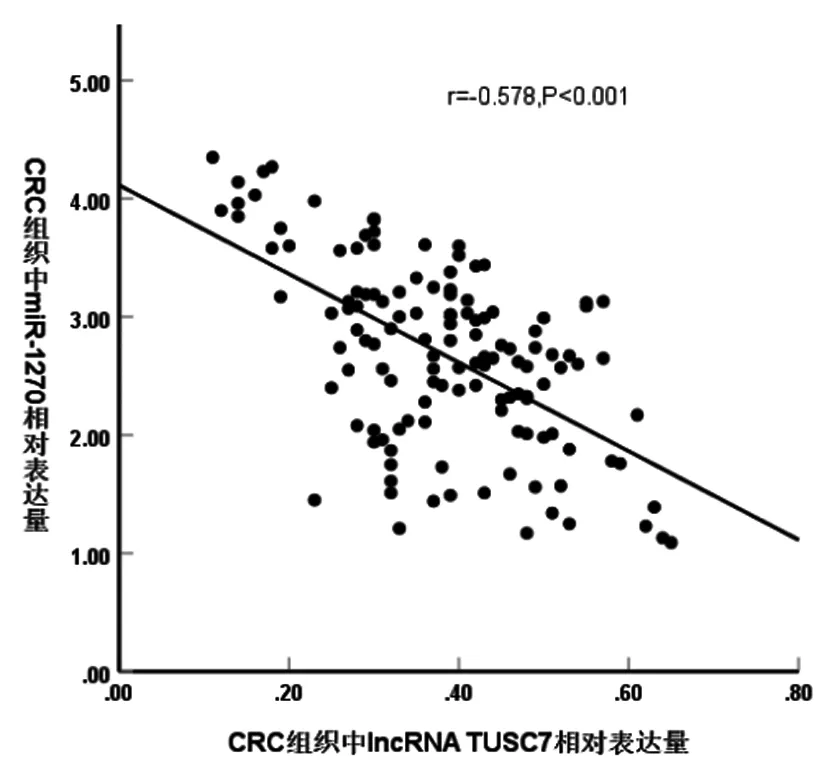
图2 CRC组织中lncRNA TUSC7表达水平与miR-1270的相关性

图3 生物信息学分析lncRNA TUSC7与miR-1270的靶向结合位点
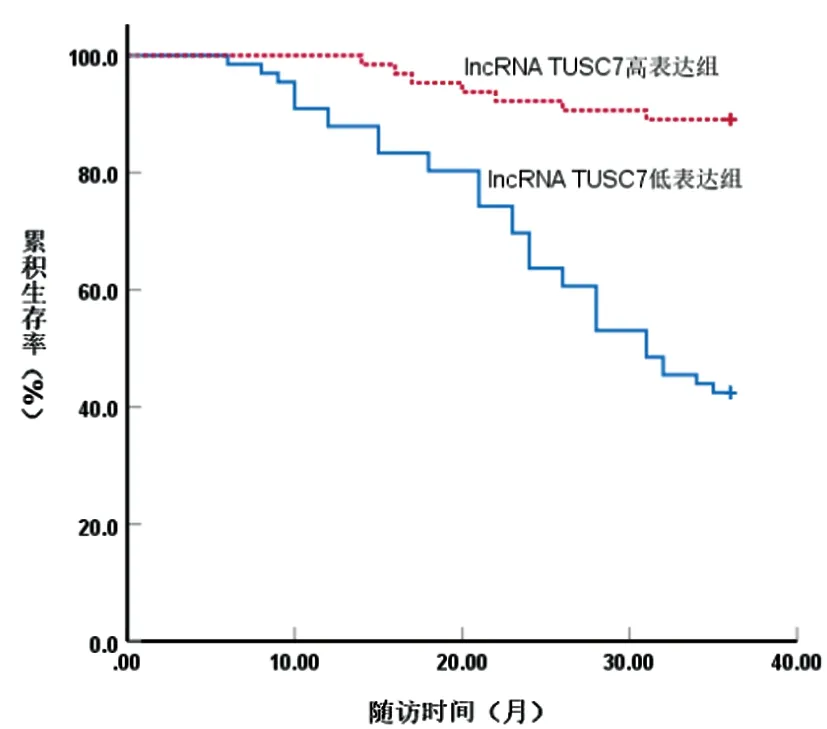
图4 CRC组织lncRNA TUSC7表达水平与CRC患者预后的关系
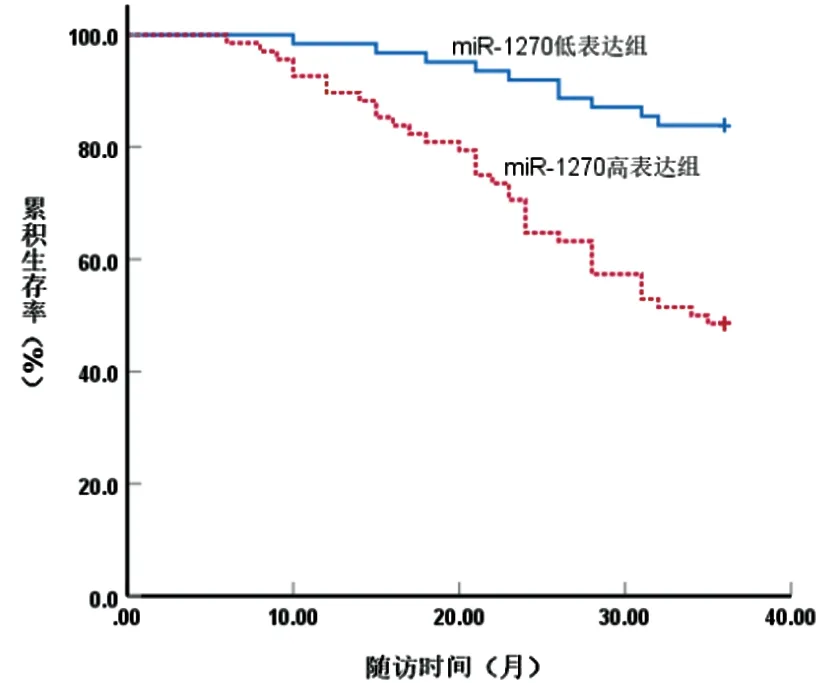
图5 CRC组织miR-1270表达水平与CRC患者预后的关系
3 讨 论
CRC患者可出现便血、大便性状变化、腹痛等症状,临床多以手术治疗CRC为主,但治疗效果不容乐观,CRC患者预后较差[7]。因此,寻找与CRC有关的生物学靶点,对及时有针对性干预,提高CRC患者治愈率,降低病死率有积极意义。
lncRNA作为一类非编码RNA,其虽不可编码蛋白,但可调控信号转导,影响CRC等癌症细胞增殖、凋亡,参与机体免疫逃逸等过程[8]。研究发现,lncRNA TUSC7在食管鳞癌中表达下调,与淋巴结转移相关,lncRNA TUSC7有望成为诊治食管鳞癌的分子靶标[9];另外,Zhang等[10]研究发现,过表达lncRNA TUSC7可抑制CRC细胞增殖、上皮-间质转化(epithelial-mesenchymal transition,EMT),lncRNA TUSC7在CRC发展中起抑癌作用。本研究显示,CRC组织中lncRNA TUSC7表达水平较低,与lnCAR数据库检索结果及曹珊珊等[4]研究趋势一致,提示lncRNA TUSC7可能与CRC病理发展相关。本文中CRC组织lncRNA TUSC7表达水平与肿瘤淋巴结转移、浸润深度、分化程度、TNM分期相关,提示lncRNA TUSC7可能与CRC严重程度有关,检测CRC组织lncRNA TUSC7表达水平有助于临床判断CRC患者病情,对制定针对CRC患者的干预方案甚是有利。进一步研究发现,lncRNA TUSC7低表达组CRC患者平均生存时间、累积生存率短于、低于lncRNA TUSC7高表达组,提示lncRNA TUSC7可能与CRC患者预后密切相关,lncRNA TUSC7表达水平越低,CRC患者预后越差,lncRNA TUSC7可辅助临床判定CRC患者预后情况。分析可能原因,lncRNA TUSC7可能通过与靶基因结合进而影响CRC细胞EMT、增殖、侵袭,从而影响CRC发展进程,显示出其与CRC患者TNM分期等临床特征、预后相关[10]。
miRNA是一类短链非编码RNA,其可参与肝细胞癌、CRC等癌细胞异常增殖,调节信号转导,介导自噬,影响肝细胞癌、CRC等疾病发生发展[11]。近期报道显示,miR-1270在食管癌、肝细胞癌中表达上调,且miR-1270可能是诊治食管癌、肝细胞癌的潜在靶标[12,13]。而miR-1270在甲状腺乳头状癌、膀胱癌中呈高表达,miR-1270在甲状腺乳头状癌、膀胱癌中发挥促癌作用[14,15]。以上研究表明,miR-1270在不同肿瘤中的作用不同。本文中CRC组织miR-1270表达水平较高,与其在胃癌中的趋势相同,提示miR-1270可能参与CRC发生发展,miR-1270可能是诊治CRC的分子靶点。进一步研究显示,处于Ⅲ~Ⅳ期、T3~T4浸润深度、低分化,发生淋巴结转移的CRC患者中miR-1270高表达患者占比较高,表明miR-1270可能与CRC发展程度相关,miR-1270有望成为评估CRC严重程度的标志物。另外,本研究显示,miR-1270低表达组CRC患者平均生存期、累积生存率长于高于miR-1270高表达组,表示CRC组织中miR-1270表达水平越高,CRC患者发生不良预后风险越大,miR-1270有望成为临床评估CRC患者预后的潜在指标。推测,miR-1270可能通过促进CRC细胞增殖、EMT,抑制CRC细胞凋亡,进而在CRC发生发展中起促进作用,从而显示出miR-1270与CRC患者TNM分期等临床特征、预后关系紧密[5]。
此外,生物信息学分析显示,lncRNA TUSC7与miR-1270存在靶向结合位点,故本文探讨了CRC组织中lncRNA TUSC7表达水平与miR-1270相关性,结果显示,lncRNA TUSC7表达水平与miR-1270呈负相关,提示lncRNA TUSC7可能与miR-1270共同影响CRC病理变化,推测lncRNA TUSC7可能与miR-1270靶向结合,进而影响CRC细胞增殖、EMT等恶性生物学行为,从而协同影响CRC发展过程。
综上,CRC组织中lncRNA TUSC7表达水平较低,miR-1270表达水平较高,二者呈负相关,且lncRNA TUSC7、miR-1270均与TNM分期、浸润深度、淋巴结转移、分化程度、预后等显著相关,为临床诊治CRC、判定CRC患者预后提供新方向。但本研究样本有限,后期将延长随访时间,扩大样本,从多角度探究lncRNA TUSC7、miR-1270与CRC的关系,以增加实验可靠性。

