结直肠癌肝转移瘤远癌组织亚细胞结构与表达谱改变
蓝淞耀,龚 晗,韦成江,唐 琪,冯 雁,林 源
(广西医科大学附属肿瘤医院胃肠外科结直肠肛门病区,广西 南宁 530021)
肿瘤是一类以细胞异常增殖为特点的全身性疾病,恶性肿瘤细胞会侵入健康组织,并通过淋巴或循环系统扩散到身体的其他部位,同时肿瘤细胞可以通过释放细胞外旁分泌信号来影响微环境[1]。在目前结直肠癌肝转移的治疗指南中,手术治疗均有不同程度的肝组织保留[2,3]。为手术切缘及远离肿瘤的组织在常规病理检测中检测不到肿瘤细胞,因此被认为是正常组织,但这些细胞是否受到肿瘤组织作用还未有研究进行探讨。通过亚细胞层面或基因表达的改变可能揭示其中的变化。因此本研究通过电镜观察人肝转移灶标本及小鼠肝转移模型中肿瘤、癌旁、远癌组织细胞亚结构改变。结合转录组测序比较小鼠肝转移瘤的癌旁、远癌和健康对照小鼠正常肝组织的基因表达差异,评价在结直肠癌肝转移灶中,肿瘤细胞对远癌肝细胞组织的影响及机制。
1 资料与方法
1.1研究对象
1.1.1样品来源:选择2019年9月至2020年10月,广西医科大学附属肿瘤医院胃肠外科结直肠肛门病区收治的5例结直肠癌合并肝转移患者的肝转移瘤手术标本进行研究。入组患者均满足以下入组标准:①通过纤维肠镜行结直肠肿物活检,活检病理确诊为结直肠癌并通过术中病理确诊合并肝转移;②术前通过血清学、影像学检查排除其他恶性肿瘤、精神疾病、免疫相关疾病;③术前未经过任何抗肿瘤治疗;④术前术后均未使用免疫相关治疗药物;⑤临床资料完整,依从性良好,签署知情同意书。手术后样本按如下标注进行取材,将距离肿瘤≤1cm的组织定义为癌旁组织,距离肿瘤≥2cm的组织定义为远癌组织,手术切缘处为正常组织。取材后样本用无菌PBS清洗,并立刻用样本使用3%戊二醛固定后用于电镜分析。本研究经广西医科大学附属肿瘤医院医学伦理委员会批准。
1.1.2动物模型建立与分组:C57BL/6N小鼠,雌性,6~8周龄(赛业苏州生物科技有限公司)。小鼠护理和处理程序委托赛业(苏州)生物科技有限公司进行,处理程序经广西医科大学附属肿瘤医院动物伦理委员会批准。肝转移模型组小鼠使用脾注射方式接种MC38细胞[4]。正常组小鼠均脾脏注射等剂量PBS。术后继续在SPF条件下饲养,观察并记录小鼠生存状态。术后12~14d后用1.25%三溴乙醇腹腔麻醉,开腹经下腔静脉取血处死,对新鲜肝脏组织进行不同分区的取材。选取距离可见肿瘤边缘小于5mm的组织为癌旁组织,大于5mm部位为远癌组织。同时取正常组小鼠肝脏为正常肝组织对照。将组织分成3份,其中1份用福尔马林溶液浸泡,用于组织病理学分析;1份用3%戊二醛固定,用于透射电镜观察;1份采用液氮冷冻,-80℃低温冰箱保存,用于转录组分析。
1.2电镜样本制备与观察:样本使用3%戊二醛固定。PBS冲洗3次后,1%锇酸固定,乙醇-丙酮逐级脱水,丙酮:包埋剂=1∶1浸透组织过夜,纯包埋剂包埋,树脂固定。切片后行铅铀染色,在广西医科大学电镜中心观察,电镜型号为日本HITACHI公司H-7650型透射电镜。
1.3苏木素-伊红染色(HE染色)烤片、在二甲苯中脱蜡、依次在100%、95%、85%、75%浓度梯度的酒精中水化,浸入蒸馏水中1min。苏木素染色30s~1min,TBST返蓝;伊红染色,根据切片的着色情况滴加蒸馏水冲洗,终止染色。中性树脂封片。
1.4转录组测序:取组织50mg,液氮冷冻研磨,溶解蛋白,提取RNA。使用Agilent 2100 bioanalyzer检测RNA完整性和总量。建库起始RNA为total RNA,总量≥1μg。采用AMPure XP beads进行建库。测序采用Illumina NovaSeq 6000进行。以参考基因组(Database version 104.39)和基因模型进行注释。使用HISAT2 v2.0.5 构建参考基因组的索引,并使用HISAT2 v2.0.5 将配对末端clean reads与参照基因组比对。
1.5生信分析:使用DESeq2软件包(1.20.0)进行组间差异表达基因分析,每组2个样本重复。使用Benjamini&Hochberg方法校正P值。以|FC|>2且校正adj值<0.05作为显著差异表达的阈值。使用clusterProfiler(v3.4.4)软件分析差异表达基因的KEGG通路富集。
2 结 果
2.1肝转移癌患者的肝内远癌组织细胞亚结构改变:正常肝细胞在电镜下细胞核呈圆形,胞质丰富,有成堆糖原及众多的粗面内质网[5]。在本研究结果中,5例结直肠癌肝转移灶的肝内远癌组织大部分细胞均出现核涣散的现象,少部分形态较圆。部分细胞异染色质呈斑点状散在核浆(图1a1)。肿瘤组织的细胞核仁不明显,核溶解增多,核质边际浓缩,核周隙变大。部分细胞核膜破裂,核呈碎裂形态,呈现更不稳定状态(图1b1)。远癌肝细胞中大量线粒体出现形态改变。线粒体形态不均一,部分线粒体膨大肿胀,甚至呈空泡状,线粒体嵴变短变少甚至消失(图1a2)。与正常细胞相比,远癌肝细胞内大量内质网发达、肿胀,并可见大量核糖体分布在肿胀的内质网之上(图1a3)。肿瘤组织的线粒体形态不规则,数目不恒定,多数线粒体嵴减少或者消失呈空泡状。细胞内少见内质网(图1b2、3)。综上所述,远癌组织亚细胞结构中均出现显著改变,但与癌细胞相比,结构异常程度不同。
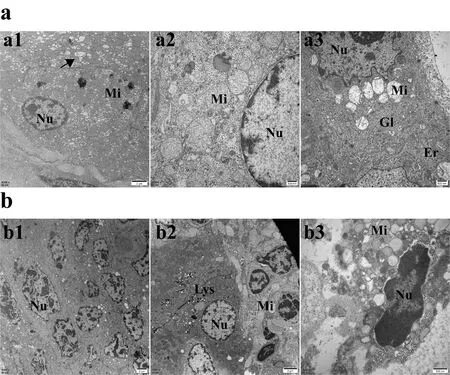
图1 人肝转移病灶电镜结果
2.2小鼠肝脏远癌组织出现与正常肝组织不同的改变:本研究采用小鼠结直肠癌肝转移模型进一步验证远癌组织中的变化。对比健康对照组小鼠,建模组小鼠的肝脏出现大量的转移病灶,直径1-2mm为主(图2a)。HE染色显示,健康对照组小鼠肝脏与模型组小鼠癌旁>1mm的细胞病理形态无明显差异(图2b)。电镜分析显示正常小鼠肝脏细胞亚细胞结构相对完整,细胞膜形态正常。细胞核圆。细胞内可见大量线粒体形态完整,内质网发达。细胞内容丰富,视野内可见大量含脂滴或蛋白质空泡样结构(图2c)。小鼠远癌组织中肝细胞形态结构相对完整,出现呈异型性的核,异染色质向核膜边缘聚集,边缘呈锯齿状。部分视野中细胞溶解状态明显,可见核溶解、核固缩等凋亡状态(图2d1)。线粒体出现空泡化,内质网相对对照组更为肿胀(图2d2)。肿瘤组织视野下细胞与细胞之间边界不清。大部分细胞核仁不明显,核异型性数量较多。有些细胞核膜破裂,异染色质凝聚在核膜下,核呈碎裂形态(图2e1),线粒体出现空泡化,数量增多;肿瘤组织中部分线粒体脱髓鞘,内质网糅合(图2e2)。小鼠肝转移模型远癌组织的肝组织细胞亚结构变化与人结直肠癌肝转移癌远癌组织具有一定程度的相似。
2.3远癌组织中表达谱发生改变:为探索远癌组织中基因表达的改变,将小鼠模型肝脏中的远癌组织、癌旁组织及癌组织、对照组正常肝组织进行了转录组分分析,以|FC|>2且校正adj值<0.05为标准,分别得到癌组织与正常组织组上调基因922个、下调基因546个、癌旁组织与正常组织组上调基因336个、下调基因199个、远癌组织与正常组织组上调基因2891个、下调基因826个(图3a)。对以上各组的上、下调基因进行KEGG通路富集。癌组织与正常组织比较组、癌旁组织与正常组织比较组中上调基因有阿米巴迁移、PI3K-Akt信号通路等共同富集通路(图3b1、2)。远癌组织与正常组织组相比上调基因在细胞凋亡、TNF信号通路、MAPK信号通路、PI3K-Akt信号通路等通路上富集(图3c1)。其中下调基因主要为:DNA加合物的化学致癌作用、甾类激素生物合成、视黄醇代谢等(图3c2)。
2.4远癌、癌旁与癌组织中共同上调的信号通路:将癌组织与正常组织组、癌旁组织与正常组织组、远癌组织与正常组织组的上调基因取交集(图4a),将共同的上调基因进行KEGG通路富集,发现基因在化学致癌作用、ECM受体相互作用等通路上富集(图4b、表1)。从共同上调的基因中选取连接度最大的基因进行互作网络分析(图4c),可以观察到连接度较大的基因分布在Col家族(如Col胶原蛋白Col2A)、Bub家族、Kif家族、Jun基因等。

表1 共同富集基因KEGG通路及基因列表
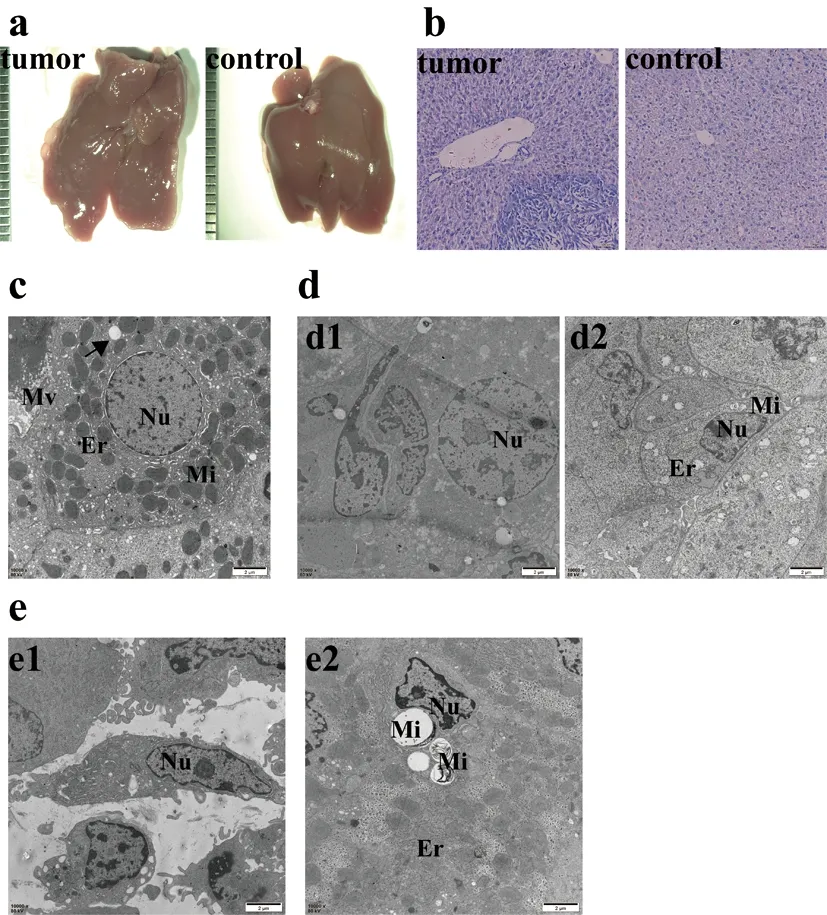
图2 小鼠转移瘤模型
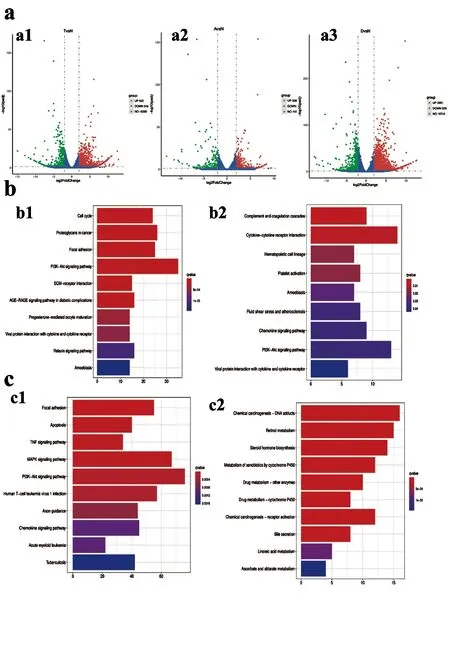
图3 转录组测序结果
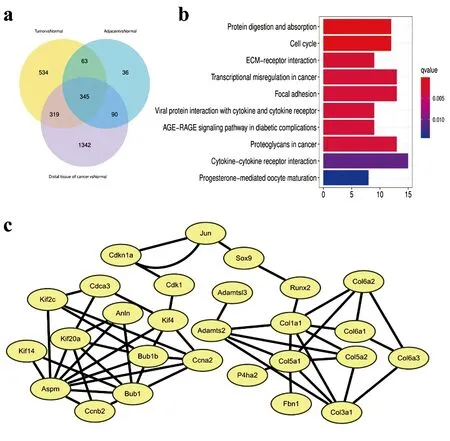
图4 远癌组织、癌旁与癌组织中共同上调的信号通路
3 讨 论
肿瘤可以包括细胞外旁分泌信号等多种不同形式作用与肿瘤微环境中的不同细胞[1]。过往研究集中在癌对癌旁组织的作用,而对于远癌组织中的影响研究很少。本研究通过对结直肠肝转移癌患者及小鼠肝转移动物模型的远癌组织进行细胞亚结构分析发现肝转移癌的远癌组织病理组织形态正常的细胞内,同样出现亚细胞结构的改变。而通过表达谱分析,发现远癌细胞出现部分与癌细胞相同的细胞通路上调。
在远癌肝组织中,呈现出与正常肝组织不一样的改变,这些改变中的一部分与肿瘤细胞的改变一致,这很有可能是恶性肿瘤在浸润转移过程中对正常机体的影响和对邻近细胞的活性诱导所致。对于肿瘤细胞的研究认为,肿瘤细胞非典型的核形态,与基因组完整性和细胞核亚结构及其功能的变化有关。远癌组织中的细胞核异型性明显,呈正常细胞核形态的较少。而异型细胞核的增多恰是远癌组织被肿瘤影响的证据之一。在许多相关研究中均发现,肿瘤细胞基因组和核亚结构及其功能的变化进而导致其表现出非典型的核形态[6]。肿瘤细胞的核仁增大,染色质亦可呈不同的形态[7]。其次,通过本研究的电镜观察可以看到远癌组织中表现出与肿瘤组织类似的线粒体数量增多的现象。线粒体可以控制活性氧、癌蛋白和肿瘤代谢物的产生和释放,调节钙离子稳态、自噬和执行细胞死亡,并通过癌细胞内部和癌细胞外部机制影响机体新陈代谢[8]。此外,肿瘤细胞在内部压力(如致癌基因的激活)和外部不利环境信号(如缺氧和营养缺乏)的刺激下,能使内质网处于应激状态[9]。肿瘤细胞通过增加蛋白质的合成以满足肿瘤发生过程中代谢增加的需求。为此增殖的癌细胞需要内质网的快速扩张以分裂并合成足够的蛋白质分配给子细胞[10]。这些相关报道和本研究中观察到远癌组织中内质网改变的现象相一致。Azizidoost S等通过回顾分析认为,当癌细胞渗入肝脏后会改变肝正常生态位细胞,肝生态位中的正常肝细胞会受到异常肝再生和炎症和纤维化等病理生理因素的影响,进而获得肿瘤易感性[11]。在本研究中观察到以上远癌组织的细胞形态改变,推测为恶性肿瘤在局部浸润过程中的活性诱导所致。肿瘤细胞的诱导改变了远癌组织细胞的亚结构,为新肿瘤形成或原肿瘤在器官内的微转移转移提供遗传物质、能量和蛋白质等先决条件。
肿瘤在局部浸润和蔓延的过程中大致分为四个步骤:肿瘤细胞间的表面黏着分子减少、与基底膜的黏着增加、正常细胞的细胞外基质降解和肿瘤细胞借助阿米巴样运动移动完成局部浸润蔓延等生物活动。本研究通过转录组测序发现上调基因在黏着斑、ECM受体相互作用等通路富集,这一结果提示了远癌组织中出现了细胞外基质结果的重塑。同时,在基因互作网络中,连接度较高的基因大多参与肿瘤增殖与转移的调控,如Adamts、Bub1、Col4a1/2、Col5a1、Col6a1等基因在不同的肿瘤研究中被证实分别参与不同的肿瘤相关信号通路轴的调节,促进肿瘤转移并增加了罹患肿瘤的易感性。于此同时,肿瘤细胞在浸润转移的过程中会产生胶原酶以溶解细胞外基质的胶原成分使基底膜形成缺损有利于肿瘤细胞的通过。在本研究中Col3a1基因在远癌组织中表达上调。Col3a1可参与编码Ⅲ型胶原蛋白,该蛋白的过表达能导致粗面内质网扩张,胶原纤维直径改变。体现了肿瘤作为一类影响全身的疾病,其对机体的影响远不止于肿瘤区域,邻近组织也常常受到波及[12]。通过本研究结果可以推测肿瘤组织调控远癌组织出现了适应性的改变,为肿瘤细胞向周围的浸润提供了更好的条件。
本研究发现结直肠癌肝转移瘤的远癌组织尽管仍然维持正常的细胞组织形态,但亚细胞结构出现及细胞表达谱均与正常细胞存在显著差异。这一现象对于肝转移的形成、复发及患者预后的影响还有待更多研究进行证实。

