少腹逐瘀汤改善高胰岛素血症小鼠子宫内膜容受性的机制研究
谌泽芳,李泽潞,李涵宇,李艳军,余曦明,张 伟,贺 冰*
(1.湖南中医药大学,湖南 长沙410208;2.湖南中医药大学第二附属医院,湖南 长沙410005)
近年来,子宫内膜容受性的改善日益成为生殖领域的热点。有报道称,在体外受精中胚胎因素占植入失败原因的1/3,而子宫内膜容受性因素作用占2/3[1]。 子宫内膜容受性是指子宫内膜容许胚胎进行定位、黏附、侵入内膜的能力[2]。 良好的子宫内膜容受性是成功妊娠的重要条件[3]。 研究表明,高胰岛素血症会使得体内葡萄糖转运减少,细胞葡萄糖利用异常,最终导致子宫内膜容受性下降[4]。 同时体内糖代谢异常,血糖长期过高也会引起血液流变学改变,更容易发生瘀滞[5]。 不孕症患者一般病程较长,中医学有“久病入络”“久病则瘀”之说,而活血祛瘀法在提高子宫内膜容受性上具有一定的理论和实践基础,其代表方之一就是少腹逐瘀汤,临床治疗不孕症疗效良好[6],但其作用于子宫内膜容受性的机制有待进一步探索。本研究在中医活血化瘀理论指导下,探讨少腹逐瘀汤是否通过调节糖代谢,影响子宫内膜整合素αvβ3 mRNA 和环氧合酶2(cyclooxygenase-2,COX-2)、白血病抑制因子(leuke-mia inhibitory, LIF)、溶血磷脂酸受体3(lysophosphatidic acid receptor 3,LPAR3)蛋白的表达,从而改善高胰岛素血症小鼠子宫内膜容受性的作用。
1 材料
1.1 实验动物
SPF 级6 周龄雌性昆明小鼠70 只,体质量(22.5±2.5) g,由湖南中医药大学实验动物中心提供(实验动物质量合格证号:110727201100782834);SPF 级8 周龄雄性昆明小鼠35 只,体质量(30±5) g,由湖南中医药大学实验动物中心提供(实验动物质量合格证号:1107272011004221)。 实验动物许可证号:SCXK(湘)2020-0005。 动物均饲养在湖南中医药大学实验动物中心,昼夜交替各12 h,温度21~26 ℃,湿度40%~50%。本实验研究通过湖南中医药大学动物伦理委员会审核(审批号:2020061701)。
1.2 主要药物与试剂
少腹逐瘀汤(炒小茴香1.5 g,炒干姜3 g,延胡索3 g,没药6 g,当归9 g,川芎9 g,肉桂3 g,赤芍6 g,生蒲黄9 g,炒五灵脂6 g),所有中药饮片均购自湖南中医药大学第二附属医院,制成浓度0.8 g/mL的提取液。 阿司匹林肠溶片(规格为50 mg/片,北京舒泰神生物制药股份有限公司,批号:180902);戊酸雌二醇片(规格为1 mg/片,拜耳医药保健有限公司广州分公司,批号:130208);甘精胰岛素注射液(规格为3 mL∶300 IU,北京赛诺菲制药有限公司,批号:S2014004)。LIF 抗体(批号:46u3290)、COX-2 抗体(批号:86f4760)均购自美国Affinity biosciences公司;LPAR3 抗体(批号:AF12237836)购自北京博奥森生物技术有限公司;HRP-羊抗兔二抗(批号:SA00001-1)购自美国Proteintech 公司;小鼠胰岛素酶联免疫吸附法试剂盒(武汉伊莱瑞特生物科技股份有限公司,批号:3CMESFA5UL)。
1.3 主要仪器
血糖检测仪(江苏鱼跃医疗设备股份有限公司,型号:590);组织切片机、荧光定量PCR 仪均购自美国Thermo Fisher Scientific 公司(型号分别为HM325、PIKOREAL96);显微镜(厦门麦克奥迪电气股份有限公司,型号:BA410E);台式冷冻离心机(湖南湘仪科技有限公司,型号:H1650R);摇床(江苏其林贝尔仪器制造有限公司,型号:TS-1);电泳仪、水平琼脂糖电泳槽均购自北京六一生物科技有限公司(型号分别为DYY-2C、DYCP-31DN);扫描电镜(日本日立公司,型号:S-3400N)。
2 方法
2.1 分组、造模及给药方法
雌性小鼠适应性喂养2 周,同时记录其动情周期。参照文献[7],建立高胰岛素不孕小鼠模型。将健康未孕的雌性小鼠随机分为正常组和高胰岛素组。每天早上8:00 开始注射, 正常组注射生理盐水,高胰岛素组注射重组人胰岛素,使用长时间梯度剂量皮下注射法:一开始持续皮下注射0.5 μL,从第17天起逐渐加大剂量,至第23 天时,注射量为8.0 μL,妊娠后每天持续皮下注射2.0 μL。 造模结束后,于晚上8:00 左右,所有小鼠按照1 只正常性成熟雄鼠和2 只动情周期正常的雌鼠分组合笼进行交配,次日早7:00 查看合笼雌鼠阴道栓。若雌鼠阴道内发现乳白色的阴道栓则记为交配日后第1 天。 将妊娠的高胰岛素组小鼠随机分为模型组、阿司匹林组(7.500 mg/kg)、戊酸雌二醇组(0.104 mg/kg)、少腹逐瘀汤正常剂量组(7.500 g/kg,相当于临床等效剂量)、少腹逐瘀汤高剂量组(15.000 g/kg,相当于临床2 倍剂量),每组10只。 阿司匹林与戊酸雌二醇在灌胃前,均用PBS溶成混悬液,正常组和模型组小鼠每天灌胃与自身体积相对应的蒸馏水,药物组灌胃相应的药物。
2.2 指标观察与检测
2.2.1 监测血糖 小鼠造模结束后及交配日后第5天、第10 天,收集尾静脉取血血液,采用血糖仪监测血糖。
2.2.2 ELISA 法测定血清胰岛素水平 各组小鼠分别在交配日后第5 天、第10 天进行眼球取血,静置2 h,3000 r/min,离心半径8 cm 持续离心10 min,吸出上层清亮液体,具体操作按ELISA 试剂盒进行。 采用稳态模型法计算胰岛素抵抗指数(homeostasis model assessment of insulin resistance, HOMA-IR),HOMA-IR=血糖×血清胰岛素/22.5[4]。
2.2.3 HE 染色观察子宫内膜厚度及结构 各组小鼠分别在交配日后第5 天、第10 天取子宫,放入4%多聚甲醛中固定,石蜡包埋,切片,苏木素伊红染色,在显微镜下观察子宫内膜厚度及结构,拍照并记录。
2.2.4 免疫组化法检测子宫内膜COX-2、LIF、LPAR3蛋白表达 各组小鼠分别在交配日后第5 天、第10天取子宫组织,进行石蜡切片脱蜡,抗原修复,阻断内源性过氧化物酶,血清封闭,加一抗和二抗,DAB显色,阳性为棕黄色,苏木素复染细胞核,脱水封片。拍照,计算机图像处理软件半定量测定各组COX-2、LIF、LPAR3 蛋白的含量,采用平均积分光密度值表示各指标的表达量,进行测量处理并记录。
2.2.5 扫描电镜观察子宫内膜胞饮突 各组小鼠分别在交配日后第5 天、第10 天取子宫组织,用眼科剪剪开刚取出的子宫,将其裁剪为5 mm×8 mm,立即夹起组织放入PBS 中超声震荡清洗3 次,每次10 min。接着,按序固定于2.5%戊二醛、锇酸溶液中,时间分别为24 h 和2 h。在双蒸水中荡涤3 次,每次10 min。按序在50%、70%、90%、100%的丙酮溶液中脱水,每次10 min。 再于50%、70%、90%、100%的醋酸异戊酯溶液中进行置换,每次10 min。 最后采用临界点干燥法干燥,真空喷镀金膜,获取样本图像。
2.2.6 实时荧光定量PCR 法检测整合素αvβ3 mRNA 表达 各组小鼠分别在交配日后第5 天、第10天取子宫组织,TRIzol 法提取组织总RNA,采取紫外分光光度计对RNA 浓度进行检测。以组织总mRNA为模板,进行逆转录互补DNA,逆转录反应及实时荧光定量PCR 检测步骤按照说明书进行。采取2-△△Ct法对mRNA 相对表达量进行分析计算。 引物均由上海生工生物工程股份有限公司合成,引物序列信息见表1。
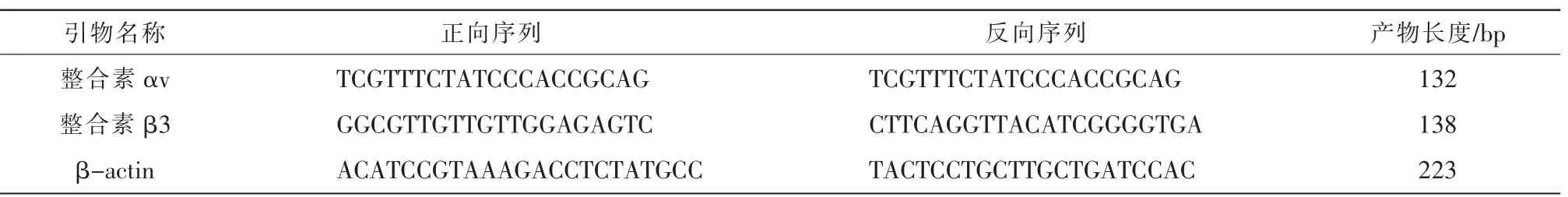
表1 各基因引物信息表
2.2.7 显微镜观察胚胎着床位点数 雌鼠阴道口发现阴栓记为交配日后第1 天,交配日后第10 天将各组小鼠断头处死并取出子宫[8]。 将取出的子宫去除周围软组织后,用生理盐水多次冲洗,置于冰上观察并记录胚胎着床位点数。
2.3 统计学方法
使用SPSS 26.0 统计软件对所有数据进行计算和处理。 计量资料以“±s”表示,符合正态分布及方差齐性,多组间比较选取单因素方差分析,两两比较采用SNK/LSD 检验,方差不齐时用Kruskal-Wallis H检验。 以P<0.05 为差异有统计学意义。
3 结果
3.1 各组小鼠糖代谢水平比较
造模后,与正常组比较,高胰岛素组小鼠血糖、血清胰岛素水平和HOMA-IR 均明显高于正常组(P<0.05)。 详见表2。
表2 高胰岛素对小鼠糖代谢的影响(±s,n=10)

表2 高胰岛素对小鼠糖代谢的影响(±s,n=10)
注:与正常组比较,*P<0.05。
组别正常组高胰岛素组血糖/(mmol·L-1)7.87±0.21 11.23±0.85*血清胰岛素/(mU·L-1)13.25±1.91 24.17±0.88*HOMA-IR 4.43±0.56 12.05±0.47*
交配日后第5 天,阿司匹林组、戊酸雌二醇组、少腹逐瘀汤正常剂量组、少腹逐瘀汤高剂量组血糖、血清胰岛素水平均明显低于模型组(P<0.05,P<0.01),少腹逐瘀汤正常剂量组、少腹逐瘀汤高剂量组血清胰岛素水平均明显低于阿司匹林组(P<0.01),少腹逐瘀汤高剂量组血清胰岛素水平明显低于戊酸雌二醇组(P<0.05)。 交配日后第10 天,少腹逐瘀汤正常剂量组、少腹逐瘀汤高剂量组血糖均明显低于模型组(P<0.05),阿司匹林组、戊酸雌二醇组、少腹逐瘀汤正常剂量组、少腹逐瘀汤高剂量组血清胰岛素水平均明显低于模型组(P<0.05,P<0.01),少腹逐瘀汤正常剂量组、少腹逐瘀汤高剂量组血清胰岛素水平均明显低于阿司匹林组(P<0.05)。 交配日后第5 天和第10 天,少腹逐瘀汤高剂量组血糖、血清胰岛素水平均低于少腹逐瘀汤正常剂量组,但差异无统计学意义(P>0.05)。 详见图1-2。
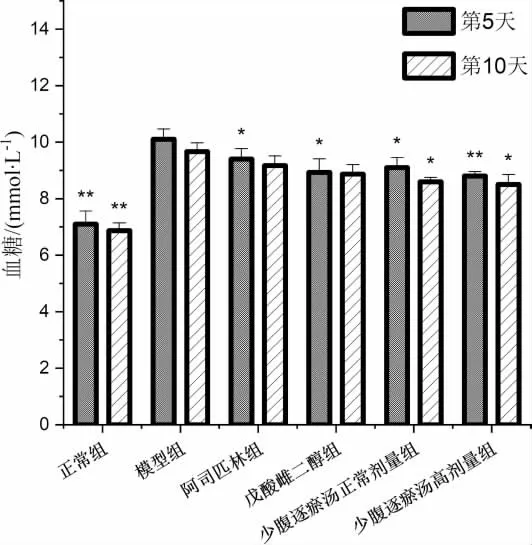
图1 交配日后第5 天、第10 天各组小鼠血糖水平
3.2 各组小鼠平均胚胎着床位点数比较
模型组小鼠胚胎着床位点数明显低于正常组(P<0.05)。 阿司匹林组、戊酸雌二醇组、少腹逐瘀汤正常剂量组、少腹逐瘀汤高剂量组胚胎着床位点数均明显高于模型组(P<0.05)。 各药物组间胚胎着床位点数比较,差异均无统计学意义(P>0.05)。少腹逐瘀汤正常剂量组胚胎着床位点数略高于少腹逐瘀汤高剂量组,但差异无统计学意义(P>0.05)。 详见表3。
表3 各组小鼠平均胚胎着床位点数比较(±s,n=5)
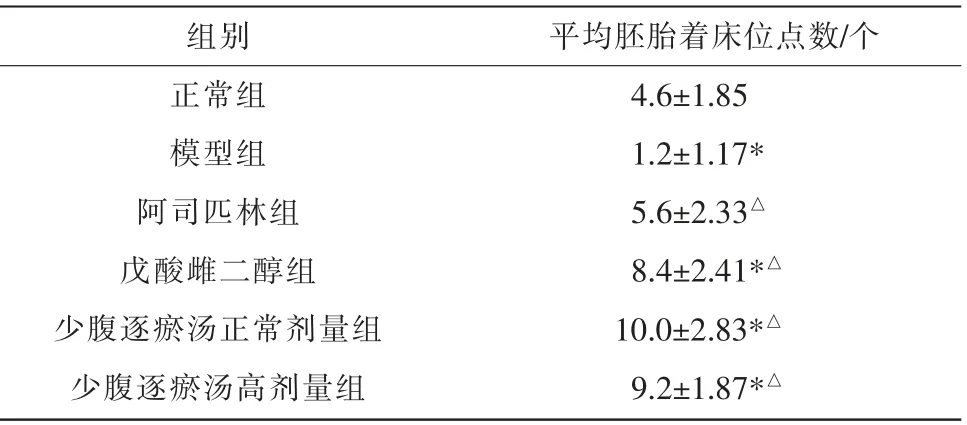
表3 各组小鼠平均胚胎着床位点数比较(±s,n=5)
注:与正常组比较,*P<0.05;与模型组比较,△P<0.05。
组别正常组模型组阿司匹林组戊酸雌二醇组少腹逐瘀汤正常剂量组少腹逐瘀汤高剂量组平均胚胎着床位点数/个4.6±1.85 1.2±1.17*5.6±2.33△8.4±2.41*△10.0±2.83*△9.2±1.87*△
3.3 各组小鼠子宫内膜胞饮突表达比较
正常组胞饮突个大圆润,内膜表面绒毛细密;与正常组比较,模型组的胞饮突小且皱缩,绒毛稀少;各药物组的胞饮突较多,表面光滑饱满,表达成熟,大小均一,且均优于模型组。 详见图3。

图3 各组小鼠子宫内膜胞饮突表达(扫描电镜,×5000,bar=10 μm)
3.4 各组小鼠子宫内膜厚度及形态比较
交配日后第5 天,正常组小鼠子宫内膜厚度增加,腺体数量增多,血管较多;模型组的子宫内膜生长迟缓,子宫内膜间质变得更加致密,腺体减少,血管数量少;阿司匹林组、戊酸雌二醇组子宫内膜厚度较模型组增加,腺体及血管数量均增多。少腹逐瘀汤正常剂量组、少腹逐瘀汤高剂量组子宫内膜形态近似于正常组,子宫内膜腺体、血管均较模型组丰富。与交配日后第5 天相比,第10 天模型组的子宫内膜变化更为明显,内膜间质更加稀疏,腺体更多;阿司匹林组、戊酸雌二醇组及少腹逐瘀汤正常剂量组、少腹逐瘀汤高剂量组子宫内膜、子宫腺体、子宫血管也较前明显改变。 详见图4。

图2 交配日后第5 天、第10 天各组小鼠血清胰岛素水平

图4 各组小鼠子宫内膜厚度及形态(HE,×100,bar=100 μm)
交配日后第5 天和第10 天,模型组子宫内膜厚度均薄于正常组(P<0.01),阿司匹林组、戊酸雌二醇组及少腹逐瘀汤正常剂量组、少腹逐瘀汤高剂量组子宫内膜均厚于模型组(P<0.05,P<0.01)。详见图5。

图5 各组小鼠子宫内膜厚度
3.5 各组小鼠子宫内膜COX-2、LIF、LPAR3 蛋白表达水平比较
交配日后第5 天和第10 天,模型组子宫内膜COX-2、LIF、LPAR3 蛋白表达水平均明显低于正常组(P<0.01),阿司匹林组、戊酸雌二醇组、少腹逐瘀汤正常剂量组、少腹逐瘀汤高剂量组子宫内膜COX-2、LIF、LPAR3 蛋白表达水平均明显高于模型组(P<0.05)。交配日后第10 天,少腹逐瘀汤高剂量组COX-2蛋白表达水平均明显高于阿司匹林组、戊酸雌二醇组、少腹逐瘀汤正常剂量组(P<0.05,P<0.01),少腹逐瘀汤高剂量组LPAR3 蛋白表达水平明显高于戊酸雌二醇组(P<0.05)。 详见图6-7。
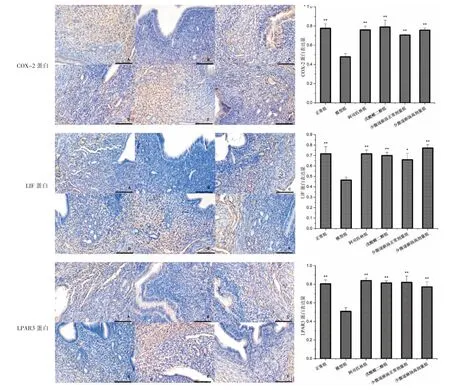
图6 第5 天各组小鼠子宫内膜COX-2、LIF、LPAR3 蛋白表达情况(免疫组化,×200,bar=100 μm)
3.6 各组小鼠子宫内膜整合素αvβ3 mRNA 表达水平比较
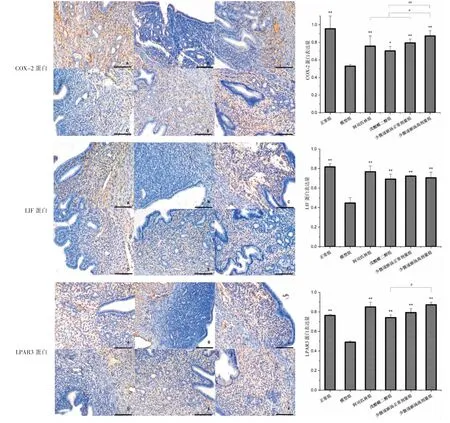
图7 第10 天各组小鼠子宫内膜COX-2、LIF、LPAR3 蛋白表达情况(免疫组化,×200,bar=100 μm)
交配日后第5 天和第10 天,模型组整合素αv、整合素β3 mRNA 表达水平均明显低于正常组(P<0.01)。 交配日后第5 天,阿司匹林组和少腹逐瘀汤高剂量组整合素αv、整合素β3 mRNA 表达水平均明显高于模型组(P<0.01);戊酸雌二醇组、少腹逐瘀汤正常剂量组整合素αv mRNA 表达水平均明显低于阿司匹林组(P<0.01);戊酸雌二醇组、少腹逐瘀汤正常剂量组、少腹逐瘀汤高剂量组整合素β3 mRNA表达水平均明显低于阿司匹林组(P<0.01)。 交配日后第10 天,阿司匹林组整合素αv mRNA 表达水平明显高于模型组(P<0.01);戊酸雌二醇组整合素αv mRNA 表达水平明显低于阿司匹林组(P<0.01)。 详见图8-9。

图8 第5 天各组小鼠子宫内膜整合素αvβ3 mRNA 表达情况
4 讨论
近年来,不孕症的患者日益增多,全球约有8000万对夫妇患病,发展中国家的患病率高达30%[9]。 子宫内膜容受性可以表示子宫内膜在一个特殊时期的状态,这是胚胎是否移植成功的重要前提[10-11]。 研究表明,大多数患有高胰岛素血症的女性,子宫内膜容受性发生改变,更容易不孕或流产[12]。中医学认为肾主生殖,肾气充盛、阴阳气血调和方能有孕,子宫内膜为胚胎生长发育提供基本条件,血液充养是维持其生理功能的物质基础。 若血液运行不畅而致血瘀,则会阻滞胞脉,胚胎失于濡养,无法正常种植于子宫[13]。少腹逐瘀汤被誉为“种子第一方”,君药为五灵脂、蒲黄,具有活血化瘀的作用;臣药为延胡索、川芎、当归、没药、赤芍,具有养血活血的作用;干姜、肉桂为佐药,具有温经散寒之功效;全方以活血化瘀、温阳散寒、舒经通络为治法,在不孕不育患者中取得良好疗效[14]。

图9 第10 天各组小鼠子宫内膜整合素αvβ3 mRNA 表达情况
胰岛素水平过高不仅会导致子宫内膜容受性下降,而且影响早期胚胎发育,增加流产风险[15]。 本实验采取长效胰岛素持续梯度注射法建立小鼠高胰岛素血症模型。 结果表明,高胰岛素组平均血清胰岛素及血糖高于正常组(P<0.05)。高胰岛素组HOMAIR 大于正常组(P<0.05),模型成功建立。 相比交配日后第5 天,第10 天血糖及血清胰岛素均下降;与模型组比,少腹逐瘀汤组血糖及血清胰岛素均明显降低(P<0.05),且少腹逐瘀汤高剂量组稍优于正常剂量组,这提示少腹逐瘀汤可以通过调控糖脂代谢改善内环境,增加子宫内膜容受性,从而提高妊娠率,同时长时间、高剂量疗效更佳。
子宫内膜容受性的标志性因子包括胞饮突、整合素、LIF、COX-2、LPAR3 等。 大量研究认为,成熟的胞饮突是子宫内膜容受性的特异性标志物[16]。 本实验发现,高胰岛素血症会导致小鼠子宫内膜增生异常、内膜绒毛退化、胞饮突小且表面皱缩;少腹逐瘀汤能改善这种损伤,使得子宫内膜接近未受损状态,促进胞饮突成熟表面光滑。 LIF 表达与胚胎着床时间基本一样,是判断子宫内膜能否容纳囊胚的重要指标[17]。 COX-2 可以很好反映子宫内膜容受性,对于胚胎植入和早期妊娠维持至关重要[18]。 LPAR3 促进子宫内膜蜕膜化和血管化, 改善子宫内膜容受性,最终建立适于胚胎种植的子宫内膜环境[19]。研究表明,整合素αvβ3 mRNA 能够作为判断子宫内膜容受性高低的根据[20]。 本研究发现,交配日后第5天、第10 天,与正常组比,模型组COX-2、LIF、LPAR3、整合素αvβ3 mRNA 的表达均明显下降(P<0.05),表明高胰岛素血症会使得子宫内膜厚度减少,腺体数量下降,并降低子宫内膜COX-2、LIF、LPAR3、整合素αvβ3 mRNA 的表达量,使得内膜容受性低下,从而受孕率降低。牛雯颖等[21]研究表明少腹逐瘀汤具有降脂、降低血液黏度作用。 在本次研究中,交配日后第5 天、第10 天,与模型组比,少腹逐瘀汤正常、高剂量组小鼠子宫内膜COX-2、LIF、LPAR3 蛋白表达水平均明显增高(P<0.05)。交配日后第5 天,与模型组比,少腹逐瘀汤高剂量组整合素αvβ3 表达水平明显增高(P<0.05)。 这提示少腹逐瘀汤可能通过调控整合素αvβ3 进而提高COX-2、LIF、LPAR3 表达,改善子宫内膜容受性,促进胚胎着床。
综上所述,少腹逐瘀汤能够提高高胰岛素血症小鼠 子 宫 内 膜COX-2、LIF、LPAR3 及 整 合 素αvβ3 mRNA 表达,表明少腹逐瘀汤可能通过调节糖代谢水平,影响子宫内膜整合素αvβ3 mRNA 的表达,调控COX-2、LIF、LPAR3 释放,来改善子宫内膜容受性受损的情况,从而使临床妊娠率不断上升。

