固肠止泻丸对溃疡性结肠炎小鼠的治疗作用研究
吴冬芝,吴柯楠,程 雯,李雯瑞,王 婷,梁艳妮*,王 征*
(陕西中医药大学 陕西中药资源产业化省部共建协同创新中心,秦药特色资源研究开发国家重点实验室(培育),陕西 咸阳 712083)
溃疡性结肠炎(ulcerative colitis, UC)是消化系统常见疾病,病情反复发作、病因迄今不明[1]。 其病理特征常始自左半结肠,后蔓延至整个结肠,同时引发消化道梗阻、穿孔、中毒性结肠扩张、直乙状结肠癌变等并发症,临床表现多为溃疡、出血和电解质代谢紊乱等[2]。 调查显示,我国UC 发病率约为11.6/10万[3]。 同时,作为治疗周期长,对患者造成身心双重折磨的全球性疾病,UC 受到了广泛关注。
固肠止泻丸(Guchang Zhixie Wan, GC)属于国家中药保护品种,方中乌梅味涩,为君药;罂粟壳酸涩,既可助君药涩肠,又兼止痛;黄连与干姜共奏寒热并用之法,三药相伍,温散并行;延胡索、木香辛温,活血消痛。诸药共奏寒热并用、标本兼治、调和肝脾、涩肠止痛之功[4]。 本课题组前期研究[5]发现,GC对葡聚糖硫酸钠(destran sulfate sodium, DSS)诱导的UC 小鼠肠道菌群有一定的影响,结果表明GC能够明显回调UC 小鼠肠道菌群的多样性,恢复UC小鼠结肠中拟杆菌门与厚壁菌门的比例,但机制尚不清楚。本文在前期研究的基础上,建立3% DSS 诱导的UC 模型,探究GC 对DSS 诱导UC 小鼠的治疗作用及其分子机制。
1 材料与方法
1.1 动物
SPF 级C57BL/6 雄鼠共36 只,6~8 周,体质量约20 g,购自成都达硕实验动物有限公司,饲养管理遵循《陕西省实验动物管理办法》。动物饲养于陕西中药资源产业化省部共建协同创新中心SPF 级实验动物中心,室内12 h 光照和黑暗更替。 实验动物许可证号:SCXK(川)2020-030。
1.2 药物
GC(陕西中医药大学制药厂,批号:20I11062);柳氮磺胺吡啶肠溶片(上海福达制药有限公司,批号:22200301)。
1.3 主要试剂
DSS(美国MP Biomedicals 公司,批号:S3045);BCA 蛋白浓度测定试剂盒(北京索莱宝科技有限公司,批号:20210922);小鼠白细胞介素-4(interleukin-4,IL-4)、白细胞介素-6(interleukin-6, IL-6)、白细胞介素-8(interleukin-8, IL-8)、白细胞介素-10(interleukin-10, IL-10)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)(欣博盛生物科技有限公司,批号:M190322-003a、M190322-004a、M190322-104a、M190322-005a、M210722-102a);兔抗鼠单克隆抗体核因子κB(nuclear factor-κB, NF-κB)/p65(#8242S)、核因子κB 抑制蛋白α(inhibitor alpha of NF-κB,IκBα)(#4812S)、信号转导及转录激活因子3(signal transduction and activator of transcription 3, STAT3)(#12460S)、磷酸化信号转导及转录激活因子3(phosphorylated signal transduction and activator of transcription 3,p-STAT3)(#9145S)均购自美国Cell Signaling Technology 公司;ECL 发光液(德国默克密理博公司,批号:2106001);HRP 标记羊抗兔IgG(批号:BA1105)、SDS-PAGE 凝胶制备试剂盒(批号:16H17B38)均购自博士德生物有限公司。
1.4 主要仪器
万分之一天平(德国美墨尔特有限公司,型号:1730R);GEL DocXR+伯乐凝胶成像系统(美国BIO-RAD 公司,型号:721BR11053);全自动样品快速研磨仪(上海净信实业发展有限公司,型号:JXFSTPRP-64);低温冷冻离心机(型号:75002440)、全波长酶标仪(型号:51119200)均购于美国Thermo 公司。
1.5 方法
1.5.1 实验分组及模型制备 36 只C57BL/6 雄鼠被适应性喂养7 d 后随机分为4 组。 除对照组小鼠自由饮用纯净水外,柳氮磺胺吡啶组、GC 组、模型组小鼠分别自饮3% DSS 进行UC 造模,小鼠出现体质量下降、腹泻便血等体征,疾病活动指数(disease activity index, DAI) 评分达到3 分时表示UC 建模成功[6]。
1.5.2 给药方法 依据课题组前期对GC 进行的研究[5],GC 组选择50 mg/kg 的GC 灌胃,0.075 g 的GC研成粉末后,加纯净水至15 mL,超声溶解配制成浓度为5 mg/mL 的药液;柳氮磺胺吡啶肠溶片配制成浓度为12.5 mg/mL 的柳氮磺胺吡啶混悬液,作为实验中的阳性对照[7]。 待UC 造模成功后,模型组与对照组灌胃相应体积纯净水,其余组小鼠灌胃相应体积药液。 实验小鼠灌胃体积为0.01 mL/g,均连续灌胃观察5 d,每天灌胃1 次。
每天根据DAI 评分表[8]对小鼠体征情况进行综合评分。 对体质量下降率、大便性状、血便情况进行评分,总分4 分,分值越高代表疾病状态越严重。
1.5.3 取材 连续灌胃观察5 d 后,小鼠禁食24 h,不禁水,眼眶采血备用,剪取约1 cm 结肠组织铺于塑料片上,用4%多聚甲醛固定结肠组织[9],石蜡块包埋,HE 染色观察小鼠结肠组织病理情况。
1.5.4 石蜡包埋和HE 染色 结肠组织样本在流水中冲洗1 h,放于逐级增加浓度的乙醇中脱水1 h,再用二甲苯透明处理,使组织的折光率增高呈透明状,脱脂后的组织放入石蜡中浸透,模具固定组织,凝固则制得包埋蜡块,冷冻15 min,最终切成5 μm的石蜡切片[10]。二甲苯充分脱蜡溶解后流水洗涤,石蜡切片在苏木素碱性染料中染色,水洗后再分化,入伊红染液中再次对其染色,最后再用乙醇脱水,浸泡于二甲苯溶液中直至透明,滴入中性树脂封固以长期保存。显微镜观察实验各组小鼠结肠组织的特征性病理变化[11]。
1.5.5 ELISA 法检测血清IL-4、IL-6、IL-8、IL-10、TNF-α 含量 实验动物眼球摘除取血,将血液样本分离后取其上清液,按照ELISA 试剂盒说明书进行血清炎症因子(IL-4、IL-6、IL-8、IL-10、TNF-α)含量测定。
1.5.6 Western blot 法检测结肠组织NF-κB、STAT3蛋白表达 取0.10~0.15 g 结肠组织,放入离心管进行制样。 加入裂解液充分匀浆,离心取上清,4 ℃冷藏。 配制BSA 浓度梯度标准液及BCA 工作液,在进行蛋白质定量分析后, 进行蛋白电泳。 电泳条件为90 V,30 min 后转120 V,然后进行转膜,封闭2 h后在4 ℃条件下孵育一抗NF-κB(1∶1000)、IκBα(1∶1000)、STAT3(1∶1000)、p-STAT3(1∶2000)过夜,用辣根过氧化酶标记的二抗与一抗在37 ℃条件下作用1 h,将PVDF 膜平铺于保鲜膜上,加入ECL 发光液避光反应2 min,最后用BIO-RAD 凝胶成像系统对PVDF 膜进行曝光处理。
1.6 统计学方法
采用GraphPad Prism 8.0.1 软件对实验数据进行处理,如果数据符合正态性分布和方差齐,多组间差异比较用单因素方差分析;如果非正态分布或方差不齐,多组间比较用Games-Howell 检验。P<0.05为差异具有统计学意义,实验所得结果用“±s”表示。
2 结果
2.1 各组给药前后一般情况观察及DAI 评分比较
与对照组相比,模型组小鼠DAI 评分显著增加(P<0.01),除对照组外,其余各组DAI 评分在前5天迅速上升,小鼠状态逐渐变差,体质量下降明显,大便不成形,个别出现血便,表明成功诱导UC 疾病模型;第5 天开始,与模型组比较,柳氮磺胺吡啶组和GC 组小鼠DAI 评分均下降(P<0.01),小鼠状态好转,体质量回升,大便性状正常。 柳氮磺胺吡啶组与GC 组比较,差异无统计学意义(P>0.05)。 详见图1。
2.2 各组结肠组织观察
对照组隐窝结构清晰,杯状细胞排列整齐,未见炎症细胞聚集;模型组可见腺体遭受不同程度破坏,杯状细胞减少,隐窝出现异常扭曲,炎性异常浸润,病变主要集中在黏膜层,表明UC 模型构建成功;柳氮磺胺吡啶组可见结肠结构相对恢复完整,隐窝及杯状细胞较为明晰,但黏膜层仍有部分炎症细胞浸润,表明柳氮磺胺吡啶对DSS 所致的UC 有缓解作用,但无法完全消除结肠受到的破坏和伤害;GC 组可见结肠组织形态完整,隐窝表面规整,杯状细胞形态清晰,黏膜结构有所恢复,表明GC 能有效改善小鼠结肠炎症状况,恢复UC 引起的结肠组织损伤。详见图2。
2.3 各组血清IL-4、IL-6、IL-8、IL-10、TNF-α 含量比较
与对照组比较,模型组IL-6、IL-8 和TNF-α 含量升高(P<0.01),IL-4、IL-10 含量降低(P<0.05,P<0.01);与模型组比较,GC 组IL-6、IL-8 和TNF-α含量下降(P<0.05,P<0.01),IL-4 含量升高(P<0.01);与柳氮磺胺吡啶组比较,GC 组IL-10 表达降低(P<0.05)、IL-4、IL-6、IL-8、TNF-α 差异无统计学意义(P>0.05)。 详见表1。
表1 各组血清IL-4、IL-6、IL-8、IL-10、TNF-α 含量变化(±s,n=6,pg/mL)
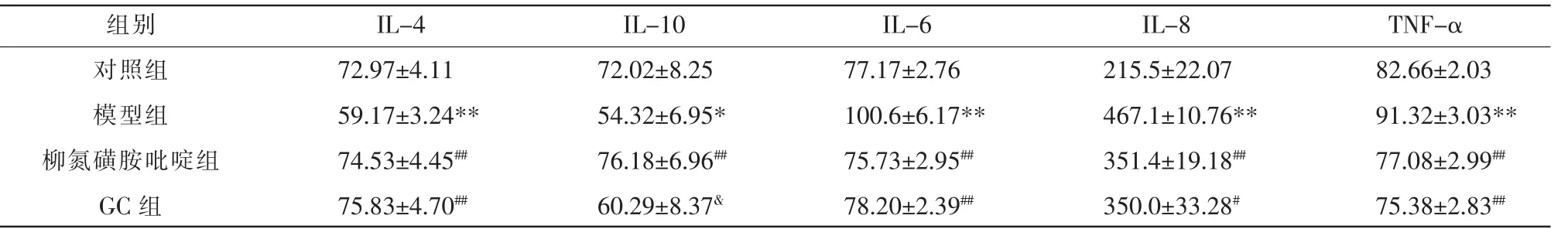
表1 各组血清IL-4、IL-6、IL-8、IL-10、TNF-α 含量变化(±s,n=6,pg/mL)
注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与柳氮磺胺吡啶组比较,&P<0.05。
IL-4 72.97±4.11 59.17±3.24**74.53±4.45##75.83±4.70##IL-10 72.02±8.25 54.32±6.95*76.18±6.96##60.29±8.37&IL-6 77.17±2.76 100.6±6.17**75.73±2.95##78.20±2.39##IL-8 215.5±22.07 467.1±10.76**351.4±19.18##350.0±33.28#组别对照组模型组柳氮磺胺吡啶组GC 组TNF-α 82.66±2.03 91.32±3.03**77.08±2.99##75.38±2.83##
2.4 各组结肠组织NF-κB、STAT3 蛋白表达水平比较
与对照组比较,模型组中NF-κB 和IκBα 蛋白表达降低(P<0.01),p-STAT3/STAT3 蛋白比值升高(P<0.05);与模型组比较,GC 组中的NF-κB 和IκBα蛋白表达升高(P<0.05,P<0.01),柳氮磺胺吡啶组和GC 组p-STAT3/STAT3 蛋白比值降低(P<0.05,P<0.01);与柳氮磺胺吡啶组比较,GC 组NF-κB 蛋白表达升高(P<0.05)、IκBα 蛋白和p-STAT3/STAT3蛋白比值差异无统计学意义(P>0.05)。详见图3、表2。
表2 各组结肠组织NF-κB、IκBα、p-STAT3 和STAT3蛋白表达比较(±s,n=6)
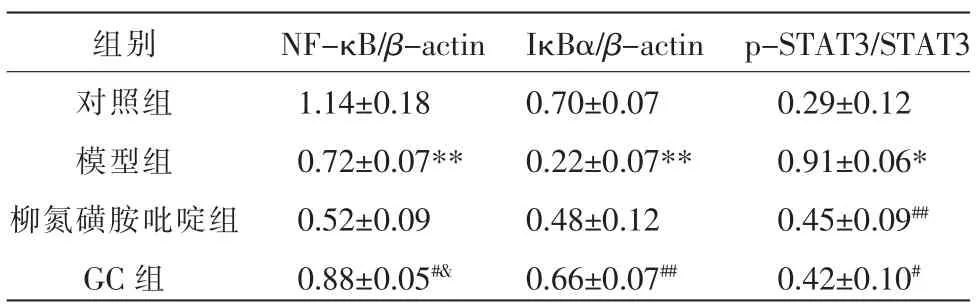
表2 各组结肠组织NF-κB、IκBα、p-STAT3 和STAT3蛋白表达比较(±s,n=6)
注:与对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与柳氮磺胺吡啶组比较,&P<0.05。
组别对照组模型组柳氮磺胺吡啶组GC 组NF-κB/β-actin 1.14±0.18 0.72±0.07**0.52±0.09 0.88±0.05#&IκBα/β-actin 0.70±0.07 0.22±0.07**0.48±0.12 0.66±0.07##p-STAT3/STAT3 0.29±0.12 0.91±0.06*0.45±0.09##0.42±0.10#

图3 各组结肠组织NF-κB、IκBα、p-STAT3 和STAT3 蛋白条带图
3 讨论
UC 属于炎性肠病的临床亚型,发生于各个年龄段,因其发病机制尚未确定而受到广泛关注[12]。临床上常用柳氮磺胺吡啶治疗UC,但长期使用容易引起各种不良反应,而中药方剂因其多样性、疗效确切、安全性高,故更适用于UC 的治疗[13-15]。 GC 是治疗UC 的经典药物之一,其成分中的乌梅收敛涩肠;黄连苦寒燥湿;干姜温中实脾,缓解黄连寒凉之性,使黄连寒而不滞[16],协同达到行气活血、润肠止泻的功效,改善由UC 引起的寒热错杂、阴虚肠燥等证型。
本实验建立由DSS 诱导的UC 小鼠模型,评估GC 的作用效果。DAI 评分显示,GC 通过减缓小鼠体质量减轻、改善大便性状等临床表现,恢复UC 对小鼠体征的影响;病理学组织切片结果表明,GC 能保护肠黏膜、减少炎症细胞的浸润、减轻腺体紊乱、改善肠道内炎症。炎症的发生多是由于炎症因子的失衡导致[17],因此,调节促炎因子和抑炎因子水平的平衡是治疗炎症的关键指标之一,本研究结果显示GC 可下调IL-6、IL-8 和TNF-α 水平,并上调抑炎因子IL-4 和IL-10 的表达,说明GC 可在一定程度上调节炎症因子的表达,改善促炎因子和抑炎因子的失衡。
本课题组前期已研究GC 对DSS 诱导的UC 小鼠的影响,结果显示,GC 调节UC 小鼠肠道内炎症细胞因子和肠道细菌丰度,进而改善UC 的病理表现[5]。既往研究表明,STAT3 和NF-κB 信号通路在UC的发展过程中起关键作用[18-19]。 STAT3 和NF-κB 的激活和串扰,促使炎症因子产生和释放,可导致慢性炎症和肿瘤的发生。 NF-κB 在细胞静息状态下与抑制性蛋白IκB(IκBα)稳定结合在细胞质中,当胞外信号传递至胞内,在激酶IKK 组成的复合物作用下,IκBα 被磷酸化降解,NF-κB 亚基进入核内,诱发炎症[20-21]。 研究表明,STAT3 为UC 研究领域较为有价值的信号通路相关蛋白之一,其激活和过度表达与炎症的发生密切相关[22-24],STAT3 利用反式传导信号,使IL-6 和受体结合,诱导STAT3 磷酸化后作用于目的基因,引起炎症发生[25]。 本研究主要观察GC 是否能调控STAT3 和NF-κB 信号通路,在Western blot法检测结果中,与模型组比较,GC 抑制UC 小鼠结肠组织中NF-κB 和STAT3 蛋白表达,且差异有统计学意义(P<0.05)。上述实验结果提示,GC 抗UC 的作用可能与NF-κB 和STAT3 炎症信号通路活化有关。
综上所述,GC 可降低UC 小鼠DAI 评分和改善组织炎症,其抗UC 作用可能与激活炎症信号通路和炎症因子的释放有关,具体机制还有待探讨。

