治伤巴布剂影响辣椒素受体表达的机制探讨
郑吉云,邵先舫,张峻峰,潘晓彦,李 岗*,夏新华*,闫 蕾
(1.湖南中医药大学,湖南 长沙 410208;2.湖南中医药大学附属常德医院,湖南 常德 415000;3.成都中医药大学,四川 成都 610000)
由常德市第一中医医院名老中医祖传秘方——“治伤散”改良而来的治伤巴布剂,由血壳、虎杖、见风消组成,具有行血散瘀、行气通经、活络止痛的功用,主要用于腰肌劳损、急慢性软组织损伤、关节扭伤、关节炎等疾病导致的疼痛。
辣椒素受体(vanilloid receptor 1, VR1)是属于非选择性阳离子通道家族的门控性阳离子通道,打开后可以让阳离子快速从胞外进入胞内,引起一系列效应[1-3],其中包括炎性疼痛的生理和病理变化。 现有研究[4-10]发现炎性介质对其影响的机制有以下几个方面:(1)通过花生四烯酸代谢物等通道激动剂来激活VR1;(2) 增加在感觉神经细胞膜上的VR1;(3)使VR1 磷酸化。 HELLIWELL 等[11]研究表明,在炎性疼痛过程中VR1 的介导发挥着重要的作用,VR1广泛存在于大鼠背根神经节(dorsal root ganglia,DRG)中;CATERINA 等[12]培育出对炎性疼痛反应降低的VR1 基因敲除小鼠,但对伤害性刺激有正常反应。 因此,在一些具有伤害性的刺激中,尤其是在伤害性热刺激所致的痛敏中的传递中,VR1 起到关键的作用,甚至痛觉的产生必需依赖VR1[13]。
p38MAPK 信号转导通路,是产生和保持疼痛的通路,其与疼痛敏感化密切相关[14]。 进一步探究p38MAPK 在疼痛敏感化机制中的作用,为疼痛敏感化疾病提供新的治疗靶点,是本次实验研究的目标之一。 现有研究表明[15],NGF、MAPK 信号通路、VR1三者与炎性疼痛形成密切相关,MAPK 信号通路参与了VR1 的表达,其作用机制与干预VR1 基因的转录与翻译、蛋白的合成有关。
为了探究其镇痛作用和镇痛机制,本实验利用福尔马林足底炎性疼痛大鼠模型,进行治伤巴布剂与云南白药膏的对比实验研究,并论述其镇痛作用和镇痛机制,探究治伤巴布剂是否通过调控NGF/p38MAPK/VR1 信号通路影响VR1 的转录和翻译,从而影响疼痛的表达。
1 材料
1.1 实验动物
健康雄性SD 大鼠共36 只,体质量250~280 g,由湖南斯莱克景达动物实验中心提供(SPF 级),合格证号:SCXK(湘)2019-0004)。 于长沙维尔生物科技有限公司动物实验中心内饲养。大鼠均采用无菌颗粒饲料饲养,自由饮水,环境温度稳定在20~25 ℃,室内通风良好,定时更换垫料。
1.2 药物
治伤巴布剂(湖南中医药大学附属常德医院药剂科,湘药制备号:Z20220594000)药方组成:血壳60 g、虎杖15 g、见风消10 g;云南白药膏(云南白药集团股份有限公司,批号:ZCA2126,国药准字:Z20073015)。
1.3 试剂及仪器
VR1 抗体、β-actin 抗体(美国Proteintech 公司,批号:66983-1-Ig、66009-1-Ig);山羊抗鼠IgG(美国Proteintech 公司,批号:SA00001-1);还原型5XSDS上样缓冲液、1.5 mol/L Tris·HCl(pH 8.8)、1.0 mol/L Tris·HCl(pH 6.8)、10%APS、10%SDS、TEMED、PBST 缓冲液、30%Acr/Bic、电泳液缓冲液、转膜缓冲液、10x 丽春红染液、脱脂奶粉、RIPA 裂解液、蛋白磷酸酶抑制剂、Super ECL Plus 超敏发光液(中国Abiowell 公司,货号:AWB0055、AWB0073、AWB0074、A WB0093、AWT0047、AWB0068、AWI0130、AWB0020、AWB0083、AWC0114、AWB0225、AWB0004、AWB0136、AWH0650、AWB0005);蛋白酶抑制剂(北京金泰宏达生物科技有限公司,货号:583794);BSA(盐城赛宝生物科技有限公司,货号:52724);显影液、定影液(上海佳信科技有限公司,货号:BW-61、BW-62);由北京擎科生物科技有限公司合成引物。
H1650R 型台式冷冻离心机(湖南湘仪实验室仪器开发有限公司);DYY-6C 型电泳仪、DYCZ-24DN型电泳槽、DYCZ-40D 型转膜仪(北京六一生物科技有限公司);JB-13 型磁力搅拌器、PHS-3C 型精密pH 计(上海仪电科学仪器股份有限公司);BioPrep-24 型生物样品均质仪(杭州奥盛仪器有限公司);ChemiScope6100 型化学发光成像系统(上海勤翔科学仪器有限公司)。
2 方法
2.1 动物造模、分组及给药
36 只雄性SD 大鼠,随机分为正常组(n=9)和造模组(n=27)。抽取5%福尔马林0.1 mL 注入造模组大鼠左侧后足底皮下建立大鼠炎性疼痛模型[16],正常组注射相应体积的生理盐水。将造模成功的大鼠随机分成模型组、 治伤巴布剂组及云南白药膏组。治伤巴布剂组以治伤巴布剂(3 cm×3 cm)外敷于大鼠左后足足底;云南白药膏组则予以云南白药膏(3 cm×3 cm)外敷于大鼠左后足,正常组和模型组分别于足底贴敷空白膏剂(3 cm×3 cm)各组大鼠分为3 个亚组,分别连续贴敷相应膏药1、3、7 d。
2.2 各组大鼠的痛行为观察及分级评价[17]
经造模后分别在1、5、15、30、45、60、90、120 min时间点观察各组大鼠疼痛反应,按下述标准进行疼痛分级并记录:0 分为注射福尔马林一侧后足与对侧后足均接触底面,行走自如;1 分为两侧后足均接触底面,但注射侧在行走时轻微跛行;2 分为两侧后足均接触底面,行走时中心偏向健侧,出现明显跛行;3 分为注射侧后足轻触底面,不敢负重,行走时抬起;4 分为注射侧后足抬起,悬空状态;5 分为大鼠出现舔、咬、抖动注射侧后足。
2.3 各组大鼠组织标本的取材与处理
造模成功后对各组大鼠分别在3 个时相点(1、3、7 d)进行标本取材,在各时相点分别取3 只。 用4%的PA 固定,取出大鼠左后足底肌肉组织和L3~L6 节段DRG;冻存样分两份,L4 用于Western blot 检测、L5 用于RT-PCR 检测[18-19]。
2.4 RT-PCR 检测大鼠DRG 中VR1 的mRNA 表达水平
取0.02 g 组织裂解,离心取上层液在260 nm与280 nm 处测其吸光度值,并计算其浓度和纯度,并将取得的总mRNA 为模板,逆转录cDNA。本实验选用GAPDH 为内参,数据处理:采用2-ΔΔCt法,计算mRNA 的相对表达量。 各基因引物序列详见表1。
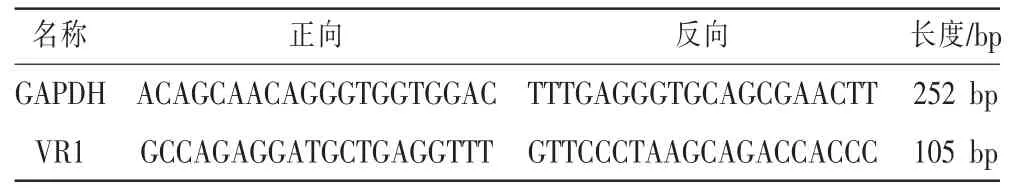
表1 各基因引物序列表
2.5 Western blot 检测大鼠DRG 中VR1 的蛋白表达水平
取0.025 g 组织裂解离心后取200 μL 蛋白上清,加入50 μL 5×loading buffer 混匀,将样品上样电泳后与经一抗(VR1:TRPV1 Monoclonal antibody(1∶2000);β-actin:Beta Actin Monoclonal antibody(1∶5000)孵育的NC 膜放入转膜缓冲液中进行转膜,后将NC 膜与1∶5000 稀释后的HRP goat anti-mouse IgG 室温孵育90 min。 显色曝光后用quantity one专业灰度分析软件进行分析。
2.6 免疫组化法检测大鼠足底肌肉中NGF 以及DRG 中p-p38MAPK 蛋白的表达水平
包埋处理大鼠肌肉组织及DRG,将组织切成4~6 μm 的薄片,脱蜡、热修复抗原及灭活内源性酶后分别滴加经1∶200 稀释的重组Anti-NGF、Anti-pp38MAPK 抗体,4 ℃过夜后滴加50~100 μL 抗-兔-IgG 抗体-HRP 多聚体,37 ℃孵育30 min。 滴加适当显色剂及染色液后树胶封片,于40×10 倍显微镜下采集图片。采集的图片经Image J 软件分析后得出平均IOD,将所得数据录入SPSS 数据分析软件处理。
2.7 统计学方法
采用统计学软件SPSS 19.0 进行分析,计量资料以“±s”表示,采用方差分析。数据符合正态分布且方差齐者,使用单因素方差分析,两两比较采用ANOVA分析;方差不齐则用秩和检验。以P<0.05 为差异有统计学意义。
3 结果
3.1 各组大鼠疼痛行为学表现比较
模型组、治伤巴布剂组和云南白药膏组大鼠出现躁动尖叫并撕咬左后足等典型的双相伤害性行为反应,提示造模成功。 疼痛反应呈典型的双相变化,即注射后即刻开始,持续3~5 min 的急性疼痛时相(第一时相),5~10 min 的静息期,和随后出现的可持续40~60 min 的继发性疼痛时相(第二时相)。 正常组无上述行为,疼痛反应积分为0。 详见图1。
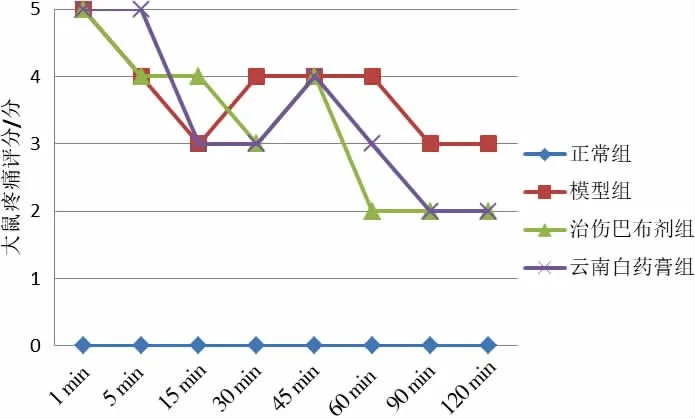
图1 注射福尔马林后不同时间各组大鼠疼痛评分折线图
3.2 各组大鼠DRG 中VR1 mRNA 水平
与正常组比较,模型组大鼠在3 个时间点DRG中VR1 mRNA 水平增加(P<0.05);与模型组比较,治伤巴布剂组和云南白药膏组大鼠在3 个时间点DRG 中VR1 mRNA 水平降低(P<0.05);与云南白药膏组比较,治伤巴布剂组大鼠DRG 中VR1 mRNA水平1、3、7 d 降低。 详见表2。
表2 4 组大鼠DRG 中VR1 mRNA 相对表达水平的比较(±s,n=9)

表2 4 组大鼠DRG 中VR1 mRNA 相对表达水平的比较(±s,n=9)
注:与正常组相比,**P<0.05;与模型组相比,##P<0.05;与云南白药膏组相比,△△P<0.05。
组别正常组模型组治伤巴布剂组云南白药膏组F 值P 值1 d 1.19±0.25 4.62±0.43**3.67±0.55**##△△3.70±0.26**##124.343 0.000 3 d 0.96±0.15 3.27±0.45**2.50±0.40**##△△2.94±0.22**##87.085 0.000 7 d 1.11±0.19 4.03±0.48**2.62±0.22**##△△3.22±0.30**##136.374 0.000
3.3 各组大鼠DRG 中VR1 蛋白表达比较
与正常组比较,模型组大鼠在3 个时间点DRG中VR1 蛋白表达水平增加(P<0.05);与模型组比较,治伤巴布剂组和云南白药膏组大鼠在3 个时间点DRG 中VR1 蛋白表达水平降低(P<0.05);与云南白药膏组相比,治伤巴布剂组大鼠DRG 中VR1蛋白表达水平在1、3、7 d 降低(P<0.05)。 详见表3、图2。
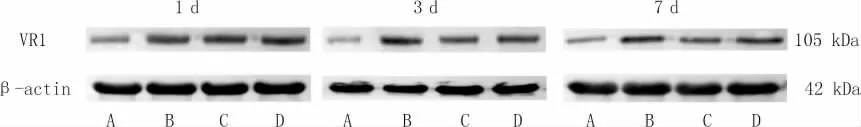
图2 各组大鼠DRG 中VR1 蛋白表达电泳图
表3 4 组大鼠DRG 中VR1 条带灰度分析结果(±s,n=9)

表3 4 组大鼠DRG 中VR1 条带灰度分析结果(±s,n=9)
注:与正常组相比,**P<0.05;与模型组相比,##P<0.05;与云南白药膏组相比,△△P<0.05。
组别正常组模型组治伤巴布剂组云南白药膏组F 值P 值1 d 0.13±0.20 0.59±0.15**0.27±0.08**##△△0.28±0.10**##11.366 0.003 3 d 0.16±0.06 0.55±0.08**0.29±0.09**##△△0.33±0.10**##11.734 0.003 7 d 0.13±0.03 0.57±0.08**0.24±0.06**##△△0.27±0.05**##31.353 0.000
3.4 各组大鼠足底肌肉中NGF 及DRG 中p-p38MAPK相对表达量比较
与正常组比较,模型组大鼠足底肌肉中NGF 及DRG 中p-p38MAPK 在3 个时间点相对表达量增加(P<0.05);与模型组比较,治伤巴布剂组和云南白药膏组中大鼠足底肌肉中NGF 及DRG 中p-p38MAPK在3 个时间点相对表达量降低(P<0.05);与云南白药膏组相比,治伤巴布剂组大鼠足底肌肉中NGF 相对表达量在3、7 d 降低,1 d 增加 (P<0.05),DRG 中pp38MAPK 相对表达量在3 d 降低,1、7 d 增加(P<0.05)。详见表4、表5 和图3、图4。
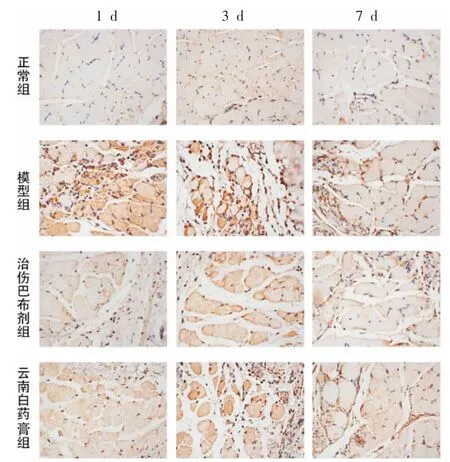
图3 各组大鼠足底肌肉中NGF 相对表达病理图片(光镜,×400)

图4 各组大鼠DRG 中p-p38MAPK 的相对表达病理图片(光镜,×400)
表4 4 组大鼠足底肌肉中NGF 相对表达量比较(±s,n=9)
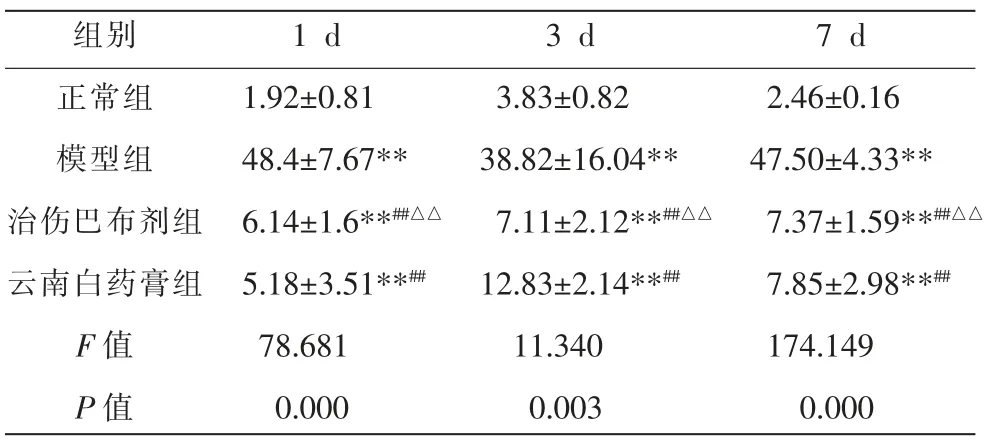
表4 4 组大鼠足底肌肉中NGF 相对表达量比较(±s,n=9)
注:与正常组相比,**P<0.05;与模型组相比,##P<0.05;与云南白药膏组相比,△△P<0.05。
组别正常组模型组治伤巴布剂组云南白药膏组F 值P 值1 d 1.92±0.81 48.4±7.67**6.14±1.6**##△△5.18±3.51**##78.681 0.000 3 d 3.83±0.82 38.82±16.04**7.11±2.12**##△△12.83±2.14**##11.340 0.003 7 d 2.46±0.16 47.50±4.33**7.37±1.59**##△△7.85±2.98**##174.149 0.000
表5 4 组大鼠DRG 中p-p38MAPK 相对表达量比较(±s,n=9)

表5 4 组大鼠DRG 中p-p38MAPK 相对表达量比较(±s,n=9)
注:与正常组相比,**P<0.05;与模型组相比,##P<0.05;与云南白药膏组相比,△△P<0.05。
组别正常组模型组治伤巴布剂组云南白药膏组F 值P 值1 d 3.22±0.75 5.50±0.61**4.62±1.10**##△△4.06±1.51**##1.896 0.209 3 d 3.73±1.94 6.93±0.93**4.09±2.75**##△△5.17±2.72**##1.264 0.350 7 d 2.24±0.74 5.79±0.75**4.76±2.16**##△△1.58±0.66**##7.764 0.009
4 讨论
中医学认为疼痛产生的原因分为“不通则痛”。“不通则痛”指当正气虚弱或实邪阻滞,导致人体的气血在经络中运行受阻,此时应行气活血来散淤通经、活络止痛,炎性疼痛则属于“不通则痛”。 治伤巴布剂属于外敷中药制剂,主要由血壳、虎杖、见风消组成,临床将其用于治疗急慢性腰肌损伤和其他软组织损伤、关节扭伤、关节炎等疾病导致的疼痛,以发挥其通络止痛的治疗作用。
本研究通过治伤巴布剂外敷干预炎性疼痛大鼠模型,在1、3、7 d 取材,检测大鼠VR1 蛋白和mRNA 表达水平以及NGF 和p-p38MAPK 蛋白的表达量;以往的研究[20]表明p-p38MAPK蛋白的表达量与VR1 蛋白表达量呈正相关。 本研究表明,与模型组比较, 治伤巴布剂组和云南白药膏组大鼠DRG 中VR1的蛋白和mRNA 表达水平在1、3、7 d 降低(P<0.05);与云南白药膏组比较,治伤巴布剂组大鼠DRG 中VR1 的蛋白和mRNA 表达水平在1、3、7 d 降低(P<0.05)。免疫组化检测结果显示,与正常组比较,模型组大鼠足底肌肉中NGF 及DRG 中p-p38MAPK 相对表达量在1、3、7 d 增加(P<0.05);与模型组比较,治伤巴布剂组和云南白药膏组中大鼠足底肌肉中NGF 及DRG 中p-p38MAPK 相对表达量在1、3、7 d降低(P<0.05),与云南白药组相比,治伤巴布剂组大鼠足底肌肉中NGF 相对表达量在3、7 d 降低,1 d增加(P<0.05),DRG 中p-p38MAPK 相对表达量在3 d 降低,1、7 d 增加(P<0.05)。
根据以上结果,我们可以得出以下结论:(1)治伤巴布剂镇痛作用是通过NGF/p38MAPK/VR1 信号通路调控VR1 蛋白的表达实现的;(2)云南白药膏组的VR1 的蛋白和mRNA 表达水平出现不匹配现象,可能存在其他通路影响VR1 的翻译,但从结果来看,治伤巴布剂对于VR1 转录与翻译的抑制作用均强于云南白药膏组;(3)治伤巴布剂对于NGF 的释放具有抑制作用;(4)根据大鼠DRG 中p-p38MAPK相对表达量比较结果,与治伤巴布剂比较,云南白药膏与p38MAPK 信号转导通路相关性更强。 本研究以炎症反应为出发点,揭示了治伤巴布剂对于炎性疼痛镇痛的作用机制可能是通过调控NGF/p38MAPK/VR1 信号通路影响VR1 的转录和翻译,为指导临床用药及中医中药的应用提供新思路。
本实验还有许多不足:(1)本研究有待大样本实验验证;(2)炎性疼痛反应还受存在相互联系的JAK/STAT、mTOR 及多条重要信号通路的调控[21-22],治伤巴布剂是否通过这些途径发挥了作用,本研究未能明确,这需要我们在今后的研究中继续探索与研究。

