腹腔镜手术联合GnRH-a治疗子宫内膜异位症伴不孕症对患者血清自身免疫功能及卵巢功能影响
方金华 许 莉 原二芳
海南省海口市妇幼保健院(570203)
子宫内膜异位症(EMs)部分可引起不孕[1]。是育龄妇女不孕的独立危险因素[2]。目前手术是治疗EMs伴不孕的首选方法,腹腔镜手术为当前主流术式,但单纯手术治疗难以清除内膜组织病灶,术后有较高复发风险,因此临床上多结合药物治疗以提高术后效果[3-4]。促性腺激素释放激素激动剂(GnRH-a)是治疗EMs最有效药物,但干预有效性仍存在一定争议[5-7]。EMs导致不孕的作用机制复杂,目前认为主要与盆腔解剖结构及输卵管改变、免疫功能异常、内分泌异常等因素相关,各因素共同作用导致不孕症的发生[8-9]。分析治疗方法对这些因素的影响或可为明确治疗效果、治疗机制提供理论依据。本研究以EMs伴不孕患者作为研究对象,分析腹腔镜手术联合GnRH-a的治疗效果,分析血清自身免疫抗体AsAb、AEmAb、AZpAb及卵巢功能指标变化,探讨腹腔镜手术联合GnRH-a治疗的可能机制。
1 资料与方法
1.1 一般资料
纳入2015年9月—2018年9月本院妇科收治的EMs所致不孕症患者。纳入标准:①年龄20~35岁;②符合《中华妇产科学》中不孕症诊断标准[10];③符合《子宫内膜异位症诊治指南》[11]标准确诊为EMs;④有腹腔镜手术指征,因EMs导致不孕(排除宫腔子宫内膜粘连);⑤卵巢病灶≥4cm包块,深部浸润型病灶;⑥有手术意愿可进行随访,对本研究知情并签署同意书。排除标准:①因排卵障碍、子宫畸形等其他因素导致不孕不育或其他不适合受孕疾病;②合并中重度妇科炎症、卵巢病变、巨大卵巢囊肿等疾病;③伴有严重内外科疾病、恶性肿瘤、精神系统疾病;④近半年使用激素类药物周期治疗;⑤无法按时服药或不能及时复诊、复查;⑥对本研究药物过敏。本研究经伦理委员会审批。
1.2 治疗方法
基于患者意愿分组,入组后明确病情取得患者知情同意后,均行腹腔镜手术治疗。月经干净后1周内进行手术,术前常规阴道、肠道准备。常规全身麻醉,建立气腹并置入腹腔镜,全面探查腹腔器官及腹膜情况,钝、锐性及双极电凝分离粘连组织,基本恢复盆腔器官解剖结构。行异位病灶电灼术或囊肿剥离术,结节状病灶采用病灶表面电灼,完全气化破坏病灶;对于游离的巧克力囊肿结构,采用单极电钩穿破囊壁,冲洗囊内液体,扩大切口并剔除囊肿壁,装袋取出,注意避免组织污染或组织遗留在腹腔形成新的异位灶。行输卵管美兰通液术,输卵管有粘连或缩窄的部位进行松解,伞端闭锁者行输卵管造口。手术结束后生理盐水冲洗腹腔,术后盆腔留置几丁糖等制剂防止粘连。观察组术后第3天始肌内注射GnRH-a(达菲林),每次3.75mg,每28d注射1次,共注射3次;对照组术后给予2.5mg孕三烯酮治疗,每周2次,连续用药6个月。
1.3 观察指标
于术前及术后3、6个月时采用模拟数字评分法(VAS)[12]评价疼痛情况,酶联免疫吸附法检测血清自身免疫抗体AsAb、AEmAb、AZpAb等水平,试剂购自北京美迪科生物科技有限公司;卵巢功能相关指标雌二醇(E2)、促黄体生成素(LH)、促卵泡刺激素(FSH)水平,采用电化学发光法检测。两组均于术后3、6、12、24个月时门诊随访。随访内容包括月经、避孕、辅助生殖措施选择、妊娠、EMs复发等情况,血或尿人绒毛膜促性腺激素阳性,妊娠至分娩并产出正常足月新生儿为正常妊娠;影像学检查提示出现新病灶,且为EMs典型症状视为复发。
1.4 统计学分析

2 结果
2.1 一般情况
共纳入患者122例,观察组(62例)及对照组(60例)。两组年龄、不孕年限、EMs病程、包块直径、生育指数评分(EFI)等比较无差异(P>0.05)。见表1。

表1 两组一般资料比较
2.2 手术前后患者疼痛情况
VAS评分两组患者术前无差异(P>0.05),术后3、6个月时观察组低于对照组(P<0.05)。见表2。
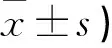
表2 两组手术前后VAS评分比较(分,
2.3 手术前后血清抗体转阴情况
血清AsAb、AEmAb、AZpAb阳性率,两组术前、术后3个月比较无差异(P>0.05);术后6个月时观察组均低于对照组(P<0.05)。见表3。

表3 两组手术前后血清自身免疫抗体阳性率比较[例(%)]
2.4 手术前后卵巢功能指标变化
术后3、6个月观察组卵巢功能指标水平均低于对照组(P<0.05)。见表4。
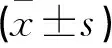
表4 两组手术前后卵巢功能指标比较
2.5 术后妊娠情况
两组助孕率无差异(P>0.05),术后12、24个月时累计妊娠率、正常良好妊娠率观察组均高于对照组(P<0.05)。见表5。

表5 两组随访期间妊娠情况分析[例(%)]
2.6 随访术后EMs复发及不良反应情况
观察组术后12个月(2例,3.2%)、24个月(3例,4.8%)EMs复发率与对照组(4例,6.7%)(9例,15.0%)比较无差异(χ2=0.772、3.550,P=0.380、0.060)。两组均未见明显不良反应发生。
3 讨论
EMs是一种良性疾病,但可表现出与恶性肿瘤类似的生长能力,腹腔镜手术创伤小,术中出血少,术后恢复快,但术后仍存在不同程度复发,得不到理想的治疗效果。孕激素是腹腔镜联合治疗方法,本研究使用的孕三烯酮,有抗孕激素及抗雌激素作用,可直接作用于内膜及异位灶,引起异位灶萎缩。GnRH-a是一种多肽神经激素,对神经系统、免疫系统及内分泌系统均存在密切联系。既往已研究证实GnRH-a联合腹腔镜手术对EM患者症状的改善效果,但对患者远期妊娠、复发的影响研究有不同结论[13]。国外一项大样本研究证实,在腹腔镜基础上联合使用GnRH-a可提高EMs患者术后2年累计妊娠率,降低复发[14];郭清萍等[15]开展的一项研究证实,与孕三烯酮比较,腹腔镜联合GnRH-a治疗的总体有效率(95.65%)显著高于孕三烯酮治疗(71.74%);朱晓华等[16]研究证实,腹腔镜联合孕三烯酮治疗及GnRH-a治疗有效率分别为70.00%、92.50%,1年妊娠率分别为42.50%、65.00%,1年复发率分别为25.00%、7.50%。本研究结果显示,联合使用GnRH-a治疗后12个月时累计妊娠率较高,这一趋势与朱晓华等[16]研究结果类似,但复发率有所差异,差异原因可能与随访时间、药品厂家等因素相关。
EMs导致不孕的机制复杂,目前认为免疫功能异常、内分泌功能异常是重要原因[17-18]。EMs是一种相对器官特异性自身免疫病,患者子宫腹腔病灶内存在大量腹水,其中有大量活化的巨噬细胞,这些巨噬细胞参与多个环节的免疫反应,同时也对精子活力、受精作用造成影响,影响受孕[19];患者腹腔液内免疫细胞也可刺激细胞因子的增加,这些细胞因子可明显抑制精子穿透卵细胞的能力,造成不孕,部分细胞因子如白细胞介素-8(IL-8)也可趋化单核细胞,增加新生血管的生成,通过自分泌作用促进异位内膜的定植,加重EMs病情进展[20]。AsAb、AEmAb、AZpAb是一类影响受孕、可导致流产的自身免疫抗体,张宏威等[21]研究显示,与健康体检女性比较,不孕症患者血清AsAb、AEmAb、AZpAb阳性率较高;而一项针对EMs的研究表明,未干预的患者可出现自然杀伤细胞数量减少,免疫屏障被破坏,机体相关抗体增加[22]。分析免疫水平变化或可为患者不孕治疗效果评估提供一定参考。本研究结果显示,在术后6个月时观察组血清AsAb、AEmAb、AZpAb阳性率均低于对照组,提示腹腔镜手术联合使用GnRH-a可降低机体免疫性抗体水平。分析认为:一方面腹腔镜手术可较好去除子宫内膜异位灶,降低机体免疫系统对异位灶的攻击,降低自身抗体;GnRH-a治疗也可通过抑制激素分泌,抑制异位灶的增殖,促使自身抗体的转阴。既往张玲玉等[23]探讨了GnRH-a对子宫内膜异位症大鼠的影响,结果显示给予GnRH-a后第4周,小鼠异位灶内血清TNF-α、StAR表达水平明显降低,同时异位病灶体积也明显降低;朱敏珊等[24]开展的一项临床研究也证实,给予GnRH-a治疗可降低患者AsAb、AEmAb、AZpAb等免疫指标抗体阳性率。本研究在以往研究结果基础上进一步证实,腹腔镜手术联合使用GnRH-a对EMs伴不孕有较好临床效果。
内分泌功能异常也是不孕发生的重要原因,研究表明,EMs患者可伴有高泌乳素血症,泌乳素分泌异常可影响卵巢的分泌功能从而引起不孕[25];另外也有研究证实,EMs患者易发生黄体功能不全,这可能也是引起不孕的重要机制[26]。本研究治疗后两组血清E2、FSH、LH均降低且观察组各指标降幅更大,提示腹腔镜手术联合使用GnRH-a可对相关性激素水平发挥更大的调节作用。结合EMs导致不孕的机制,推测GnRH-a的免疫抑制效应及改善内分泌激素效应是提高妊娠率、降低复发的可能机制。
腹腔镜手术联合使用GnRH-a可提高EMs伴不孕患者妊娠率,降低复发,其机制可能与GnRH-a的免疫抑制效应及改善性激素效应相关,整体效果较孕激素效果更好。本研究样本量较少,且患者远期受孕情况可受其他因素影响,本研究未对这些混杂因素进行收集及分析,仍有待扩大样本量并进行因素分析,进一步探讨GnRH-a对EMs伴不孕治疗效果。

