低氧暴露对小鼠脾淋巴细胞增殖和凋亡的影响
郭玉静,胡英,龙启福,许玉珍,李积东,永胜
氧关乎生物的生命,当机体处于低氧状态时会引起组织和细胞不可逆转的损伤。低氧会改变细胞代谢[1],诱导炎性细胞因子产生[2],导致氧化损伤[3],并影响细胞的增殖和凋亡信号通路[4]。淋巴细胞作为机体重要的适应性免疫应答细胞,在维持免疫稳态中必不可少。研究发现,低氧暴露可抑制CD3/CD28抗体介导的T淋巴细胞增殖、分化并减少B淋巴细胞激活因子受体和表面受体(如BCR、CD19等),导致淋巴细胞水肿,未成熟B淋巴细胞发育停滞,T、B淋巴细胞数量减少,最终诱导淋巴细胞损伤[5-7]。本课题组前期研究发现,低氧暴露30 d后,小鼠脾的T淋巴细胞数量减少、CD4+T/CD8+T淋巴细胞比例下降且CD4+T淋巴细胞活化水平显著降低[8]。然而,并未对低氧暴露诱导淋巴细胞数量减少的机制进行探究。因此,本研究通过检测低氧暴露对淋巴细胞增殖和凋亡的影响,以探究低氧诱导下淋巴细胞数量减少的潜在机制。
1 材料与方法
1.1实验动物6~8周龄SPF级C57BL/6雄性小鼠30只,体质量(18±2)g,购自西安交通大学医学部实验动物中心,动物生产许可证号:SYXK(陕)2020-005。饲养于18~22℃动物房中,自由进食饮水。本实验已经过青海大学伦理协会审查。
1.2试剂和仪器胎牛血清(FBS,北京TransGen Biotech公司);抗小鼠CD3藻红蛋白-花青素7(PE-cy7)抗体、抗小鼠CD19别藻青蛋白(APC)抗体、羧基荧光素乙酰乙酸(CFSE)增殖检测试剂盒、FITC Annexin V凋亡检测试剂盒(美国BD公司);淋巴细胞非特异性刺激物刀豆蛋白A(ConA,美国Sigma公司);逆转录试剂盒和实时荧光定量PCR(qPCR)试剂盒(日本TaKaRa公司);引物[生工生物工程(上海)股份有限公司];硝酸纤维素(NC)膜(美国Pall Corporation公司);鼠源B细胞淋巴瘤/白血病-2(bcl-2)蛋白抗体、鼠源胱天蛋白酶-3(caspase-3)蛋白抗体、辣根过氧化物酶标记的山羊抗兔二抗和山羊抗小鼠二抗(Proteintech公司);兔源bcl-2同源拮抗剂-杀伤蛋白(Bak)蛋白抗体(Affinity公司);增强化学发光液(美国Thermo Fisher Scientific公司)。细胞培养箱(中国海尔公司);低氧培养箱(美国BioSpherix公司);流式细胞仪(美国Beckman公司);冷场发射扫描电子显微镜(日本JEOL公司);荧光定量PCR仪(瑞士Roche公司);电泳仪、转膜仪(美国Bio-Rad公司);凝胶成像系统(法国VILBER公司)。
1.3方法
1.3.1小鼠脾淋巴细胞分离和培养将小鼠脱颈处死,用75%乙醇浸泡5 min,然后用无菌镊剪切开小鼠腹腔,摘除脾,用1 mL PBS清洗5次。将脾切为3份,置于2 mL PBS的无菌平皿内,用无菌镊挤压脾组织。取脾细胞悬浮液经200目尼龙筛滤器后,于50 mL无菌离心管中,4℃、1 500 r/min离心5 min,弃去上清液,加3 mL红细胞裂解液混合均匀,置于冰盒15 min,充分溶解后4℃、1 500 r/min离心10 min,弃去上清液,PBS冲洗1~2次。最后将含10%FBS与1%的青链霉素的RPMI 1640培养液重悬浮细胞。用细胞计数仪对10 μL的细胞进行计数,重复3次,取平均值(细胞存活率≥95%)。将细胞浓度调整为2.0×106/mL,然后将细胞(1×106个/mL)加入24孔板。将同一只小鼠淋巴细胞分为2组,常氧组置于CO2细胞培养箱(37℃、5%CO2、21%O2、74%N2),低氧组置于低氧培养箱(37℃、5%CO2、1%O2、94%N2)培养12、24、48 h。
1.3.2流式细胞术检测T、B淋巴细胞数量离心收集细胞沉淀,加入100 μL PBS重悬细胞,再加入2 μL抗小鼠CD3PE-cy7和CD19 APC抗体,同时设空白组、CD3 PE-cy7单标管和CD19 APC单标管。避光孵育15 min后,加入400 μL PBS重悬细胞。将染色完毕的细胞悬液转移至流式管,上机检测T、B淋巴细胞百分比。
1.3.3CFSE检测淋巴细胞增殖情况小鼠淋巴细胞提取完成后,加入CFSE(终浓度5 μmol/L)。37℃水浴15 min后,加入9×原体积的PBS,4℃、1 500 r/min离心5 min,弃上清。加入10 mL含10% FBS的RPMI 1640培养液,4℃、1 500 r/min离心10 min,洗涤2次。调整细胞含量为2.0×106个/mL,置于24孔板中,每孔加ConA(终质量浓度3 mg/L)培养12、24、48 h,流式细胞术检测淋巴细胞增殖率。
1.3.4Annexin V-FITC/PI双染检测淋巴细胞凋亡率通过FITC Annexin V凋亡检测试剂盒检测凋亡百分比。用PBS洗涤细胞,4℃、1 500 r/min离心5 min,弃上清液,再悬浮在100 μL的1×FITC Binding Buffer中。用5 μL FITC Annexin V和5 μL PI避 光 染 色15 min。然 后 加 入400 μL 1×FITC Binding Buffer,培养12、24、48 h,流式细胞术检测淋巴细胞凋亡率。
1.3.5扫描电镜(SEM)观察淋巴细胞形态离心收集细胞,加入2.5%戊二醛,并在4℃下固定24 h,随后用PBS清洗3次。将样品分别在30%、50%、70%、80%、90%和100%的乙醇中梯度脱水10 min,干燥至临界点。样品在双面导电胶带上铺展,粘贴在金属短柱上,在溅射镀膜装置中镀金2 min,然后在扫描电子显微镜下观察。
1.3.6qPCR检测Bak、bcl-2、caspase-3的mRNA表达离心收集细胞沉淀,加入1 mL TRIzol提取细胞总RNA,进行RNA浓度及纯度测定,并将RNA逆转录为cDNA。以β-actin为内参,用qPCR法检测淋巴细胞Bak、bcl-2、caspase-3的mRNA表达量。qPCR反应体系:2×SYBR®Premix Ex TaqTM10 μL,上、下游引物(均为10 μmol/L)各0.8 μL,cDNA 2 μL,ddH2O 6.4 μL。反应条件:95℃预变性30 s;95℃5 s,63℃60 s,循环50次。采用2-ΔΔCt法计算相关基因mRNA相对表达量。引物序列见表1。

Tab.1 Sequence of the primers in qPCR表1 qPCR引物序列
1.3.7Western blot检测Bak、bcl-2、caspase-3蛋白表达离心收集细胞,加入40~60 μL蛋白裂解液提取总蛋白,并用BCA法检测其浓度,调整蛋白上样量为30 μg/孔。使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)进行蛋白质分离,随后将其转移到NC膜上。在室温下5%的脱脂奶粉中封闭2 h,TBST清洗3遍,添加Bak(1∶300)、bcl-2(1∶500)、caspase-3(1∶500)、β-actin(1∶10 000)一抗,在4℃下孵育过夜。次日,TBST清洗膜,用二抗(1∶5 000)在室温下孵育1 h。最后使用增强化学发光(ECL)显色液对蛋白进行可视化,并用Image J分析软件进行分析。
1.4统计学方法采用SPSS 18.0软件进行数据分析,符合正态分布的计量资料采用均数±标准差(±s)表示。2组间比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 低氧处理对T、B淋巴细胞数量的影响 与常氧组比较,低氧组12、24、48 h时T、B淋巴细胞的百分比下降(P<0.05)。见表2。
2.2 低氧处理对小鼠淋巴细胞增殖的影响 与常氧组比较,12、24、48 h时低氧组淋巴细胞增殖率显著下降(P<0.01)。见图1、表3。
2.3 低氧处理对淋巴细胞凋亡的影响 与常氧组比较,12、24、48 h低氧组淋巴细胞凋亡率均显著增加(P<0.05),见表4、图2。
2.4 低氧处理对淋巴细胞形态的影响同一时间下低氧组较常氧组更早出现淋巴细胞凋亡形态学特征,见图3。12 h时,常氧组淋巴细胞形态正常,细胞膜完整,表面可见微绒毛;而低氧组淋巴细胞表面微绒毛消失。24 h时,低氧组较常氧组淋巴细胞体积增大,细胞破碎,胞浆外溢。48 h时,大量细胞出现晚期凋亡特征,常氧组淋巴细胞体积开始增大,细胞塌陷、胞浆外溢,呈火山口样结构;低氧组淋巴细胞见大小不等、呈杵状和球状的突起,细胞完全破碎。
2.5 低 氧 对 淋 巴 细 胞Bak、bcl-2、caspase-3的mRNA表达影响与常氧组相比,12、24、48 h时,低氧组淋巴细胞Bak和caspase-3的mRNA表达量上调,bcl-2的mRNA表达量下调(P<0.01),见表5。
2.6 低氧对淋巴细胞Bak、bcl-2、caspase-3的蛋白表达影响12、24、48 h时,低氧组较常氧组淋巴细胞Bak和caspase-3蛋白表达量升高,bcl-2蛋白表达量降低(P<0.05)。见表6、图4。
Tab.2 Comparison of the percentages of T and B lymphocytes at different time points between the two groups表2 2组不同时间T、B淋巴细胞百分比比较 (n=3,%,±s)
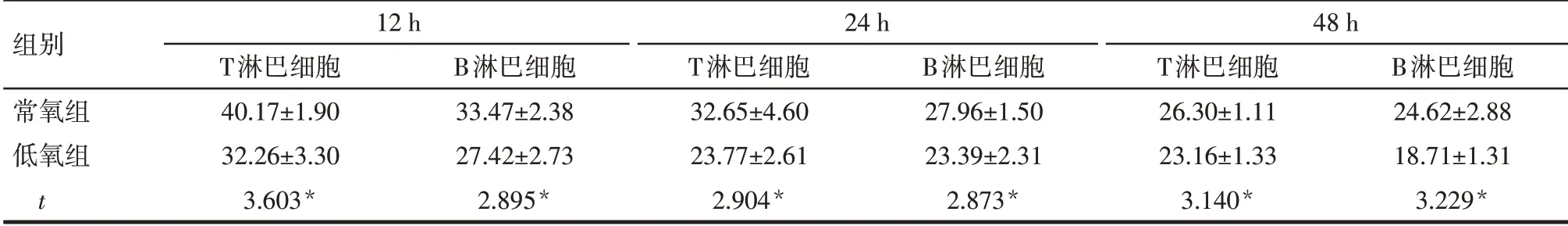
Tab.2 Comparison of the percentages of T and B lymphocytes at different time points between the two groups表2 2组不同时间T、B淋巴细胞百分比比较 (n=3,%,±s)
*P<0.05。
组别常氧组低氧组t 12 h T淋巴细胞40.17±1.90 32.26±3.30 3.603*B淋巴细胞33.47±2.38 27.42±2.73 2.895*24 h T淋巴细胞32.65±4.60 23.77±2.61 2.904*B淋巴细胞27.96±1.50 23.39±2.31 2.873*48 h T淋巴细胞26.30±1.11 23.16±1.33 3.140*B淋巴细胞24.62±2.88 18.71±1.31 3.229*

Fig.1 Effects of normoxia and hypoxia exposure on lymphocyte proliferation at different time points图1常氧和低氧暴露不同时间对淋巴细胞增殖的影响
Tab.3 Comparison of lymphocyte proliferation rates at different time points between two groups表3 2组不同时间淋巴细胞增殖率比较(n=3,%,±s)

Tab.3 Comparison of lymphocyte proliferation rates at different time points between two groups表3 2组不同时间淋巴细胞增殖率比较(n=3,%,±s)
**P<0.01。
组别常氧组低氧组t 12 h 31.56±1.63 27.31±2.05 4.749**24 h 38.50±0.31 34.74±0.82 11.324**48 h 43.32±1.35 40.66±0.49 5.566**
Tab.4 Comparison of apoptosis rate of lymphocyte at different time points between the two groups表4 2组不同时间淋巴细胞凋亡率比较(n=3,%,±s)

Tab.4 Comparison of apoptosis rate of lymphocyte at different time points between the two groups表4 2组不同时间淋巴细胞凋亡率比较(n=3,%,±s)
*P<0.05,**P<0.01。
组别常氧组低氧组t 12 h 17.05±1.33 22.28±1.13 5.446**24 h 30.66±3.11 36.34±1.64 3.172*48 h 82.01±1.66 86.99±1.42 6.033**
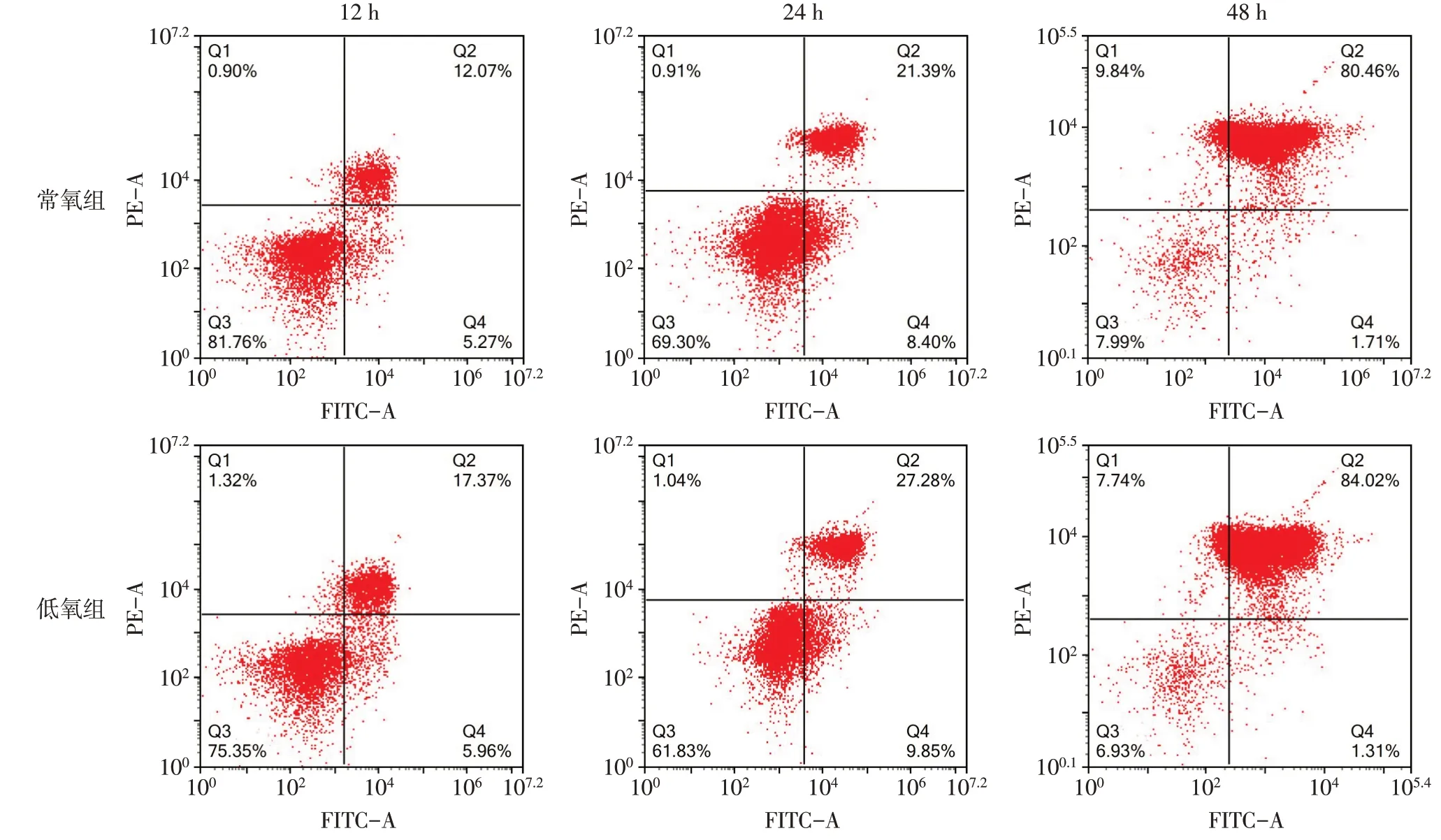
Fig.2 Effects of normoxia and hypoxia exposure on lymphocyte apoptosis at different time points图2常氧和低氧暴露不同时间对淋巴细胞凋亡的影响
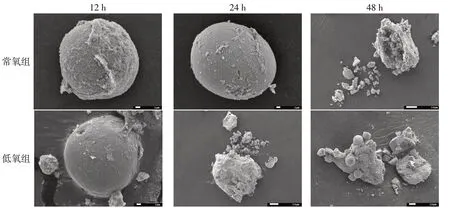
Fig.3 Lymphocyte morphological changes of hypoxia exposure at different time points observed by SEM图3 SEM观察低氧暴露不同时间淋巴细胞形态变化
3 讨论
低氧与免疫功能障碍关系密切。脾作为体内最大的免疫器官在维持免疫稳态中发挥重要作用。脾的淋巴细胞是产生免疫应答的主要部分,其数量变化与机体免疫功能密切相关[9]。因此,在本研究中选择脾淋巴细胞作为研究对象来判断低氧暴露后小鼠的免疫状态。
CD3+分子在所有成熟T淋巴细胞中表达,是T淋巴细胞表面的特异性标志物。CD19+是B淋巴细胞表面的特异性标志物。本研究通过PE-cy7 CD3+和APC CD19+荧光染料分别标记T、B淋巴细胞,发现低氧暴露下T、B淋巴细胞数量均减少。在低氧条件下,缺氧诱导因子(HIF)表达常升高。研究发现,HIF-1α可以促进滑膜成纤维细胞与B淋巴细胞之间相互作用,抑制调节性B淋巴细胞和初始B淋巴细胞生长,并诱导γ干扰素(IFN-γ)、白细胞介素(IL)-17炎性细胞因子和IgG自身抗体的产生,从而加重类风湿性关节炎患者的病情[10]。研究表明[11-12],低氧可抑制CD4+、CD8+T淋巴细胞的增殖,并降低活化T细胞总腺苷三磷酸产量以及IFN-γ、IL-3、IL-12和IL-18分泌。CD4+T淋巴细胞主要分化为Th细胞,Th细胞在免疫应答过程中起关键作用,影响免疫细胞的活化[13-14]。Th细胞活化后分化为Th1、Th2和Tfh效应细胞,其中Th2亚群通过分泌IL-4、IL-5、IL-6等细胞因子,Tfh细胞通过分泌IL-21促进B淋巴细胞的增殖和分化[15]。因此,推断低氧暴露下T淋巴细胞数量的减少可能影响调节B淋巴细胞生长的细胞因子分泌,进而导致B淋巴细胞减少。
Tab.5 Comparison of mRNA expression levels of Bak,bcl-2 and caspase-3 in lymphocytes at different time points between the two groups表5 2组低氧暴露不同时间淋巴细胞Bak、bcl-2、caspase-3 mRNA表达水平比较 (n=3,±s)
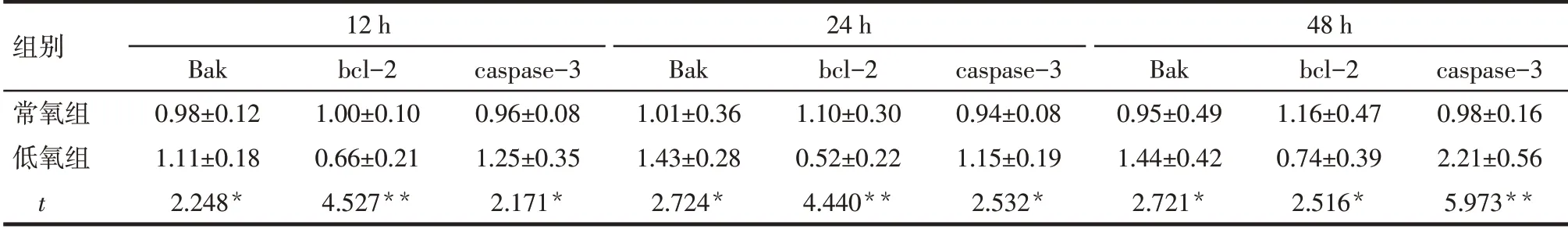
Tab.5 Comparison of mRNA expression levels of Bak,bcl-2 and caspase-3 in lymphocytes at different time points between the two groups表5 2组低氧暴露不同时间淋巴细胞Bak、bcl-2、caspase-3 mRNA表达水平比较 (n=3,±s)
*P<0.05,**P<0.01。
组别常氧组低氧组t 12 h Bak 0.98±0.12 1.11±0.18 2.248*bcl-2 1.00±0.10 0.66±0.21 4.527**caspase-3 0.96±0.08 1.25±0.35 2.171*24 h Bak 1.01±0.36 1.43±0.28 2.724*bcl-2 1.10±0.30 0.52±0.22 4.440**caspase-3 0.94±0.08 1.15±0.19 2.532*48 h Bak 0.95±0.49 1.44±0.42 2.721*bcl-2 1.16±0.47 0.74±0.39 2.516*caspase-3 0.98±0.16 2.21±0.56 5.973**
Tab.6 Comparison of Bak,bcl-2 and caspase-3 protein expression levels in lymphocytes at different time pointsbetween the two groups of mice表6 2组低氧暴露不同时间淋巴细胞Bak、bcl-2、caspase-3蛋白表达水平比较 (n=3,±s)
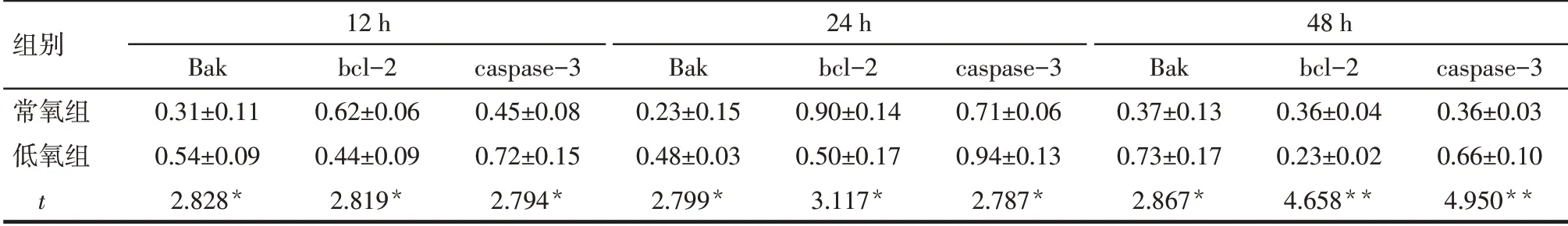
Tab.6 Comparison of Bak,bcl-2 and caspase-3 protein expression levels in lymphocytes at different time pointsbetween the two groups of mice表6 2组低氧暴露不同时间淋巴细胞Bak、bcl-2、caspase-3蛋白表达水平比较 (n=3,±s)
*P<0.05,**P<0.01。
组别常氧组低氧组t 12 h Bak 0.31±0.11 0.54±0.09 2.828*bcl-2 0.62±0.06 0.44±0.09 2.819*caspase-3 0.45±0.08 0.72±0.15 2.794*24 h Bak 0.23±0.15 0.48±0.03 2.799*bcl-2 0.90±0.14 0.50±0.17 3.117*caspase-3 0.71±0.06 0.94±0.13 2.787*48 h Bak 0.37±0.13 0.73±0.17 2.867*bcl-2 0.36±0.04 0.23±0.02 4.658**caspase-3 0.36±0.03 0.66±0.10 4.950**
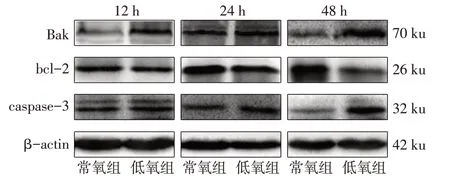
Fig.4 Protein expression levels of Bak,bcl-2 and caspase-3 in lymphocytes at different time points between the two groups of mice图4低氧暴露不同时间淋巴细胞Bak、bcl-2、caspase-3的蛋白表达水平
淋巴细胞增殖和凋亡可影响CD4+T/CD8+T淋巴细胞的比例[8]、T淋巴细胞和B淋巴细胞的数量及免疫系统功能[16-17]。为进一步探究低氧暴露下淋巴细胞数量减少的原因,本研究通过流式细胞术检测低氧暴露对淋巴细胞增殖和凋亡的影响,发现在ConA刺激下,低氧暴露对淋巴细胞增殖有抑制作用。淋巴细胞增殖是免疫应答的重要因素,增殖减少可导致细胞损伤修复、细胞周期调节和染色体重组等功能发生改变[18-19]。此外,细胞凋亡也是引起细胞损伤的重要因素,低氧在促进淋巴细胞凋亡中起关键作用。研究发现,HIF通过抑制过渡性B细胞,来增加生发中心B淋巴细胞的糖酵解速率,从而减少细胞增殖、促进凋亡并调节抗体产生[20]。Shan等[21]将HIF-1α转染至巨噬细胞后与淋巴细胞共培养,可以抑制T淋巴细胞增殖,促进细胞凋亡。本研究通过评估淋巴细胞凋亡率,发现低氧能明显诱导淋巴细胞凋亡,提示淋巴细胞增殖减少或凋亡增加可能是低氧暴露诱导T、B淋巴细胞减少的重要原因。
为进一步明确低氧引起淋巴细胞数量改变的主要原因,本研究通过SEM观察淋巴细胞形态。结果显示,淋巴细胞随着时间的推移出现凋亡特征形态学改变,且在同一时间下低氧组较常氧组更早出现凋亡特征形态学变化,提示低氧可能主要通过诱导淋巴细胞凋亡而使其数量减少。细胞凋亡由多个基因和通路协调。bcl-2家族在细胞凋亡中起至关重要的作用,主要分布在核膜、线粒体膜和内质网膜上,以维持细胞器膜的完整性[22]。bcl-2家族主要分为抗凋亡基因(bcl-2、bcl-xl等)和促凋亡基因(Bax、Bak等)[23]。这2组蛋白表达失衡可导致线粒体损伤,释放促凋亡因子并激活下游caspases家族,引起细胞凋亡[24]。caspase-3的激活通常被认为是细胞凋亡进入不可逆阶段的标志[25]。研究发现,低氧通过下调bcl-2诱导心肌细胞凋亡[26]。Zhao等[27]发现,低氧暴露促进人类子宫囊性韧带成纤维细胞凋亡,凋亡相关因子caspases、Bax/bcl-2显著上调。本研究中低氧暴露不同时间下淋巴细胞抗凋亡基因bcl-2的mRNA和蛋白表达量显著下调;促凋亡基因Bak和caspase-3的mRNA和蛋白表达量显著上调,与上述研究结果一致。
综上,低氧暴露可降低小鼠脾T淋巴细胞和B淋巴细胞数量,抑制淋巴细胞增殖,促进淋巴细胞凋亡,并进一步加快淋巴细胞出现凋亡特征形态学改变,同时诱导凋亡相关因子在转录和蛋白水平发生显著差异。后续将进一步探讨低氧暴露诱导淋巴细胞凋亡的具体机制及相关通路,为揭示低氧引起免疫功能障碍的机制提供新的实验依据。

