内毒素血症通过下调HNF4α表达加剧肝损伤
唐永静,陈云芬,廖月,程其娇,张桂娟,王云,何毅怀△
重症肝病在我国较为常见,其病死率高,预后差[1]。大范围肝细胞的急性损伤(如细胞凋亡)是引起肝损伤进展的机制之一[2]。肝损伤进展受多种因素影响,包括合并细菌感染、高载量乙肝病毒感染等。有研究表明,内毒素血症与肝损伤进展关系密切,脂多糖(lipopolysaccharide,LPS)作为内毒素的主要成分,在内毒素血症中起着重要作用[3]。LPS与D-氨基半乳糖联合,常被用于建立实验性肝衰竭小鼠模型。本课题组前期预实验发现,LPS引起肝损伤的使用剂量尚无统一标准,正常状态下大量LPS才能引起肝损伤,但是在肝损伤的基础上,非肝毒性剂量LPS将加剧肝损伤。这一发现与文献[4-5]报道相一致,提示肝脏的基础疾病可能增加肝脏对内毒素血症的敏感性,肝脏损伤程度越重,其对内毒素血症的损伤作用反应越敏感,但具体机制不详。肝细胞核因子4α(hepatocyte nuclear factor 4 alpha,HNF4α)作为肝细胞富集的重要转录因子,与肝细胞的抗损伤反应密切相关[6]。有研究发现,LPS可显著下调大鼠肝脏中HNF4α的表达[7];而在肝癌中条件性上调HNF4α表达可抑制LPS诱导的细胞凋亡[8],提示HNF4α表达水平可在一定程度上反映肝脏对内毒素血症的敏感性。本研究旨在探索内毒素血症中HNF4α表达的变化特点、对肝细胞凋亡的作用及在肝损伤中的意义。
1 材料与方法
1.1材料
1.1.1实验动物SPF级雄性BALB/c小鼠144只,6~8周龄,平均体质量(25±4)g,购自遵义医科大学动物实验中心[动物生产许可证号:SYXK(黔)2021-0004]。将所有动物置于温度(21.0±2.0)℃,湿度65%±5%条件下自由进食饮水,并保持12 h/12 h昼夜循环光照。实验小鼠的使用遵循《实验动物管理条例》[9]及遵义医科大学实验动物管理规定[伦审(2020)2-321号]。
1.1.2主要设备和试剂全自动曝光机(Clinx,ChemiScope 6000,中国),全自动生化分析仪(Beckman Coulter autoanalyzer,AU5800,美国)。裂解液(R0010,Solarbio,北京);鼠单 克 隆β-actin内 参 蛋 白(sc-58673,Santa Cruz Biotechnology)、鼠 单 克 隆HNF4α(ab41898,Abcam,Cambridge,MA,USA)、兔单克隆胱天蛋 白酶3剪切体(Cleaved caspase-3,9664,CST)。辣根过氧化物酶(HRP)标记的抗小鼠IgG二抗(sc-516102,Santa Cruz,USA)或抗兔IgG二抗(sc-2357,Santa Cruz)。
1.2动物分组和建模方法小鼠适应性喂养1周后,采用随机数字表法将小鼠分组。每组诱导12只小鼠,均给药1次,注射前禁饮禁食6 h。诱导时间为24 h。
1.2.1CCl4诱导小鼠急性肝损伤CCl4组:分别腹腔注射0.5、1.0、2.0 mL/kg CCl4(按CCl4折算;CCl4与橄榄油按体积比为1∶4混合,0.22 μm滤菌器滤菌,4~8℃保存)。对照组:腹腔注射等体积橄榄油(0.22 μm滤菌器滤菌,4~8℃保存)。
1.2.2LPS诱导小鼠急性肝损伤LPS组:分别腹腔注射LPS,剂量为非肝毒性剂量(0.1 mg/kg、0.5 mg/kg)、肝毒性剂量(2.5 mg/kg,10 mg LPS溶于50 mL的PBS中;0.22 μm滤菌器滤菌,-20℃冰箱保存)。对照组:腹腔注射等体积
PBS。
1.2.3LPS干预CCl4诱导急性肝损伤模型小鼠CCl4组:腹腔注射1.0 mL/kg CCl4;LPS+CCl4组:分别腹腔注射0.1 mg/kg、0.5 mg/kg LPS预处理2 h,均给药1次;然后腹腔注射1.0 mL/kg CCl4。对照组:腹腔注射等体积橄榄油或PBS。
1.2.4标本收集与处理建模24 h后将小鼠置于有4 L CO2的安乐死盒中,待其失去知觉后,维持血液循环的同时收集血液和肝组织样本。将收集到的血液标本3 000 r/min离心15 min,吸取上清液,置于4℃冰箱过夜。取50 mg肝组织置于裂解液进行细胞裂解,置于-80℃冰箱保存;1 cm3大小的肝组织样本置于4%多聚甲醛中固定24 h,随后切成5 μm厚的组织切片,置于切片盒室温保存。
1.3指标检测与方法
1.3.1肝功能的检测采用全自动生化分析仪检测血清丙氨酸转氨酶(ALT,速率法)及血清总胆红素(TBil,重氮法)水平。
1.3.2蛋白免疫印迹(Western blot)法检测HNF4α、Cleaved caspase-3蛋白的表达将各组小鼠50 mg肝组织加入5 mL裂解缓冲液[含50 μL苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)],4℃下进行细胞裂解,BCA蛋白浓度测定试剂盒检测总蛋白量。样本经10%SDS-聚丙烯酰胺凝胶电泳(100 V恒压)分离,然后按照凝胶面积以0.65 mA/cm2恒流电转移1.5 h将蛋白自凝胶转印至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜。PVDF膜经5%脱脂奶粉室温封闭2 h后,加入1∶1 000稀释的β-actin、HNF4α、Cleaved caspase-3一抗,4℃孵育过夜,TBST漂洗后用1∶2 000稀释的HRP抗小鼠IgG二抗或抗兔IgG二抗孵育2 h,漂洗后滴加ECL化学发光试剂于全自动曝光机中显影,利用Image J软件分析条带灰度值,计算HNF4α、Cleaved caspase-3蛋白与β-actin的比值。实验重复3次。
1.3.3原位末端标记法检测细胞凋亡情况各实验组小鼠肝组织石蜡切片分别经过脱蜡、脱水、去除组织蛋白、破膜后,取脱氧核糖核苷酸末端转移酶(TdT)与脱氧核糖核苷酸衍生物地高辛按体积比1∶14混合,滴到肝组织上,保持湿盒内湿度,37℃孵育2 h。紫外激发波长330~380 nm,发射波长420 nm;FITC绿光激发波长465~495 nm,发射波长515~555 nm;CY3红光激发波长510~560 nm,发射波长590 nm。细胞核在DAPI染色后在紫外线下呈蓝色,FITC荧光素标记的阳性凋亡细胞核呈绿色。切片通过全息扫描(Pannoramic DESK/MIDI/250/1000,3DHISTECH,Hungary)及CaseViewer 2.3软件(3DHISTECH,Hungary)采集图像。每张切片高倍镜下随机读取5个视野,计算细胞凋亡指数(apoptotic index,AI)=阳性细胞数/总细胞数×100%。实验重复3次。
1.4统计学方法采用SPSS 18.0软件进行数据处理。计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,若方差齐组间多重比较行LSD-t检验;若方差不齐组间多重比较行Tamhane′s T2检验。P<0.05为差异有统计学意义。
2 结果
2.1 CCl4对小鼠肝损伤及细胞凋亡的影响0.5、1.0、2.0 mL/kg CCl4组小鼠的血清ALT、TBil水平及肝组织HNF4α、Cleaved caspase-3蛋白表达水平均明显高于对照组,且均呈剂量依赖性增高(均P<0.05),见表1、图1。
Tab.1 Comparison of serum ALT and TBil levels,and protein expression levels of HNF4α and Cleaved caspase-3 in liver tissue between the four groups of mice induced by different doses of CCl4表1不同剂量CCl4诱导组血清ALT、TBil水平及肝组织HNF4α、Cleaved caspase-3蛋白表达水平比较(±s)

Tab.1 Comparison of serum ALT and TBil levels,and protein expression levels of HNF4α and Cleaved caspase-3 in liver tissue between the four groups of mice induced by different doses of CCl4表1不同剂量CCl4诱导组血清ALT、TBil水平及肝组织HNF4α、Cleaved caspase-3蛋白表达水平比较(±s)
**P<0.01;a与对照组比较,b与0.5 mL/kg CCl4组比较,c与1.0 mL/kg CCl4组比较,P<0.05。
组别对照组0.5 mL/kg CCl4组1.0 mL/kg CCl4组2.0 mL/kg CCl4组F n 12 12 12 12 ALT(U/L)42.08±5.53 2 496.25±202.35a 4 458.00±506.94ab 6 502.08±599.06abc 493.724**TBil(μmol/L)1.28±0.15 1.93±0.17a 4.45±0.27ab 6.35±0.69abc 404.139**组别对照组0.5 mL/kg CCl4组1.0 mL/kg CCl4组2.0 mL/kg CCl4组F HNF4α 1.00±0.00 1.95±0.05a 6.46±0.25ab 11.48±0.43abc 4 020.010**Cleaved caspase-3 1.00±0.00 1.71±0.11a 5.55±0.21ab 8.48±0.16abc 6 745.702**

Fig.1 Western blot detection of HNF4α and Cleaved caspase-3 protein expression in liver tissue induced by different doses of CCl4图1 Western blot检测不同剂量CCl4诱导组肝组织HNF4α、Cleaved caspase-3蛋白表达
2.2 LPS对小鼠肝损伤及细胞凋亡的影响2.5 mg/kg LPS组小鼠血清ALT、TBil水平及肝组织Cleaved caspase-3蛋白表达水平高于对照组、0.1 mg/kg LPS组、0.5 mg/kg LPS组,肝组织HNF4α蛋白表达水平低于对照组、0.1 mg/kg LPS组、0.5 mg/kg LPS组(P<0.05);对照组、0.1 mg/kg LPS组、0.5 mg/kg LPS组间差异均无统计学意义,见表2、图2。
Tab.2 Comparison of serum ALT and TBil levels,and protein expression levels of HNF4α and Cleaved caspase-3 in liver tissue between the four groups of mice induced by different doses of LPS表2不同剂量LPS组血清ALT、TBil水平及肝组织HNF4α、Cleaved caspase-3蛋白表达水平比较(±s)

Tab.2 Comparison of serum ALT and TBil levels,and protein expression levels of HNF4α and Cleaved caspase-3 in liver tissue between the four groups of mice induced by different doses of LPS表2不同剂量LPS组血清ALT、TBil水平及肝组织HNF4α、Cleaved caspase-3蛋白表达水平比较(±s)
**P<0.01;a与对照组比较,b与0.1 mg/kg LPS组比较,c与0.5 mg/kg LPS组比较,P<0.05。
组别对照组0.1 mg/kg LPS组0.5 mg/kg LPS组2.5 mg/kg LPS组F HNF4α 1.00±0.00 0.94±0.10 0.86±0.07 0.47±0.03abc 156.332**Cleaved caspase-3 1.00±0.00 1.06±0.10 2.44±0.14 7.40±0.16abc 7 022.815**组别对照组0.1 mg/kg LPS组0.5 mg/kg LPS组2.5 mg/kg LPS组F n 12 12 12 12 ALT(U/L)32.92±5.89 37.67±9.12 53.33±8.51 5 725.50±109.62abc 29 112.963**TBil(μmol/L)1.18±0.29 1.48±0.21 1.50±0.21 5.44±0.22abc 836.544**
2.3 LPS及CCl4对小鼠肝损伤及肝细胞凋亡的影响CCl4组、0.1 mg/kg LPS+CCl4组和0.5 mg/kg LPS+CCl4组小鼠血清ALT、TBil水平,肝组织HNF4α、Cleaved caspase-3蛋白表达水平及肝细胞凋亡指数均高于对照组(P<0.05)。0.1 mg/kg LPS+CCl4组和0.5 mg/kg LPS+CCl4组小鼠血清ALT、TBil水平,肝组织Cleaved caspase-3蛋白表达水平及肝细胞凋亡指数均高于CCl4组,HNF4α蛋白表达水平低于CCl4组(P<0.05);0.5 mg/kg LPS+CCl4组与0.1 mg/kg LPS+CCl4组间差异无统计学意义,见表3,图3、4。
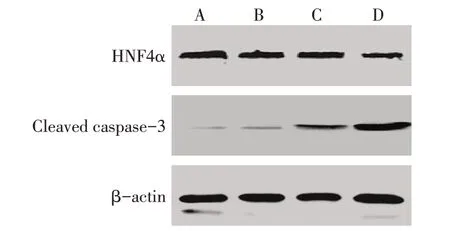
Fig.2 Western blot detection of HNF4α and Cleaved caspase-3 protein expression in liver tissue induced by different doses of LPS图2 Western blot检测不同剂量LPS诱导组肝组织HNF4α、Cleaved caspase-3蛋白表达
Tab.3 Comparison of serum ALT and TBil levels,protein expression levels of HNF4α and Cleaved caspase-3 in liver tissue and apoptotic index between the four groups表3各组血清ALT、TBil水平,肝组织HNF4α、Cleaved caspase-3蛋白表达水平及肝细胞凋亡指数比较(±s)

Tab.3 Comparison of serum ALT and TBil levels,protein expression levels of HNF4α and Cleaved caspase-3 in liver tissue and apoptotic index between the four groups表3各组血清ALT、TBil水平,肝组织HNF4α、Cleaved caspase-3蛋白表达水平及肝细胞凋亡指数比较(±s)
**P<0.01;a与对照组比较,b与CCl4组比较,P<0.05。
组别对照组CCl4组0.1 mg/kg LPS+CCl4组0.5 mg/kg LPS+CCl4组F n 12 12 12 12 ALT(U/L)34.75±2.24 3 412.08±122.68a 5 683.00±177.65ab 6 269.92±98.71ab 6 236.269**TBil(μmol/L)1.26±0.26 3.38±0.29a 5.40±0.20ab 6.28±0.16ab 1 011.176**组别对照组CCl4组0.1 mg/kg LPS+CCl4组0.5 mg/kg LPS+CCl4组F HNF4α 1.00±0.00 3.41±0.26a 2.45±0.14ab 1.55±0.08ab 513.070**Cleaved caspase-3 1.00±0.00 2.29±0.15a 2.78±0.23ab 3.23±0.31ab 238.550**凋亡指数0.52±0.11 27.58±0.83a 31.93±0.73ab 36.71±0.82ab 6 101.197**

Fig.3 Western blot detection of HNF4α and Cleaved caspase-3protein levels in liver tissue of mice图3 Western blot检测各组小鼠肝脏HNF4α、Cleaved caspase-3蛋白表达水平

Fig.4 TUNEL detection of hepatocyte apoptosis of mice in each group(×20)图4原位末端标记染色检测各组小鼠肝细胞凋亡情况(×20)
3 讨论
肝脏损伤与代谢紊乱、饮酒、肝炎病毒感染等多种因素有关,如合并细菌感染会显著加重肝脏损伤,但其具体机制尚未明确[10-11]。本课题组前期研究发现,蛋白激酶R样内质网激酶(PERK)-磷酸化真核翻译起始因子2α(eIF2α)信号通路可通过抗肝细胞凋亡减轻小鼠肝损伤[2],与文献[12-13]报道一致。有研究表明,肝损伤时,将触发内质网(ER)应激,激活PERK、活化转录因子6(ATF6)和需肌醇酶1α(IRE1α)以阻碍蛋白质合成,减轻肝脏负荷,促进细胞存活[14]。一旦ER稳态受到破坏,ER应激将触发促凋亡信号,凋亡的激活受多种信号通路共同影响。目前主要有3条凋亡途径:C/EBP同源蛋白(CHOP)基因的激活转录、Jun-氨基末端激酶(JNK)的激活通路及内质网特有的caspase-3激活等[15]。有研究表明,HNF4α表达短暂性下调对急性肝损伤可能有益,可以重新分配转录资源;但持续存在的刺激将促使HNF4α表达持续下调,其下调程度与肝损伤程度密切相关[16]。本研究结果显示,与对照组相比,CCl4及LPS均可加重小鼠肝损伤及肝细胞凋亡,肝毒性剂量LPS组肝损伤程度更为显著,且可下调HNF4α蛋白表达;而CCl4组肝组织HNF4α蛋白表达上调,提示HNF4α在不同原因引起的肝损伤中存在多种表达模式。有研究表明,肝脏因其解剖位置易成为细菌诱导损伤和产生炎症的主要受累器官;累积的LPS可参与肝细胞直接损伤或通过促进炎症反应加重肝损伤[17]。大量LPS可以参与肝细胞损伤并诱导其凋亡,血清LPS水平与肝细胞凋亡呈正相关[18]。肝损伤合并细菌感染及内毒素血症均可导致肝损伤程度加重[19-20]。本研究结果显示,非肝毒性剂量LPS诱导组小鼠血清ALT、TBiL及肝组织HNF4α、Cleaved caspase-3蛋白表达无明显差异,均未引起肝损伤;肝毒性剂量LPS诱导组小鼠血清ALT、TBiL及Cleaved caspase-3蛋白表达显著增加,HNF4α蛋白表达下调,与相关研究结果一致[21],提示肝细胞凋亡与肝脏损害程度相关,但HNF4α对肝细胞凋亡及肝损害的作用及机制尚未确定。
本研究通过CCl4联合非肝毒性剂量的LPS模拟肝损伤合并内毒素血症实验模型,发现0.1 mg/kg LPS+CCl4组和0.5 mg/kg LPS+CCl4组小鼠血清ALT、TBil水平,肝组织Cleaved caspase-3蛋白表达水平及肝细胞凋亡指数均高于对照组和CCl4组,HNF4α蛋白表达水平低于对照组和CCl4组。由此进一步说明,在肝损伤的基础上非肝毒性剂量的LPS也能够通过抑制HNF4α表达,增加肝细胞对凋亡的敏感性来加剧肝损害。
综上所述,内毒素血症对肝损伤的影响除与内毒素水平有关外,还与肝细胞的基础状态及损伤后HNF4α的反应性上调水平有关。HNF4α可能通过调控肝细胞凋亡影响肝损伤进展过程,HNF4α在不同肝损伤模型中存在多种调节模式。但在肝损伤中差异调控HNF4α的机制,及HNF4α在肝细胞凋亡和肝损伤中的具体作用机制尚待进一步研究。

