吡非尼酮通过miRNA-425-5p调控TGF-β/Smad通路对大鼠心肌纤维化的影响
邹琳,张昕,李丽
心力衰竭(heart failure,HF)标志着心脏疾病发展到终末阶段,其临床特征为不同程度的呼吸困难、体力活动受限、体液潴留。心肌纤维化是正常心肌组织受损后被纤维化组织替代,丧失心肌正常结构、功能的病理性进程,是独立于射血分数之外的心力衰竭患者死亡的重要因素之一。转化生长因子β(TGF-β)是在心肌纤维化的进展中起主导作用的关键因子,可通过启动多条信号通路推动心肌纤维化进程,其中TGF-β/Smad通路是启动心肌纤维化的关键通路。微小RNA(microRNA,miRNA)是一类长度为15~25个核苷酸的短链非编码RNA,多条miRNA被证实与心肌纤维化进程有关[1]。miRNA-425-5p可以通过抑制TGF-β/Smad通路改善心肌纤维化水平,对治疗心肌梗死后心肌纤维化具有重要的研究及临床意义[2]。吡非尼酮是一类小分子抗纤维化药物,在临床上广泛应用于特发性肺纤维化的治疗,其作用机制与抗炎、抑制TGF-β/Smad信号通路有关[3]。现阶段吡非尼酮尚未应用于心肌纤维化的治疗。本研究拟采用开胸结扎冠状动脉左前降支建立心肌梗死大鼠模型,并通过体外培养心肌成纤维细胞,观察吡非尼酮能否通过上调miRNA-425-5p抑制TGF-β/Smad信号通路来减轻心肌纤维化程度,从而改善心肌梗死大鼠心脏功能。
1 材料与方法
1.1实验动物60只SPF级58~60日龄雄性SD大鼠,体质量(300±20)g,购自内蒙古大学实验动物研究中心,动物生产许可证号:SCXK(蒙)2016-0001。适应性喂养1周后开始实验,期间自由摄食、饮水。20只SPF级1~3日龄SD乳鼠,购自北京维通利华实验动物技术有限公司,动物生产许可证号:SCXK(京)2012-0001。
1.2主要试剂与仪器吡非尼酮胶囊(艾思瑞,北京康蒂尼药业有限公司);吡非尼酮(北京谱析科技有限公司;货号53179-13-8);水合氯醛、白细胞介素6(IL-6,批号CKE30219)、Ⅰ型胶原α2(COL1α2,批号CK-E31131)、Ⅲ型胶原纤维α1(COL3α1,批号CK-E37320)试剂盒均购自上海机纯实业有限公司;BCA蛋白定量试剂盒(Thermo,PICPI23223);RIPA组织细胞快速裂解液(北京索莱宝科技有限公司,R0020);蛋白预染Marker(Fermentas,SM1811);TGF-β1(批号Ab215715)、GAPDH(批号Ab9485)兔单克隆抗体购自英国Abcam公司;Smad2(批号#5339)、Smad3(批号#9523)兔单克隆抗体购自美国CST公司;山羊抗兔IgG(H+L)HRP购自美国Thermo公司(货号31460);Lipofectamine 2000试剂(Thermo);miRNA-425-5p mimic及实时荧光定量PCR(qPCR)引物由上海信帆生物科技有限公司合成;SYBR Green PCR试 剂 盒(Thermo,#K0223);逆 转 录 试 剂 盒(Fermentas,#K1622);Trizol(invitrogen,1596-026)。mini protean 3 cell型电泳仪(美国BIO-RAD公司),TE77XP型电转仪(美国HOEFER公司),MK3型酶标仪(美国Thermo Fisher Scientific公司),Vivid E9型心动超声仪器(美国GE公司),Real-time检测仪(美国ABI公司),TG-16M型低温冷冻离心机(上海卢湘仪离心机仪器有限公司)。
1.3方法
1.3.1动物分组、造模及给药60只SD大鼠,按随机数字表法抽取10只作为假手术组(只穿线不结扎),其余50只造模。大鼠术前禁食水12 h,腹腔内注射10%水合氯醛(注射剂量0.4 g/kg)。麻醉后固定于手术台上,连接心电图仪器,备皮、消毒、经喉气管插管,连接小动物呼吸机,调整呼吸机数值。依据参考文献[4]方法并改进建立大鼠心肌梗死模型。术后大鼠腹腔注射青霉素5万U/d,连续注射3 d预防感染。造模后假手术组全部存活,其余50只造模后存活35只,15只均于结扎后24 h内死亡。各组大鼠于术后给与正常饮食,成模大鼠按随机数字表法分为模型组17只和吡非尼酮组18只。造模4 d后吡非尼酮组给予0.3 g/kg灌胃给药,每日1次,其余2组给予等量超纯水灌胃,连续4周。
1.3.2大鼠心脏多普勒超声检测大鼠在末次给药12 h后进行10%水合氯醛0.4 g/kg腹腔注射麻醉。麻醉后固定、备皮,采用心脏多普勒超声检测大鼠左心室收缩期末径(LVESd)、左心室舒张期末径(LVEDd)、左心室射血分数(LVEF)、左心室短轴缩短率(FS)。每只大鼠测8个心动周期,取平均值。操作及分析由专科医生完成。
1.3.3酶联免疫吸附试验(ELISA)检测IL-6、COL1α2、COL3α1水平处死动物当天取大鼠腹主动脉血,置于抗凝管中摇匀,3 000 r/min离心20 min,收集上清液。采用ELISA法按照试剂盒说明书进行操作,检测大鼠血浆中IL-6、COL1α2、COL3α1水平。每组取10个样本进行实验。
1.3.4大鼠心肌组织处理处死大鼠,剪下心脏,生理盐水灌洗心腔,洗净心腔内残余血液,将结扎处以下心室壁从心底到心尖切为3等份,分别用于Masson染色、Western blot和qPCR。将第一部分置于4%多聚甲醛中固定,剩余部分置于-80℃冰箱冻存。
1.3.5Masson染色洗掉心肌组织甲醛,梯度乙醇浸泡脱水,二甲苯透明,浸蜡,切片。取覆盖整个梗死部位的石蜡切片,Masson染色,观察胶原纤维及肌纤维的形态及分布。使用Image-Pro Plus 6.0分析各组心肌胶原容积分数(CVF)。CVF=胶原面积/视野总面积×100%。每组取10个样本进行实验。
1.3.6Western blot法检测心肌组织中TGF-β1、Smad2、Smad3蛋白表达取-80℃保存的心肌组织,置于冰上研磨,加入裂解液。裂解后的样品4℃、12 000×g离心15 min,取上清液进行BCA蛋白定量。加入适量上样缓冲液,沸水浴10min后离心取等量蛋白上样。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,PVDF转膜;5%脱脂奶粉室温封闭1 h,分别加入TGF-β1、Smad2、Smad3一抗(稀释倍数均1∶1 000)室温孵育2 h;随后加入HRP标记的二抗(1∶1 000稀释),与膜37℃孵育1 h;条带用发光液发光,照片用Gel-Pro Analyzer 4.0软件分析。每组取4个样本进行实验。
1.3.7qPCR检测心肌组织中TGF-β1和miRNA-425-5p表达取适量大鼠心肌组织,提取组织总RNA,反转录成cDNA。按照试剂盒说明书进行实验,配制PCR反应液,总体系为25 μL,PCR反应条件为95℃30 s;95℃5 s,60℃30 s,共40个循环。引物序列见表1。目的基因的相对表达水平用2-ΔΔCt表示。每组取3个样本进行实验。
肉眼观察牙根数目,上颌第一前磨牙单根型为42.95%,双根型为57.05%(P>0.05);而下颌第一磨牙单根型(94.67%)显著高于双根型(5.33%)(P<0.05)(表2)。
1.3.8心肌成纤维细胞分离、培养与分组1~3日龄SD乳鼠消毒、开胸取心脏,去除心房、大血管等组织,将组织消化,收集细胞悬液种植于培养瓶中,37℃、5%CO2培养箱中差速贴壁法去除心肌细胞。原代培养得到的非心肌细胞加入DMEM培养液,传代培养2~3代。取对数生长期细胞,按照2×105个/孔标准接种于培养板上。分为对照组、miRNA-425-5p mimic组和吡非尼酮组,进行药物干预。
1.3.9细胞转染及药物干预对照组不做处理。miRNA-425-5p mimic组按照Lipofectamine 2000说明书,于细胞融合80%左右时,将miRNA-425-5p mimic转染至心肌成纤维细胞。吡非尼酮组加入吡非尼酮,使其终浓度为1.5 g/L。各组细胞培养6 h后更换培养基,继续培养24 h后进行后续实验。
1.3.10qPCR检测各组细胞中miRNA-425-5p与TGF-β1mRNA表达用胰酶将各组细胞消化制成单细胞悬液,细胞计数,稀释为1×106个/mL。引物序列见表1,其余步骤参考1.3.7。每个样本重复3次。
1.4统计学方法采用SPSS 26.0统软件进行数据分析;计量资料以均数±标准差(±s)表示;多组间比较采用单因素方差分析,组间多重比较采用LSD-t法,2组间比较采用t检验;以P<0.05为差异有统计学意义。

Tab.1 Sequences of the primers表1引物序列
2 结果
2.1 3组大鼠心功能对比与假手术组相比,模型组大鼠LVEDd、LVESd显著增大,LVEF、FS显著降低(P<0.05),吡非尼酮组与模型组相比大鼠心脏LVEDd、LVESd缩小,LVEF、FS显著升高(P<0.05)。见图1、表2。
2.2 3组大鼠心肌纤维化程度大鼠心肌经Masson染色,心肌组织与胞质呈红色,胶原纤维呈蓝色。假手术组心肌组织间有极少量胶原纤维,模型组心肌组织间可见明显的胶原纤维沉积,吡非尼酮组纤维化程度较模型组明显减轻。模型组大鼠CVF为4.12%±0.66%,与假手术组的17.98%±0.88%相比,心肌纤维化程度明显增加。吡非尼酮组CVF为10.35%±0.82%,与模型组相比心肌纤维化程度减轻(n=10,F=770.880,P<0.01)。见图2。
2.3 3组大鼠血浆中IL-6、COL1α2、COL3α1水平比较与假手术组相比,模型组大鼠血浆中IL-6、COL1α2、COL3α1水平明显增高(P<0.05);与模型组相比较,吡非尼酮组大鼠血浆中IL-6、COL1α2、COL3α1水平明显降低(P<0.05)。见表3。

Fig.1 Results of cardiac color ultrasound in three groups of rats图1 3组大鼠心脏彩超结果
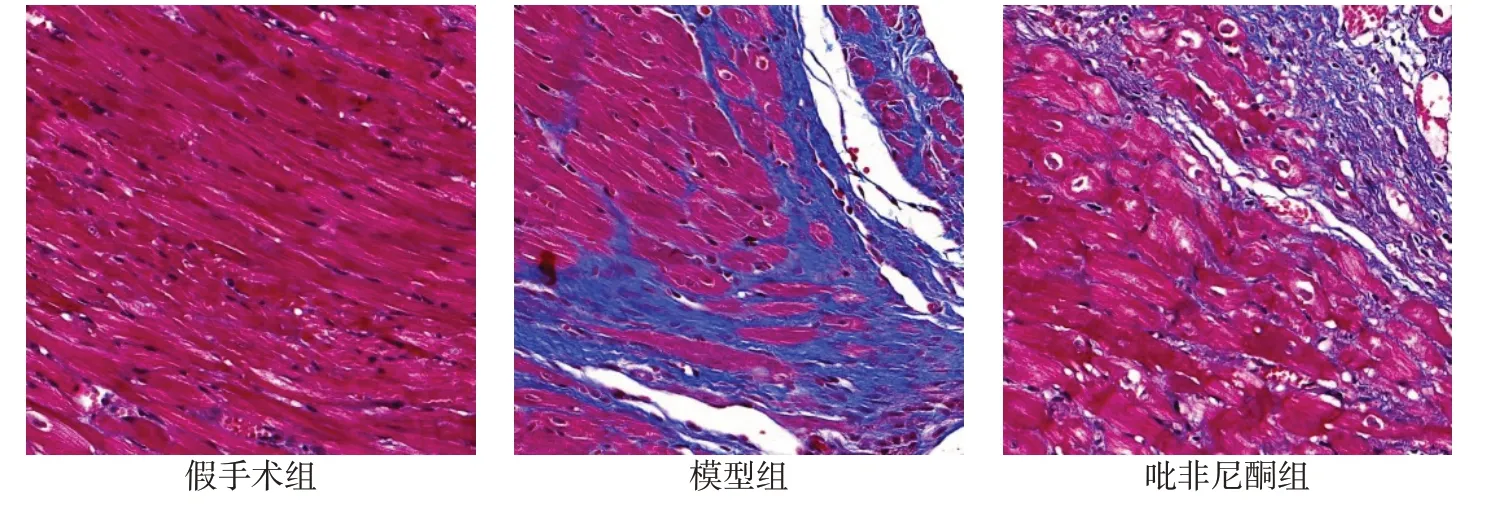
Fig.2 Heart histopathological changes in the three groups of rats(Masson,×100)图2 3组大鼠心脏组织病理学变化(Masson染色,×100)
Tab.2 Comparison of the heart structure and function between the three groups of rats表2 3组大鼠心脏结构及功能比较 (±s)
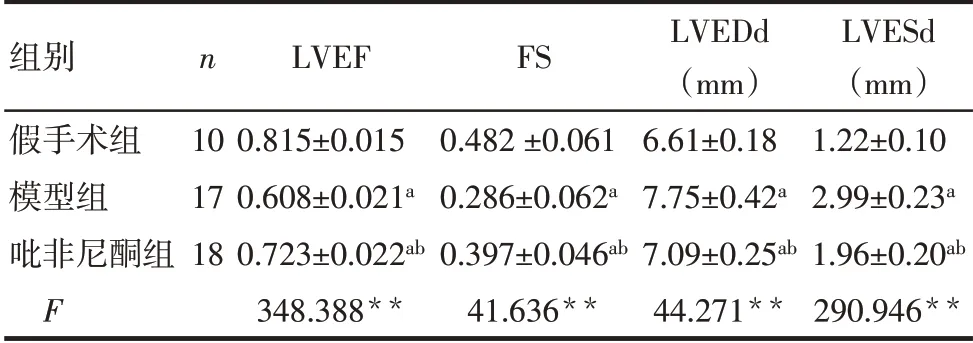
Tab.2 Comparison of the heart structure and function between the three groups of rats表2 3组大鼠心脏结构及功能比较 (±s)
**P<0.01;a与假手术组比较,b与模型组比较,P<0.05。
组别假手术组模型组吡非尼酮组F n 10 17 18 LVEF 0.815±0.015 0.608±0.021a 0.723±0.022ab 348.388**FS 0.482±0.061 0.286±0.062a 0.397±0.046ab 41.636**LVEDd(mm)6.61±0.18 7.75±0.42a 7.09±0.25ab 44.271**LVESd(mm)1.22±0.10 2.99±0.23a 1.96±0.20ab 290.946**
Tab.3 Comparison of plasma levels of IL-6,COL1α2 and COL3α1 between the three groups of rats表3 3组大鼠血浆IL-6、COL1α2、COL3α1水平比较(n=10,ng/L,±s)
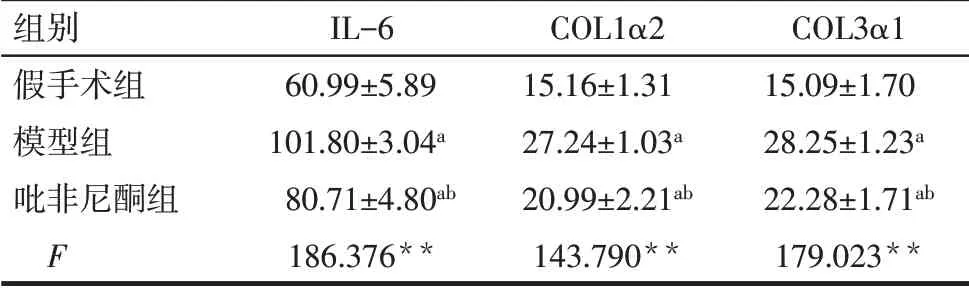
Tab.3 Comparison of plasma levels of IL-6,COL1α2 and COL3α1 between the three groups of rats表3 3组大鼠血浆IL-6、COL1α2、COL3α1水平比较(n=10,ng/L,±s)
**P<0.01;a与假手术组比较,b与模型组比较,P<0.05。
组别假手术组模型组吡非尼酮组F IL-6 60.99±5.89 101.80±3.04a 80.71±4.80ab 186.376**COL1α2 15.16±1.31 27.24±1.03a 20.99±2.21ab 143.790**COL3α1 15.09±1.70 28.25±1.23a 22.28±1.71ab 179.023**
2.4 3组大鼠心肌组织中TGF-β1、Smad2、Smad3蛋白表达水平比较与假手术组相比,模型组大鼠心肌组织中TGF-β1、Smad2、Smad3蛋白表达升高(P<0.05);与模型组相比较,吡非尼酮组大鼠心肌组织中TGF-β1、Smad2、Smad3蛋白表达水平降低(P<0.05)。见图3、表4。

Fig.3 The protein expression levels of TGF-β1,Smad2 and Smad3 in myocardial tissues of rats detected by Western blot assay图3 Western blot检测3组大鼠心肌组织TGF-β1、Smad2、Smad3蛋白表达
Tab.4 Comparison of protein expression levels of myocardial tissue TGF-β1,Smad2 and Smad3 between the three groups of rats表4 3组大鼠心肌组织TGF-β1、Smad2、Smad3蛋白表达水平比较 (n=4,±s)

Tab.4 Comparison of protein expression levels of myocardial tissue TGF-β1,Smad2 and Smad3 between the three groups of rats表4 3组大鼠心肌组织TGF-β1、Smad2、Smad3蛋白表达水平比较 (n=4,±s)
**P<0.01;a与假手术组比较,b与模型组比较,P<0.05。
组别假手术组模型组吡非尼酮组F TGF-β1 0.40±0.02 0.97±0.07a 0.71±0.03ab 155.789**Smad2 0.58±0.01 1.09±0.02a 0.76±0.03ab 689.734**Smad3 0.56±0.07 1.12±0.04a 0.86±0.02ab 127.620**
2.5 3组大鼠心肌组织中miRNA-425-5p水平的比较模型组大鼠心肌组织中miRNA-425-5p相对表达量为0.99±0.01,与假手术组的3.36±0.11相比,表达水平明显降低(P<0.05);吡非尼酮组大鼠心肌组织中miRNA-425-5p相对表达量为1.77±0.14,与模型组相比表达水平明显升高(n=3,F=536.613,P<0.05)。
2.6 3组大鼠心肌成纤维细胞中miRNA-425-5p与TGF-β1 mRNA表达水平的比较与对照组相比,miRNA-425-5p mimic组大鼠心肌成纤维细胞中miRNA-425-5p表达水平明显升高,TGF-β1 mRNA水平明显降低(P<0.05);与对照组相比,吡非尼酮组大鼠心肌成纤维细胞中miRNA-425-5p表达水平明显升高,TGF-β1 mRNA表达水平明显降低(均P<0.05)。见表5。
Tab.5 Comparison of mRNA relative expression levels of TGF-β1 and miRNA-425-5p between the three groups of rats表5 3组大鼠心肌成纤维细胞TGF-β1、miRNA-425-5p mRNA相对表达量比较 (n=3,±s)
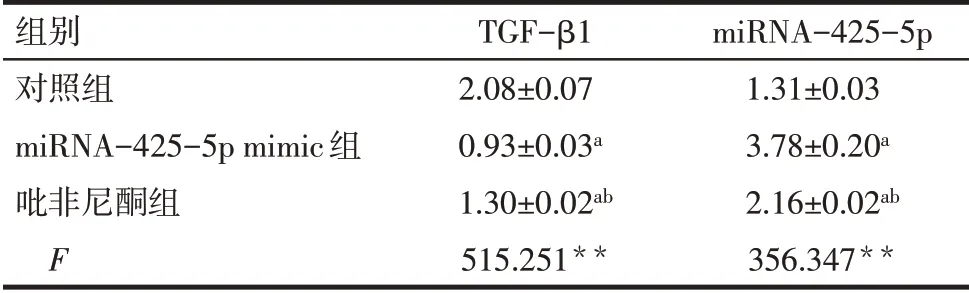
Tab.5 Comparison of mRNA relative expression levels of TGF-β1 and miRNA-425-5p between the three groups of rats表5 3组大鼠心肌成纤维细胞TGF-β1、miRNA-425-5p mRNA相对表达量比较 (n=3,±s)
**P<0.01;a与对照组比较,b与miRNA-425-5p mimic组比较,P<0.05。
组别对照组miRNA-425-5p mimic组吡非尼酮组F TGF-β1 2.08±0.07 0.93±0.03a 1.30±0.02ab 515.251**miRNA-425-5p 1.31±0.03 3.78±0.20a 2.16±0.02ab 356.347**
3 讨论
吡非尼酮是第一个通过重复、随机、安慰剂对照的Ⅲ期临床试验证明对特发性肺纤维化有治疗效果的药物。有研究表明,吡非尼酮同样可以减轻心力衰竭患者左心室心肌纤维化程度[5]。本研究通过结扎大鼠冠状动脉制备心肌梗死模型与培养大鼠心肌成纤维细胞,从体外与体内两个方面探讨了吡非尼酮改善心肌纤维化的作用与机制。
3.1 吡非尼酮可以改善心肌梗死大鼠的心脏功能心肌梗死是心肌缺血性疾病的终末表现,其病理生理学表现为功能性心肌细胞的死亡、缺失,引起心脏功能下降,导致不良预后。应用吡非尼酮可以改善心肌梗死大鼠的心肌肥厚与左心室收缩功能,该作用可能是通过调节肾素-血管紧张素系统实现的[6]。本研究心脏彩超结果证明了吡非尼酮可以改善心肌梗死大鼠心脏功能。
3.2 应用吡非尼酮可以减轻心肌梗死后的心肌纤维化进程心肌纤维化是心脏损伤后发生的心肌间质重塑,心肌成纤维细胞异常增殖活化,胶原纤维大量分泌,坏死的心肌细胞被胶原基质瘢痕替代的病理进程。参与心肌纤维化的主要胶原纤维为Col-Ⅰ、Col-Ⅲ。在生理状态下,Col-Ⅰ、Col-Ⅲ等胶原蛋白的合成、分解处于动态平衡,而心肌梗死发生后,胶原蛋白大量分泌,其合成大于分解,沉积于心肌间质,导致心肌纤维化[7]。胶原纤维的过量堆积将导致心肌僵硬度的提高,引起心功能损害和心室肌重构,最终导致不良事件的发生。本研究结果表明,应用吡非尼酮可以改善心肌梗死大鼠心肌纤维化程度。
3.3 吡非尼酮可以通过抗炎作用减轻心肌纤维化心肌梗死后单核细胞与巨噬细胞分泌大量炎性因子,在心肌纤维化进程中起到重要作用[8]。IL-6是一类多效应细胞因子,敲除IL-6基因可明显减轻高脂饮食诱导心肌病小鼠的心肌纤维化程度[9]。另有研究表明,心肌成纤维细胞也可以分泌IL-6,通过旁分泌途径作用于心肌细胞,促使心肌肥厚与纤维化[10]。IL-6影响心肌纤维化是通过IL-6-Ca2+/钙调蛋白依赖性蛋白激酶Ⅱ-STAT3与IL-6-丝裂原活化蛋白激酶途径实现的[11]。本研究结果显示,与模型组相比,吡非尼酮组大鼠血浆中IL-6水平明显降低,提示吡非尼酮减轻心肌梗死后心肌纤维化进程与其抗炎作用有关。
3.4 吡非尼酮可通过抑制TGF-β/Smad信号通路改善心肌纤维化TGF-β/Smad通路是调控心肌纤维化进程的最主要通路之一。TGF-β/Smad信号通路可通过炎症、心肌细胞凋亡、心肌肥大、心肌纤维化等多种进程参与心室重构。研究表明,注射异丙肾上腺素所致的大鼠心肌重塑模型中,炎性因子IL-6、TNF-α含量明显增加,TGF-β/Smad通路激活,同时出现了心肌细胞的凋亡[12]。有研究表明,当给予血管紧张素Ⅱ阻断剂时,TGF-β减少,TAK1-p38磷酸化受抑制,同时可通过调节TGF-β/Smad通路抑制小鼠心肌肥大[13]。此外,心室压力负荷实验表明,TGF-β表达水平随心肌纤维化的增加明显升高,过表达TGF-β1的转基因小鼠心肌纤维化程度明显加重[14]。梗死后心肌纤维化大鼠模型中p-Smad3与t-Smad3的表达较正常组明显上升[15]。本研究结果表明,与模型组相比,吡非尼酮组大鼠心肌组织中TGF-β1、Smad2、Smad3蛋白表达明显降低,提示吡非尼酮改善心肌纤维化与抑制TGF-β/Smad信号通路相关。
3.5 吡非尼酮可通过调节miRNA-425-5p表达水平抑制TGF-β/Smad信号通路miRNA与梗死后心力衰竭心肌纤维化进程密切相关。有研究发现,miRNA-425-5p可以通过调控靶基因CREB1抑制心肌纤维化的发生[16]。本研究细胞部分实验结果可见,相比对照组,吡非尼酮组大鼠心肌成纤维细胞中miRNA-425-5p水平明显升高,TGF-β1 mRNA水平明显降低,证明了吡非尼酮可通过提高miRNA-425-5p的表达来抑制TGF-β/Smad信号通路。
综上所述,吡非尼酮可通过调节miRNA-425-5p的表达抑制TGF-β/Smad信号通路,减轻炎症反应,改善心肌纤维化,治疗心肌梗死,改善心脏功能。

