高糖通过miR-192调控CAV-1/EGF影响肾小球系膜细胞增殖、迁移及细胞外基质形成的机制研究
吴玮熙,刘帅辉,周赛君,刘红岩,张睿,于珮
糖尿病肾病(diabetic kidney disease,DKD)是糖尿病较严重的并发症之一[1-2]。目前,控制血糖、血压或阻断肾素血管紧张素系统(renin angiotensin system,RAS)等传统治疗方法可以延缓DKD的进展,但尚无有效的方法预防或逆转DKD向肾功能衰竭进展[3]。因此,深入探讨DKD的发病机制,挖掘DKD治疗的新靶点,为临床预防和治疗DKD提供新的思路显得十分重要和紧迫。DKD早期的主要病理特征是肾小球肥大,逐渐导致肾小球细胞外基质(extracellular matrix,ECM)沉积和肾小管间质纤维化,最终发展为肾脏不可逆的结构损伤[4]。研究表明,微小RNA(microRNA,miR)-192在肾小球系膜细胞外基质增生及系膜细胞肥大等方面发挥重要作用,抑制miR-192的表达可以改善DKD的肾脏纤维化[5],但具体机制尚不明确。本课题组前期通过尿蛋白组学筛选并验证了表皮生长因子(epidermal growth factor,EGF)可作为DKD早期标志物,并检索miRNA数据库发现小窝蛋白1(caveolin 1,CAV-1)可能是miR-192的靶蛋白,但确切调控机制有待进一步探索[6]。本研究旨在探讨miR-192在高糖诱导的人肾小球系膜细胞损伤的作用及相关机制,及其可否通过调节CAV-1和EGF表达参与DKD的进展,为研究DKD发生、发展提供新的思路。
1 材料与方法
1.1主要试剂与仪器胎牛血清(FBS)、RPMI 1640培养基、Opti-MEM培养基、胰蛋白酶购自美国Gibco公司;miR-192inhibitor/micmics、DEPC水购自中国上海吉玛制药技术有限公司,实时荧光定量PCR(qPCR)引物均由生工生物工程(上海)股份有限公司合成,RIPA蛋白裂解液、蛋白酶抑制剂购自北京Solarbio科技有限公司;小鼠抗人CAV-1、EGF、1型胶原蛋白(COLⅠ)、纤连蛋白(FN)、β-actin单克隆抗体购自美国Santa Cruz公司;HRP标记的兔抗小鼠IgG购自Protein Tech公司;NC膜购自美国Pall Corporation公司;ECL超敏化学发光液购自美国Advansta公司;预染蛋白Marker、Lipofectamine 2000购自美国Thermo Fisher Scienfic公司;Takara RNAiso Plus、SYBR Premix Ex TaqⅡ(Tli RNaseHPlus)购自日本宝生物工程有限公司;CCK-8试剂盒购自中国MCE有限公司;Western blot系统、凝胶成像分析系统和细胞培养箱购自美国Thermo Fisher Scientific公司;倒置荧光显微镜购自Olympus公司;酶标仪购自Bio-Rad公司。
1.2细胞培养人肾小球系膜细胞系(HMCs)购自北京北纳创联生物技术院,用含有10%FBS的RPMI 1640培养基在37℃、5%CO2的细胞培养箱中培养。根据细胞生长状况,每1~2 d换1次液,待细胞处于对数生长期进行后续实验。
1.3细胞转染及分组细胞按照随机数字表法分为6组:正糖组(NG组,5.6 mmol/L葡萄糖)、高糖组(HG组,25 mmol/L葡萄糖)、NG+mimics组(5.6 mmol/L葡萄糖+miR-192模拟物)、HG+mimics组(25 mmol/L葡萄糖+miR-192模拟物)、NG+inhibitor组(5.6 mmol/L葡萄糖+miR-192抑制剂)、HG+inhibitor组(25 mmol/L葡萄糖+miR-192抑制剂)。HMCs接种于6孔板上,细胞汇合至80%~90%时,按照Lipofectamine 2000操作说明书将miR-192抑制剂和模拟物分别转入生长状态良好的肾小球系膜细胞中。转染6 h后,根据不同条件更换液体培养24 h,用于后续实验。
1.4CCK-8法检测细胞增殖活性将细胞按照5×103/mL的密度接种在96孔板中,每组设置5个复孔,每孔加入100 μL培养基,放入细胞培养箱中培养过夜。待细胞贴壁后用不同培养基干预细胞24 h,然后向每孔中加入10 μL的CCK-8工作液后再放回培养箱中孵育0.5~4 h,每隔0.5 h用酶标仪测定450 nm处的光密度值(OD值),评估细胞活力。根据OD值计算细胞增殖率,增殖率=[(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)]×100%。
1.5划痕愈合实验检测细胞迁移能力将细胞按1×105/孔接种于6孔板中,37℃恒温培养过夜,用200 μL的高压灭菌枪头垂直沿着无菌直尺划痕,尽量保证使划痕宽度一致。用磷酸盐缓冲液冲洗掉细胞划痕产生的碎屑,加入2 mL无血清培养基后放入细胞培养箱中继续培养,分别于0 h、24 h时拍照记录结果。用Image J软件计算划痕面积(S),并计算划痕愈合率。划痕愈合率=[1-(S24h/S0h)]×100%。
1.6qPCR检测miR-192、EGF、CAV-1、FN、COLⅠmRNA表达利用Trizol法提取细胞总RNA,测量RNA浓度和纯度,利用试剂盒说明书逆转录合成cDNA。PCR引物设计见表1。取1 μL的cDNA产物进行qPCR扩增。扩增条件:预变性95℃30 s;95℃5 s,55℃30 s,72℃30 s,45个循环;溶解曲线分析:95℃5 s,65℃60 s,95℃1 s,采用2-ΔΔCt法计算各个指标相对表达量。
1.7Western blot检测蛋白表达将干预后的细胞收集到2 mL离心管中,离心后用PBS重悬细胞清洗3遍,加入RIPA裂解液和广谱蛋白酶抑制剂,充分裂解后吸取到1.5 mL离心管中。4℃、12 000×g离心10 min取上清液,加入上样缓冲液,沸水浴10 min。取10 μL蛋白样品进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,经转膜仪转膜后加入5%脱脂牛奶封闭2 h,TBST洗涤后分别加入CAV-1、EGF、COLⅠ、FN一抗(1∶1 000稀释)4℃孵育过夜。TBST再次洗涤10 min×3次后加入二抗(1∶4 000)常温孵育1 h,TBST洗涤后利用电化学(ECL)发光法显色,扫描仪检测结果。Image J软件分析蛋白的灰度值,以β-actin为内参,计算蛋白相对表达量。
1.8统计学方法采用SPSS 26.0软件分析数据,用GraphPad Prism 5.0软件作图。符合正态分布的计量资料以均数±标准差(±s)表示,多组间均数比较使用单因素方差分析,组间多重比较采用LSD-t法。P<0.05为差异有统计学意义。

Tab.1 The primer sequences for qPCR表1 qPCR引物序列
2 结果
2.1 各组细胞增殖的情况与NG组相比,HG组和NG+mimics组细胞增殖率升高,NG+inhibitor组细胞增殖率下降(P<0.05)。与HG组相比,HG+mimics组细胞增殖率增加,HG+inhibitor组细胞增殖率下降(P<0.05)。与NG+inhibitor组相比,HG+inhibitor组细胞增殖率下降更明显(P<0.05),见图1。

Fig.1 Comparison of proliferative activity of mesangial cells between the six groups图1各组人肾小球系膜细胞的增殖活性比较
2.2 各组细胞迁移能力比较与NG组相比,HG组、NG+mimics组细胞划痕愈合率增加(P<0.05);NG+inhibitor组划痕愈合率降低(P<0.05);与HG组相比,HG+mimics组划痕愈合率增加(P<0.05),HG+inhibitor组 划 痕 愈 合 率 降 低(P<0.05),见图2、3。
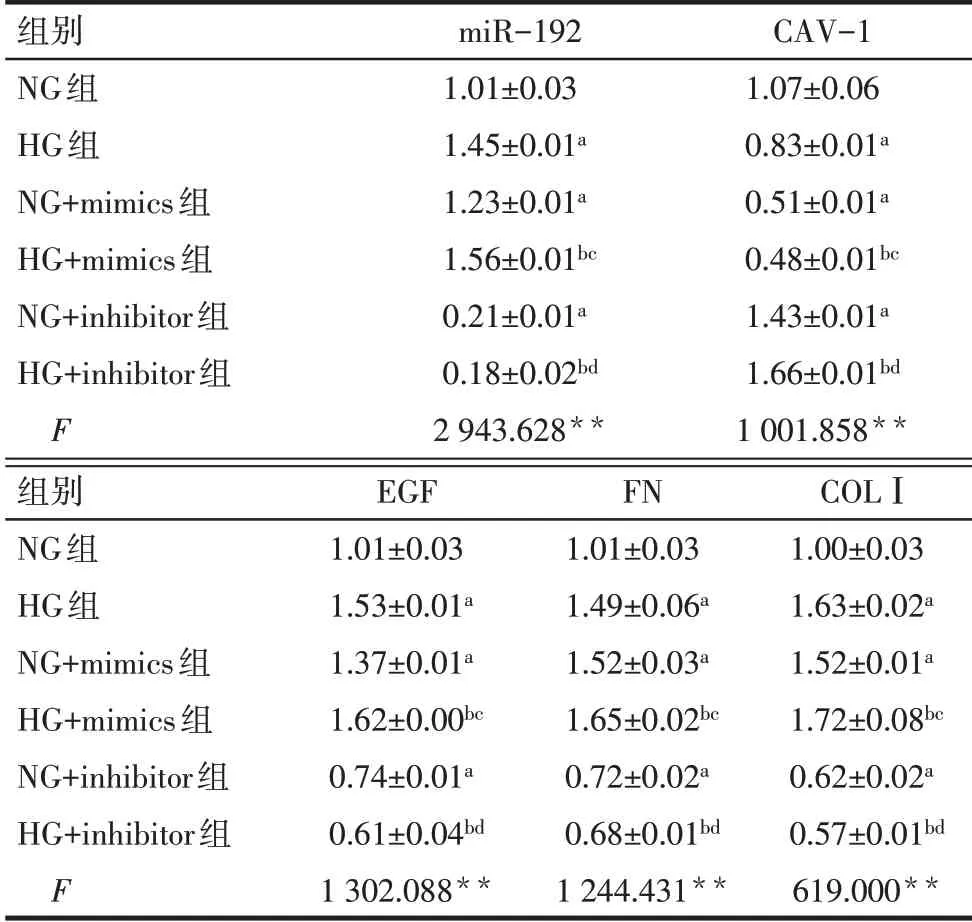
2.3 各组miR-192及CAV-1、EGF、FN、COLⅠmRNA相对表达水平比较与NG组相比,HG组和NG+mimics组miR-192、EGF、FN、COLⅠmRNA表达上调,CAV-1 mRNA表达下调(均P<0.05);NG+inhibitor组miR-192、EGF、FN、COLⅠmRNA表达下调,CAV-1 mRNA表达上调(P<0.05)。与HG组相比,HG+mimics组miR-192、EGF、FN、COLⅠmRNA表达上调,CAV-1 mRNA表达下调(P<0.05);HG+inhibitor组miR-192、EGF、FN、COLⅠmRNA表达下调,CAV-1 mRNA表达上调(P<0.05),见表2。
2.4 各组CAV-1、EGF、FN、COLⅠ蛋白相对表达水平与NG组相比,HG组CAV-1表达降低,EGF、FN和COLⅠ表达升高(均P<0.05)。在NG组和HG组加入miR-192 mimics后,CAV-1表达降低,EGF、FN和COLⅠ表达升高(均P<0.05)。在NG组和HG组分别加入miR-192 inhibitor后,CAV-1蛋白表达升高,EGF、FN和COLⅠ表达水平均降低,HG组加入miR-192 inhibitor趋势更加明显(均P<0.05),见图2、表3。
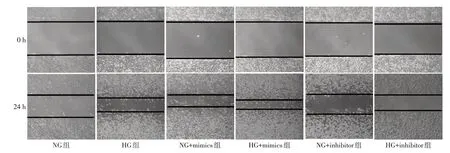
Fig.2 Migration ability of cells of the six groups(×200)图2各组细胞的迁移能力(×200)

图3 Comparison of the migration ability of cells between the six groups图3各组细胞的迁移能力比较
Tab.2 Comparison of miR-192,CAV-1,EGF,FN,COLI mRNA levels of cells between the six groups表2各组细胞miR-192及CAV-1、EGF、FN、COLI mRNA水平比较 (n=3,±s)
Tab.2 Comparison of miR-192,CAV-1,EGF,FN,COLI mRNA levels of cells between the six groups表2各组细胞miR-192及CAV-1、EGF、FN、COLI mRNA水平比较 (n=3,±s)
**P<0.01;a与NG组比较,b与HG组比较,c与NG+mimics组比较,d与NG+inhibitor组比较,P<0.05。
组别NG组HG组NG+mimics组HG+mimics组NG+inhibitor组HG+inhibitor组F miR-192 1.01±0.03 1.45±0.01a 1.23±0.01a 1.56±0.01bc 0.21±0.01a 0.18±0.02bd 2 943.628**CAV-1 1.07±0.06 0.83±0.01a 0.51±0.01a 0.48±0.01bc 1.43±0.01a 1.66±0.01bd 1 001.858**组别NG组HG组NG+mimics组HG+mimics组NG+inhibitor组HG+inhibitor组F EGF 1.01±0.03 1.53±0.01a 1.37±0.01a 1.62±0.00bc 0.74±0.01a 0.61±0.04bd 1 302.088**FN 1.01±0.03 1.49±0.06a 1.52±0.03a 1.65±0.02bc 0.72±0.02a 0.68±0.01bd 1 244.431**COLⅠ1.00±0.03 1.63±0.02a 1.52±0.01a 1.72±0.08bc 0.62±0.02a 0.57±0.01bd 619.000**
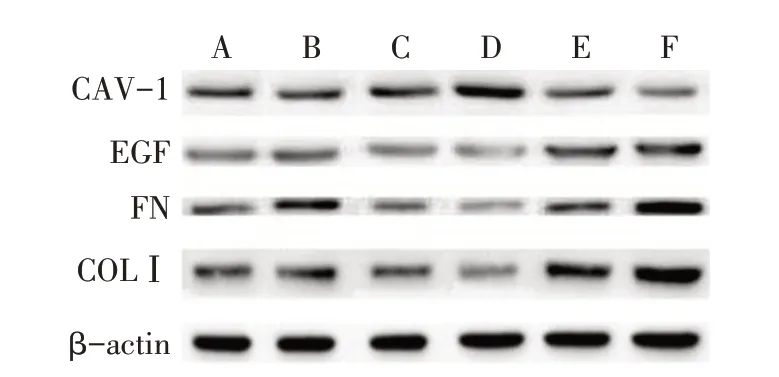
Fig.2 Changes of CAV-1,EGF,FN and COLⅠprotein detected by Western blot assay图2 Western blot法检测CAV-1、EGF、FN、COLⅠ蛋白变化
Tab.3 Comparison of the protein levels of CAV-1,EGF,FN and COLI between the six groups表3各组细胞CAV-1、EGF、FN、COLI蛋白表达水平比较 (n=3,±s)

Tab.3 Comparison of the protein levels of CAV-1,EGF,FN and COLI between the six groups表3各组细胞CAV-1、EGF、FN、COLI蛋白表达水平比较 (n=3,±s)
**P<0.01;a与NG组比较,b与HG组比较,c与NG+mimics组比较,d与NG+inhibitor组比较,P<0.05。
组别NG组HG组NG+mimics组HG+mimics组NG+inhibitor组HG+inhibitor组F CAV-1 0.95±0.01 0.93±0.01a 0.80±0.01a 0.55±0.01bc 1.06±0.01a 1.20±0.01bd 1 740.498**EGF 0.71±0.02 0.78±0.11a 0.88±0.11a 0.88±0.11b 0.66±0.02a 0.48±0.01bd 509.618**FN 0.67±0.01 0.95±0.02a 0.73±0.05a 1.07±0.11bc 0.58±0.02a 0.41±0.01bd 68.769**COLⅠ0.81±0.01 0.84±0.01a 0.93±0.01a 1.08±0.08bc 0.78±0.08a 0.54±0.01bd 76.459**
3 讨论
DKD的主要病理特征包括肾小球基底膜增厚、系膜扩张和肥大以及ECM异常积累。FN和COLⅠ通常被认为是ECM的主要成分[7],它们随着间质ECM的积累增加,可明显促进肾脏组织纤维化。研究表明,糖尿病患者的肾脏细胞可以调控ECM蛋白质如COLⅠ的表达,长期慢性高血糖刺激肾小球系膜细胞增殖,促使系膜细胞分泌细胞外基质增多,是导致肾小球硬化、肾小管间质纤维化和蛋白尿产生的重要病理机制[8]。COLⅠ是一种基膜胶原,是肾小球ECM的主要成分,在系膜细胞间相互交叉形成网络[9]。FN是一种大分子糖蛋白,在细胞外基质中相互交叉形成网状结构,为其他细胞外基质成分沉积提供支架[10]。在高糖刺激下ECM异常累积,系膜细胞增殖且随着病情加重,这种趋势更加显著。本研究发现,和正常条件下培养的细胞比,高糖条件下培养的肾小球系膜细胞的增殖率和迁移愈合率均出现升高,ECM生成增多。利用miR-192 mimics或inhibitor处理系膜细胞,当miR-192表达增多或减少时,细胞增殖、迁移和ECM表现出相同的趋势,说明miR-192参与了DKD的发生发展。
miR-192属于microRNA家族中目前研究较为广泛的一员,其可以影响细胞的分化以及增殖代谢,直接或间接地参与多种疾病发生发展[11-13],包括DKD。有研究表明,miR-192在糖尿病患者肾脏中高度且完全特异表达,但其具体功能或靶标尚不完全清楚[14]。在慢性肾脏病小鼠模型中,高表达的miR-192可能作为保护因素发挥抗纤维化的作用,上调miR-192的表达可以通过Smad同源物3(Smad3)延缓肾间质纤维化[15]。与该结果相反的是,在DKD模型的小鼠的肾小球系膜细胞中,转化生长因子β(TGF-β)通过miR-192诱导Smad相互作用蛋白1(SIP1)下调,减少E盒抑制因子1(EF1)对2型胶原(COLⅠA2)的抑制作用,增加COLⅠA2的表达,促进ECM增生,最终导致肾脏纤维化[16]。本研究发现,与正常葡萄糖浓度培养基培养的细胞比,高糖干预后的系膜细胞miR-192的表达水平增高,并通过靶向CAV-1,进一步引起系膜细胞增殖、迁移和ECM累积,促进DKD的进展。
CAV-1是形成富含胆固醇的膜微区小窝所需的完整膜蛋白,它是细胞黏附和迁移的重要调节剂,参与多种疾病的发生、发展[17],对DKD的信号转导很重要。过表达CAV-1能够通过抑制丝裂原活化蛋白激酶(MAPK)通路,减少系膜细胞的增殖[18]。有研究发现,乳腺癌细胞中,miR-192通过靶向CAV-1抑制肿瘤细胞增殖并诱导凋亡[19]。本研究发现,和正常糖浓度培养的肾小球系膜细胞对比,高糖培养的细胞miR-192表达增高,CAV-1的mRNA和蛋白表达水平均降低;用miR-192 inhibitor转染系膜细胞下调miR-192的表达后,CAV-1的表达水平升高,而在转染miR-192 mimics后发现,随着系膜细胞miR-192表达水平的增高,CAV-1表达水平降低,说明miR-192抑制CAV-1的表达。
EGF是由十二指肠、肾脏等器官分泌的多肽[20-21],参与增殖、代谢、分化等多种生物过程的调控,具有促进上皮细胞增殖分化作用,能促进包括肾小球系膜细胞和上皮细胞的增殖分化,与DKD早期肾小球肥大和肾小管硬化有关[22]。本课题组前期通过STRING分析发现EGF与CAV-1具有相互作用[12]。Orlichenko等[23]发现CAV-1能够通过促进EGF的生成调节黏附结合蛋白(E-cadherin),增加胰腺肿瘤细胞的转移和侵袭能力。本研究发现,经过高糖培养和转染miR-192 micmics的肾小球系膜细胞,CAV-1表达水平降低,EGF表达水平升高,细胞增殖率升高;而在下调miR-192导致CAV-1过表达后,EGF表达水平受到抑制,提示在系膜细胞中,CAV-1可以抑制EGF表达。
综上所述,高糖上调肾小球系膜细胞内miR-192表达,进而抑制CAV-1的表达,从而减弱CAV-1对下游蛋白EGF的负向调控作用,进而引起系膜细胞增殖和迁移,ECM生成增多,这一调控机制可能是DKD进展的关键因素之一。通过抑制miR-192的表达延缓肾小球系膜细胞增殖和迁移以及ECM的形成,可为防治和DKD提供新的靶点,也为DKD发病机制的初步探索提供了新的视角。

