M g-HAP-HA复合吸附剂对亚甲基蓝的吸附性能研究
郑 瑶,苏可心,薛田田,李静萍
(兰州交通大学化学与化工学院,兰州 730070)
亚甲基蓝(MB)是一种重要的有机合成噻嗪类染料,易溶于水,溶液呈碱性,有毒性[1].在印染行业用于麻、蚕丝织物、纸张、生物、细菌组织的染色,竹、木的着色及墨水和色淀的制造等.亚甲基蓝印染废水具有水体量大、色纯度高、有机污染物浓度高[2]等特点,且具有一定的抗氧化、抗生物降解性,含亚甲基蓝工业废水地排放造成了自然界水体的污染.因此需要寻找一种高效率、低能耗、低经济成本、绿色安全的废水处理方法.
目前,国内外印染废水处理的方法有多种多样,其中包括微生物法、混凝法、化学沉淀法、氧化法、吸附法及膜分离法等[3].其中吸附法因操作便捷、能耗低、所需工艺条件简单而被广泛应用[4].
羟基磷灰石(HAP)是一种环境友好型材料,对污染物有良好的吸附能力[5].此外,HAP还具有制备工艺简单[6-7]、成本低、原料来源广等优势,但也存在分散性不好、吸附时易团聚的缺陷.腐植酸(HA)[8]是一类广泛存在于自然界中的高分子有机混合物,有良好的吸附性能并具有胶体性质[9-10],在水溶液中有很好的分散性,因此可与HAP进行复合,制成的复合吸附剂,可以改善HAP的团聚问题.
为了充分利用本土资源,本文采用的原料腐植酸从甘肃天祝褐煤中提取制得.本课题组将腐植酸(HA)与掺镁羟基磷灰石(Mg-HAP)复合制备出一种新型的Mg-HAP-HA复合吸附剂,对Mg-HAPHA、HA、Mg-HAP3种吸附剂吸附亚甲基蓝的效果、影响因素进行了探究,并对吸附了亚甲基蓝的Mg-HAP-HA复合吸附剂,进行解吸脱附再生性能实验.通过吸附动力学实验,确定了Mg-HAP-HA复合吸附剂对亚甲基蓝的吸附动力学模型.
1 实验部分
1.1 实验试剂及仪器
本文所需实验试剂及仪器如表1~2所列.

表1 实验试剂Tab.1 List of reagents used in the experiment
1.2 M g-HAP-HA的制备
1.2.1 腐植酸的提纯
称取20 g腐植酸钠置于500 mL烧杯中,加入400 mL蒸馏水,充分搅拌至腐植酸钠全部溶于水,用2 mol/L的H2SO4溶液调节pH值至1~2左右后,有大量的絮状沉淀物生成,即为腐植酸.静置12 h后,将得到的腐植酸沉淀过滤并用去离子水洗涤至滤液中无SO2-4出现为止,80℃条件下烘干,充分研磨后过200目筛,记为HA.
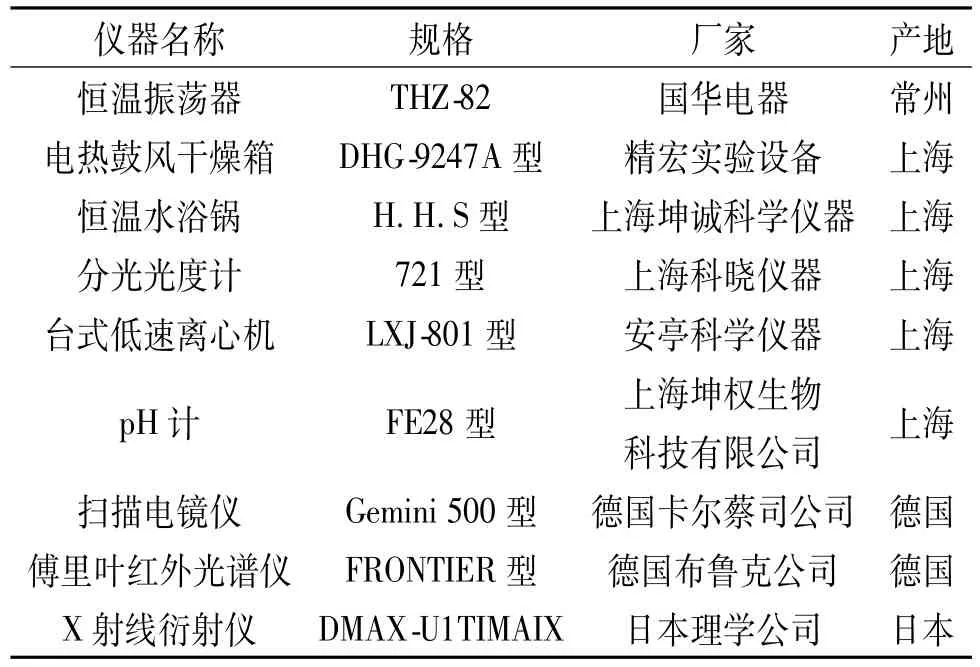
表2 实验仪器Tab.2 List of apparatuses used in the experiment
1.2.2 羟基磷灰石的制备
以 Ca(NO3)2·4H2O、Mg(NO3)2·6H2O、(NH4)2HPO4为反应物,采用共沉淀法制备羟基磷灰石.在烧杯中加入250 mL 0.5 mol/L的Ca(NO3)2,再将150 mL(NH4)2HPO4缓慢滴加至 Ca(NO3)2溶液中(Ca:P摩尔比为5:3).用氨水调节溶液的pH为10,搅拌0.5 h,在70℃温度下陈化8 h后,将产物抽滤、洗涤至pH不变,90℃下烘干,充分研磨后过200目筛,标记为HAP.
1.2.3 掺镁羟基磷灰石的制备
将羟基磷灰石通过加入Ca(NO3)2·4H2O和Mg(NO3)2·6H2O混合溶液的方法,掺入镁离子.在500 mL烧杯中加入 250 mL 0.5mol/L的 Ca(NO3)2,再将 150 mL(NH4)2HPO4缓慢滴加至 Ca(NO3)2中.表3是根据Mg:Ca的10种不同摩尔比配制,保持(Mg+Ca):P摩尔比为5:3制备掺镁羟基磷灰石.用氨水调节溶液的pH为10左右,搅拌30 min,在70℃下陈化8 h后,将产物抽滤、洗涤至pH中性不变,90℃条件下烘干,充分研磨后过200目筛,记为Mg-HAP.
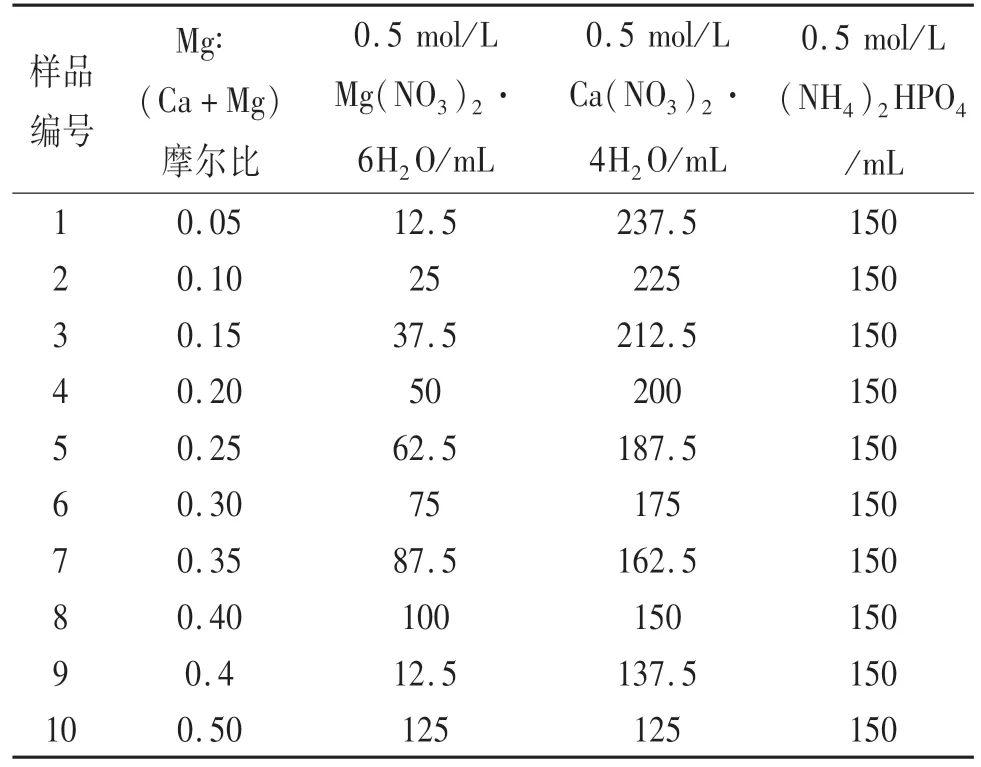
表3 不同M g:(Ca+Mg)摩尔比配制M g-HAP用料表Tab.3 Materials for preparing M g-HAP w ith different Mg:(Ca+M g)molar ratio
1.2.4 Mg-HAP-HA复合吸附剂的制备
用不同Mg:(Ca+Mg)摩尔比的掺镁羟基磷灰石对亚甲基蓝进行吸附试验,得出Mg:(Ca+Mg)摩尔比为0.2的掺镁羟基磷灰石吸附效果最佳,将其与腐植酸进行不同质量比的复合,制备出掺镁羟基磷灰石-腐植酸复合吸附剂.
称取一定质量的腐植酸置于1 000 mL烧杯中,加入500 mL蒸馏水,超声分散0.5 h.按照不同的复合质量比(见表4)加入掺镁羟基磷灰石,机械搅拌24 h后,过滤洗涤,90℃条件烘干,得到掺镁羟基磷灰石-腐植酸复合吸附剂,记为Mg-HAP-HA.
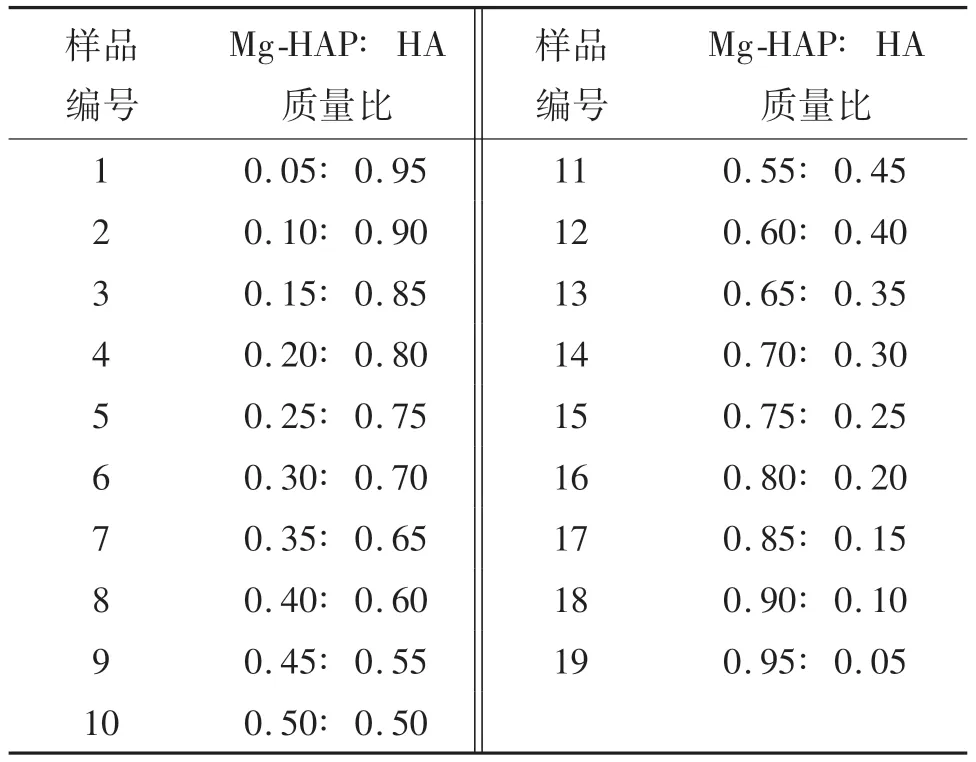
表4 Mg-HAP-HA质量比Tab.4 M g-HAP-HA mass ratio
将不同质量比的Mg-HAP-HA复合吸附剂各0.1 g对亚甲基蓝溶液进行吸附试验,亚甲基蓝初始浓度为250 mg/L,在25℃下,等温吸附120 min,所得到的吸附结果如图1所示,即复合质量比为0.55:0.45的11号Mg-HAP-HA复合吸附剂对亚甲基蓝的吸附率最高,达到98.79%,将其记为Mg-HAP-HA11.从图1可以看到当Mg-HAP:HA复合质量比较低时,吸附率也较低,这是因为HA对亚甲基蓝吸附能力低于Mg-HAP.随着复合质量比增大,吸附率提高,到Mg-HAP-HA11时吸附率最大,继续增大复合比,吸附率开始下降,是由于Mg-HAP含量比较高,导致复合吸附剂分散性变差,容易在水中沉聚.
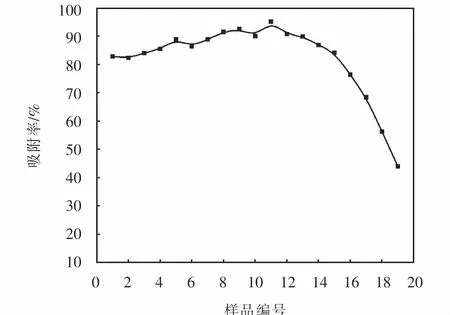
图1 不同复合质量比Mg-HAP-HA对亚甲基蓝吸附率的影响Fig.1 Effect of Mg-HAP-HA on methylene blue adsorption rate
1.3 单因素实验探究吸附MB的影响因素
在具塞锥形瓶中加入一定质量的吸附剂和一定浓度的亚甲基蓝溶液,并在振荡器中恒速震荡吸附.分别改变吸附条件,即时间、温度、溶液pH、亚甲基蓝初始浓度和吸附剂投加量,进行不同吸附剂对亚甲基蓝的吸附性能实验.按照公式(1)、(2)计算吸附率、吸附量.
吸附率:
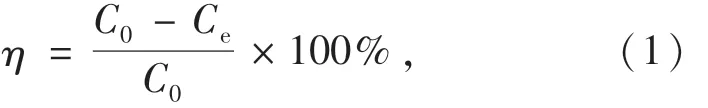
吸附量:
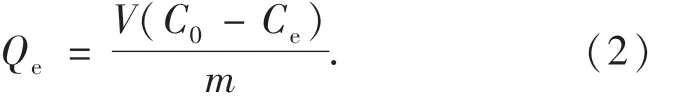
式中:C0为吸附质 MB的初始浓度,mg/L;Ce为吸附平衡浓度,mg/L;V为吸附质 MB的溶液体积,mL;m为吸附剂投加量,mg.
1.3.1 吸附时间
准确称取HA、Mg-HAP、Mg-HAP-HA113种吸附剂各0.1 g,置于250 mL具塞锥形瓶中,分别加入50 mL浓度为250 mg/L的亚甲基蓝溶液,调节溶液pH为6,在35℃条件下,恒温振荡吸附240 min,每间隔30 min离心后,取上清液,测定吸光度值,计算吸附率.讨论吸附时间对3种吸附剂吸附亚甲基蓝的影响.
1.3.2 吸附pH
准确称取HA、Mg-HAP、Mg-HAP-HA113种吸附剂各0.1 g,置于250 mL具塞锥形瓶中,分别加入250 mg/L的亚甲基蓝溶液50 mL,调节溶液pH分别为1、2、3、4、5、6、7、8、9,在 35℃条件下,恒温振荡吸附120 min,离心后取上清液,测定吸光度值,计算吸附率.讨论pH对3种吸附剂吸附亚甲基蓝的影响.
1.3.3 吸附温度
准确称取HA、Mg-HAP、Mg-HAP-HA113种吸附剂各0.1 g,置于250 mL具塞锥形瓶中,分别加入250 mg/L的亚甲基蓝溶液50 mL,调节溶液pH为6,温度分别为 25,30,35,40,45,50℃,恒温振荡吸附120 min,离心后取上清液,测定吸光度值.讨论吸附温度对3种吸附剂吸附亚甲基蓝的影响.
1.3.4 吸附剂投加量
精确称量质量分别为 0.03,0.05,0.08,0.1,0.15,0.25,0.3 g的 HA、Mg-HAP、Mg-HAP-HA113种吸附剂,置于250 mL具塞锥形瓶中,分别加入250 mg/L的亚甲基蓝溶液50 mL,调节溶液pH为6,在35℃条件下,恒温振荡吸附120 min,离心后取上清液,计算吸附率.讨论吸附剂投加量对3种吸附剂吸附亚甲基蓝的影响.
1.3.5 亚甲基蓝初始浓度
准确称取HA、Mg-HAP、Mg-HAP-HA113种吸附剂各0.1 g,置于250 mL具塞锥形瓶中,分别加入浓度为100,150,200,250,300,350,400 mg/L的亚甲基蓝溶液50 mL,调节溶液pH为6,在35℃条件下,恒温振荡吸附120 min,离心后取上清液,测定吸光度值.讨论亚甲基蓝的初始浓度对3种吸附剂吸附亚甲基蓝吸附率的影响.
1.4 吸附剂的解吸脱附循环再生实验
将饱和吸附亚甲基蓝后的Mg-HAP-HA11复合吸附剂干燥后,加入到不同脱附剂溶液中进行脱附,待溶液中亚甲基蓝浓度不再增大时,复合吸附剂经离心后,测定其吸光度,计算其脱附率.离心后的复合吸附剂经蒸馏水洗涤干燥,重复解吸脱附循环再生实验.
1.5 吸附亚甲基蓝的动力学实验
准确称取HA、Mg-HAP、Mg-HAP-HA113种吸附剂各0.1 g,置于250 mL具塞锥形瓶中,分别加入250 mg/L的亚甲基蓝溶液50 mL,调节溶液pH为6,在 35℃条件下,恒温振荡 30,60,90,120,150,180,210,240 min后,离心取上清液,测定吸光度值,计算吸附量.分别用公式(3)、(4)和(5)对所得到的实验数据进行拟合.
1)准一级动力学模型
众多影响因素中只存在一种因子决定反应速率称为准一级动力学,吸附剂表面只有一种反应位点,其用于液相的直线型方程式为[11]
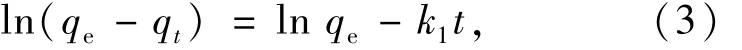
式中:qe为平衡吸附量,mg/g;qt为 t时刻的吸附量,mg/g;k1为一级吸附速率常数,L/min.
2)准二级动力学模型
准二级动力学模型是基于假设吸附速率受化学吸附机理的控制,其直线型表达式为
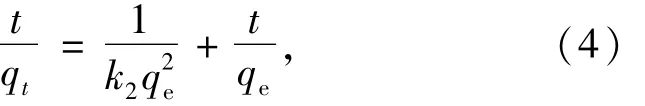
式中:qe为平衡吸附量,mg/g;k2为二级吸附速率常数,g/(mg·min);qt为 t时刻的吸附量,mg/g.
3)Weber-Morris内扩散模型

式中:qt为t时刻吸附量;C为液膜的厚度;kid为颗粒内扩散速率常数.
2 讨论与分析
2.1 样品表征测试方法
2.1.1 SEM分析
图2中(a)、(b)为HA的低倍镜和高倍镜图,图3中(a)、(b)为Mg-HAP的低倍镜和高倍镜图,图4中(a)、(b)为 Mg-HAP-HA11复合吸附剂的低倍镜和高倍镜图.
从图2中可以看到HA表面结构粗糙,呈现出较大的块状结构.从图3中可以看到其与HA的SEM图有显著差异,呈现出较小的颗粒状结构,表面结构更加粗糙、有明显的孔隙结构、比表面积较大.从图4中可以看到Mg-HAP和HA复合后的Mg-HAP-HA11吸附剂的SEM图,跟HA和Mg-HAP的SEM图相比,表面变的更加粗糙、孔洞数目增多、比表面积更大.

图2 HA的SEM 图Fig.2 SEM image of HA

图3 M g-HAP的 SEM 图Fig.3 SEM image of Mg-HAP
2.1.2 FT-IR分析
图5为HA、Mg-HAP和Mg-HAP-HA113种吸附剂的FT-IR图.
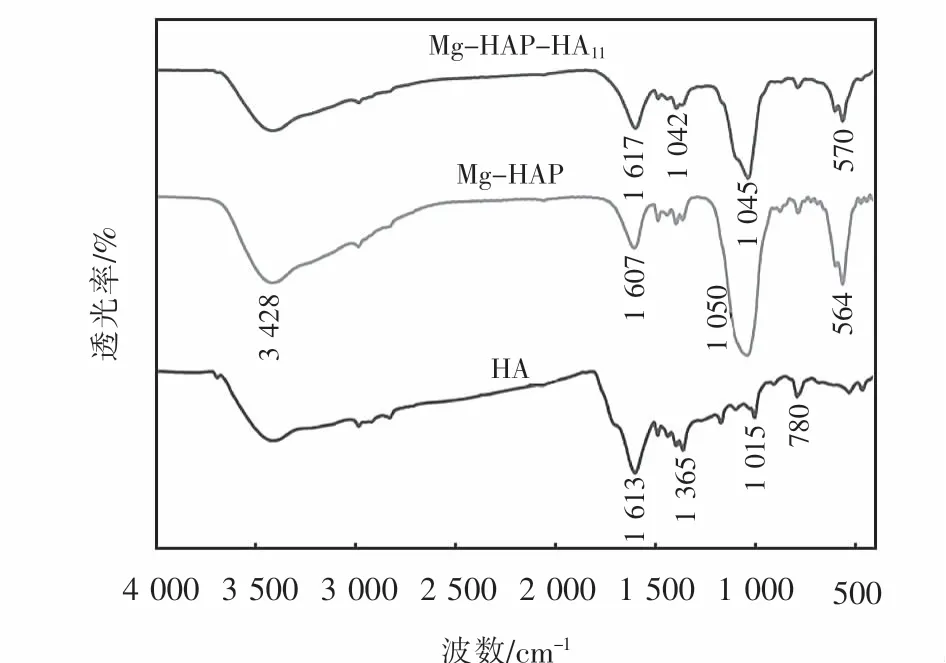
图5 HA、M g-HAP和M g-HAP-HA11复合吸附剂的FTIR图Fig.5 FT-IR images of the HA,Mg-HAP,and M g-HAPHA 11 com posite adsorbent
由于HA物质中含有丰富的活性基团,这些基团之间会互相影响,使原本的吸收峰发生位移或被掩盖,但根据其位置仍可确定部分基团[12].在3 400 cm-1附近出现的宽峰是氢键缔合OH和游离OH的氢键伸缩振动峰.HA的特征吸收峰出现在1 600 cm-1和1 365 cm-1处,1 600 cm-1附近出现的吸收峰,为芳香族C=C拉伸振动以及-COOH中的C=O伸缩振动[13],1 365 cm-1处出现的一组吸收峰,主要包括有COO-对称吸收峰和脂肪末端CH3弯曲振动[14].780 cm-1处出现的较弱吸收峰,为苯环中CH面外弯曲振动吸收峰,在HA、Mg-HAP和Mg-HAP-HA11的谱图上,可以看到1 050 cm-1和570 cm-1附近出现的两组峰是PO3-4的特征吸收峰[15],表明Mg-HAP与HA复合成功.

图 4 Mg-HAP-HA 11的 SEM 图Fig.4 SEM image of Mg-HAP-HA 11
2.1.3 XRD分析
图6为HA、Mg-HAP和Mg-HAP-HA113种吸附剂的XRD图.
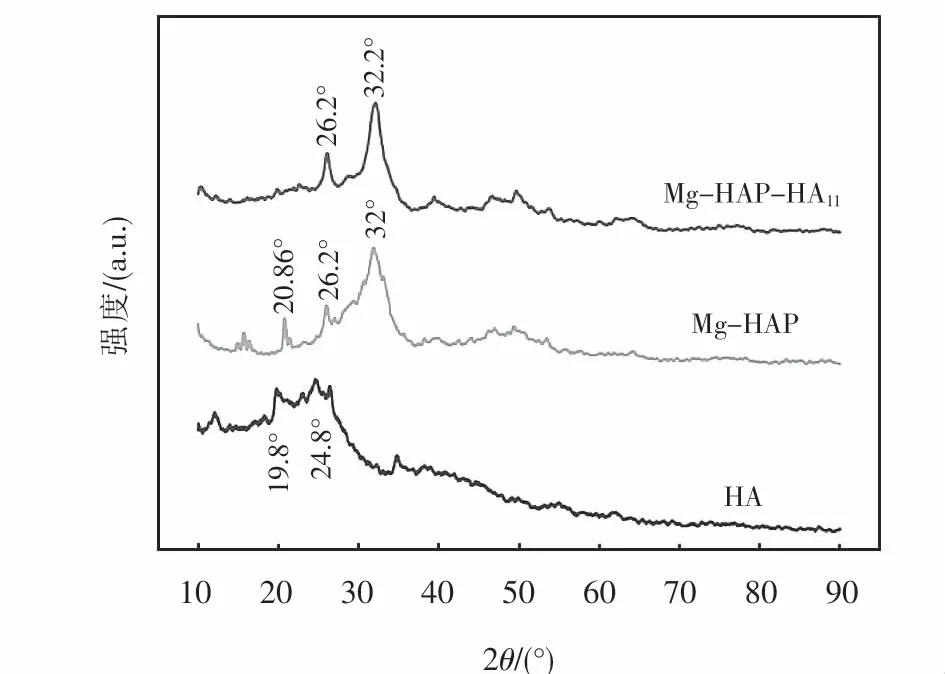
图6 HA、Mg-HAP和M g-HAP-HA11的XRD图Fig.6 XRD images of HA,M g-HAP and M g-HAP-HA11 composite adsorbent
图6 中可观察到HAP、Mg-HAP、Mg-HAP-HA11在2θ为26.2°,Mg-HAP、Mg-HAP-HA11在 2θ为 32°附近的位置处,出现了和HA相对应的衍射峰,表明Mg(II)与HAP,Mg-HAP与 HA已成功复合.但是衍射峰强度不够高,可能是Mg(II)的掺杂导致其晶格缺陷变大,这种晶格的缺陷会使比表面积进一步增大,使得吸附能力提高[16-17].在HA的XRD图谱上可以看到19.8°~24.8°有一条比较宽的衍射峰,为HA的晶面衍射峰,但是峰强度较低,这是因为HA在形成的过程当中,其结构内的芳环可能会发生有序排列,从而形成某种晶体结构[18].
2.2 实验结果与讨论
2.2.1 吸附时间
HA、Mg-HAP和Mg-HAP-HA113种吸附剂对亚甲基蓝的吸附率随时间变化关系,如图7所示.
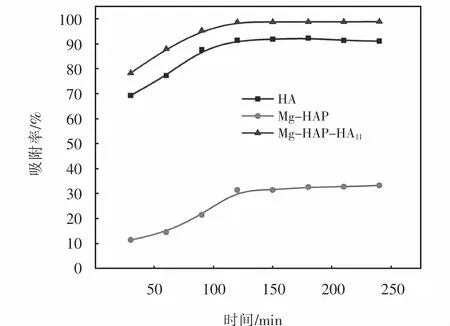
图7 时间对MB吸附率的影响Fig.7 Effect of time on adsorption rate of MB
图7 中,在0~120 min之间,随着时间的增加,Mg-HAP和Mg-HAP-HA11比HA吸附率数值大,3种吸附剂对亚甲基蓝的吸附率,在吸附时间为120 min时最大,120 min后,HA、Mg-HAP和 Mg-HAP-HA11吸附率数值基本保持不变,不随时间而变化.在吸附开始阶段,溶液中亚甲基蓝分子较多,吸附剂表面还存在许多的吸附活性位点未被反应占据,因此,吸附率迅速增大.当亚甲基蓝浓度逐渐降低后,吸附剂的吸附活性位点减少,最终达到吸附平衡.
2.2.2 吸附pH
HA、Mg-HAP和Mg-HAP-HA11在不同pH值条件下,吸附亚甲基蓝的吸附率,如图8所示.
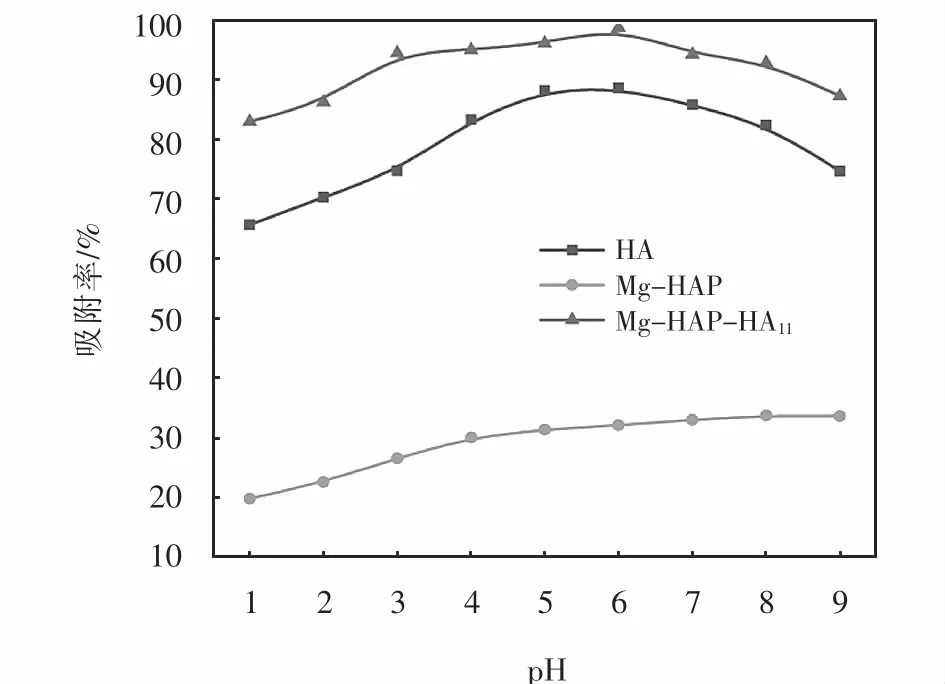
图8 p H对MB吸附率的影响Fig.8 Effect of pH on adsorption rate of MB
从图8中可以看到在pH为1~6时,3种吸附剂对亚甲基蓝的吸附率逐渐增大.当pH继续增大,HA和Mg-HAP-HA11对亚甲基蓝的吸附率开始减小,而Mg-HAP对亚甲基蓝的吸附率仍在增大,但增加幅度较小.当溶液pH值较小时,吸附剂表面带正电,会与亚甲基蓝产生静电斥力.同时溶液中含有大量的H+,会与其形成竞争吸附[19],这个状态下吸附剂对亚甲基蓝的吸附率会降低.随着溶液酸碱值增大,H+浓度降低,吸附剂电负性增加,吸附率开始逐渐升高.而当溶液处于碱性环境时,会破坏HA表面的酸性基团,使得吸附率开始下降.因此,选择6作为最佳吸附pH值.
2.2.3 吸附温度
HA、Mg-HAP和Mg-HAP-HA11在不同温度下对亚甲基蓝的吸附结果,如图9所示.当温度升高,所研究的3种吸附剂的吸附率都有不同程度地提高,温度的升高能够使亚甲基蓝分子运动加快,增加了与吸附剂碰撞的机率,有利于吸附过程地进行.根据实验结果可知,在温度由35℃提升至50℃,HA、Mg-HAP和Mg-HAP-HA113种吸附剂对亚甲基蓝的吸附率分别由89.38%、32.12%、98.79%提升至96.82%、42.74%、99.29%.其中Mg-HAP-HA11和HA的吸附率提升并不明显,是因为其本身对亚甲基蓝的吸附能力较强,在35℃时已经吸附了大量的亚甲基蓝,而Mg-HAP在35℃吸附率仅有32.12%,溶液中尚有大量的亚甲基蓝,升高温度,吸附率仍有明显提升.因此,选择35℃作为最佳吸附温度.
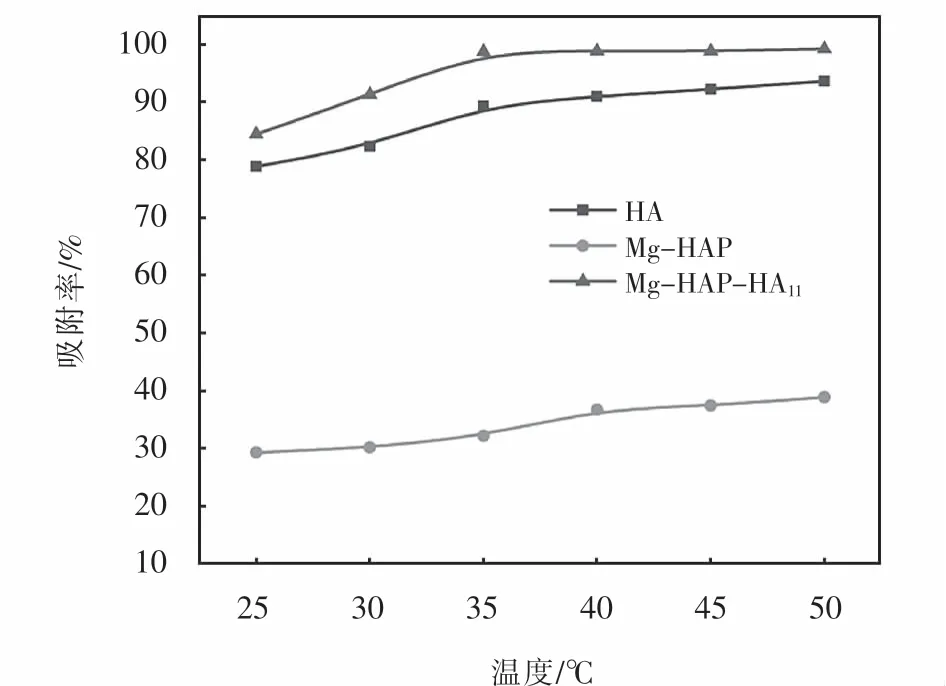
图9 温度对MB吸附率的影响Fig.9 Effect of temperature on adsorption rate of MB
2.2.4 吸附剂投加量
HA、Mg-HAP和Mg-HAP-HA11在不同投加量条件下对亚甲基蓝的吸附率,如图10所示.随着吸附剂投加量地增加,吸附率明显增大.其中Mg-HAPHA11和HA在投加量为0.1 g时,对亚甲基蓝的吸附率分别为98.79%和89.38%,继续增加吸附剂投加量,由于溶液中剩余的亚甲基蓝分子数目较少,吸附率基本不变.而Mg-HAP在投加量为0.1 g时对亚甲基蓝的吸附率仅为32.12%.因此,选择0.1 g作为吸附剂的最佳投加量.
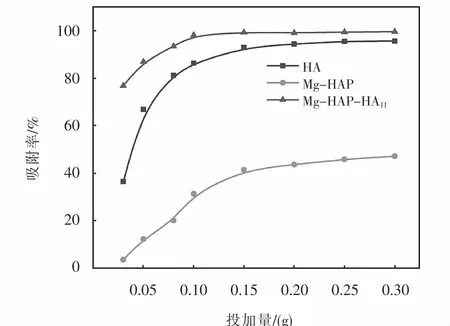
图10 投加量对MB吸附率的影响Fig.10 Effect of dosage on adsorption rate of MB
2.2.5 吸附质的初始浓度
HA、Mg-HAP和Mg-HAP-HA11吸附不同浓度亚甲基蓝溶液的吸附率,如图11所示.在初始浓度较低时,HA和Mg-HAP-HA11在亚甲基蓝浓度为100~200 mg/L时,吸附率均保持在90%以上,其中Mg-HAP-HA11相较于HA和Mg-HAP吸附效果最佳.而随着亚甲基蓝浓度的增大,吸附率开始下降,原因是由于吸附剂投加量保持不变,吸附剂活性位点不变,而亚甲基蓝浓度却在增大,亚甲基蓝分子不能完全被吸附,吸附率开始下降,因此,选择亚甲基蓝的最佳浓度为250 mg/L.
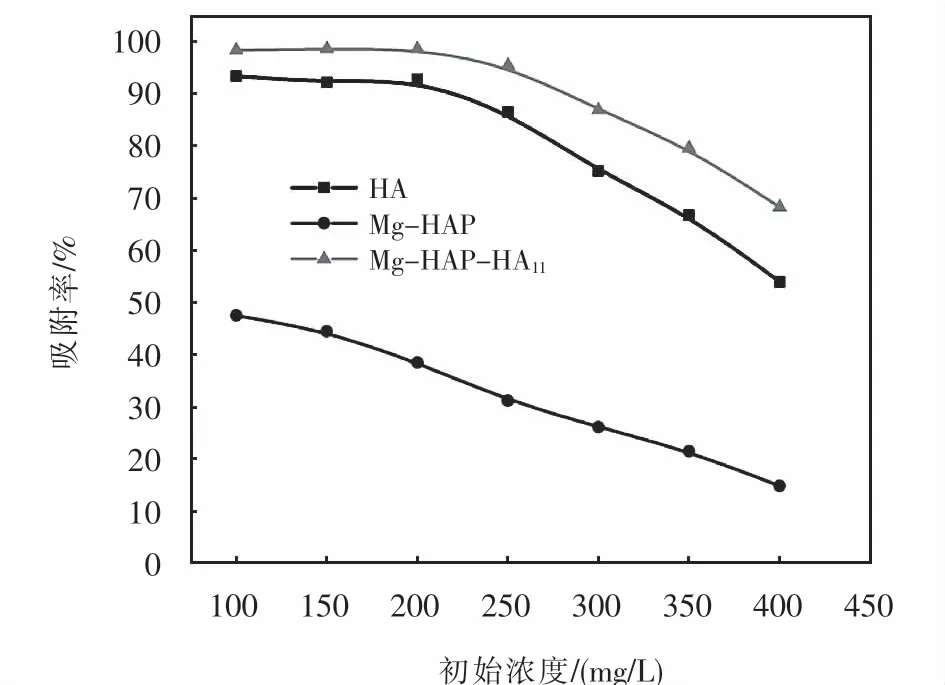
图11 吸附质的初始浓度对MB吸附率的影响Fig.11 Effect of initial adsorbate concentration on adsorption rate of MB
2.2.6 吸附剂的解吸脱附再生实验
图12(a)为选取4种脱附剂对Mg-HAP-HA11复合吸附剂进行的脱附实验,从图中可看出,采用甲醇和乙酸(9:1)的混合液的脱附效果最好,首次脱附后对MB的吸附率达到了85.88%.选取甲醇和乙酸(9:1)的混合液作为脱附剂对Mg-HAP-HA11复合吸附剂进行脱附再生实验,结果如图12(b)所示,从图中可看出,在经过3次循环再生试验后,Mg-HAPHA11仍保持有较高的吸附性能,对亚甲基蓝的吸附率维持在60%以上,进行第4次循环再生时,吸附率仅有42.64%,吸附性能明显降低,由此说明,Mg-HAP-HA11对亚甲基蓝的吸附主要为化学吸附,在进行多次解吸脱附循环使用后,吸附性能变差.
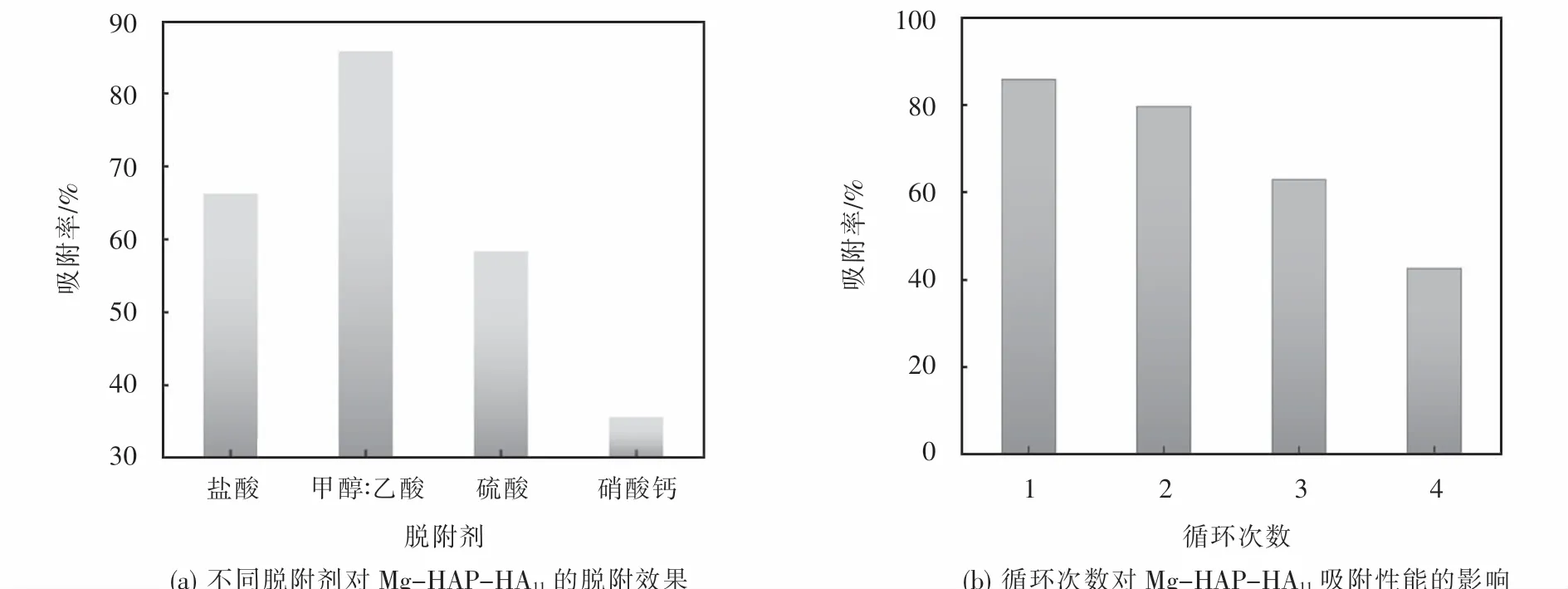
图12 M g-HAP-HA11循环再生实验Fig.12 Cyclic regeneration experiment of Mg-HAP-HA 11
2.3 吸附亚甲基蓝的动力学
HA、Mg-HAP和Mg-HAP-HA113种吸附剂对亚甲基蓝的吸附量随时间的变化关系,如图13所示.从图13中可以看到,在30~120 min内,吸附量的上升速度较快,在120 min后,吸附量增加速度变慢,180 min后吸附量基本不再增加,吸附达到平衡.
将上述实验数据,分别用准一级和准二级动力学方程进行拟合,拟合结果如图14所示,相关参数见表5.从表5可以看出,由准二级动力学方程拟合所得到的线性相关系数R2为0.999 4,大于准一级动力学方程拟合得到的R2,同时由准二级吸附速率方程拟合得到的 qe,c为 128.87 mg/g,与实验所得到的 qe(123.49 mg/g)更为相近.所以该吸附过程更符合准二级动力学模型,准二级动力学模型认为化学吸附为整个吸附过程的决速步骤,因此,Mg-HAPHA11对亚甲基蓝的吸附过程主要为化学吸附.
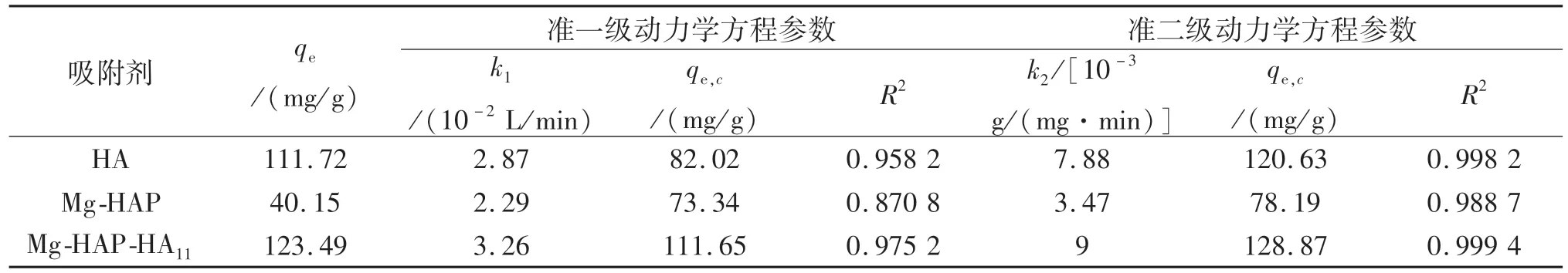
表5 吸附亚甲基蓝的动力学方程回归参数表Tab.5 Regression parameters of kinetic equation for adsorption of MB
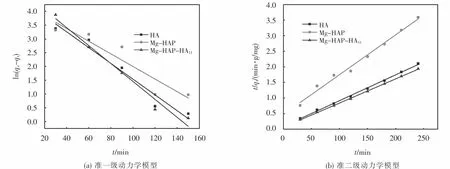
图14 吸附亚甲基蓝的动力学方程回归图Fig.14 Regression of order kinetic equations for adsorption of MB
将上述实验数据用Weber-Morris方程进行拟合,如图15所示.从图15中可看到,Mg-HAP-HA11对亚甲基蓝的吸附结果拟合得到的两条直线并没有经过原点,表明了该吸附过程不是由单个的颗粒内扩散步骤所控制.吸附亚甲基蓝的Weber-Morris内扩散模型参数表见表6.从表6可以看出kid1>kid2,表明吸附开始阶段的吸附速率较快.在吸附开始时,亚甲基蓝首先从溶液中向吸附剂表面扩散,此时溶液中亚甲基蓝浓度较高,扩散阻力较小,并且吸附剂表面有大量的未反应的活性位点,亚甲基蓝分子首先被吸附到吸附剂表面,当吸附剂表面的活性位点被全部占据后,亚甲基蓝开始由吸附剂外表面向吸附剂内部扩散,内表面的吸附开始控制整个吸附步骤.
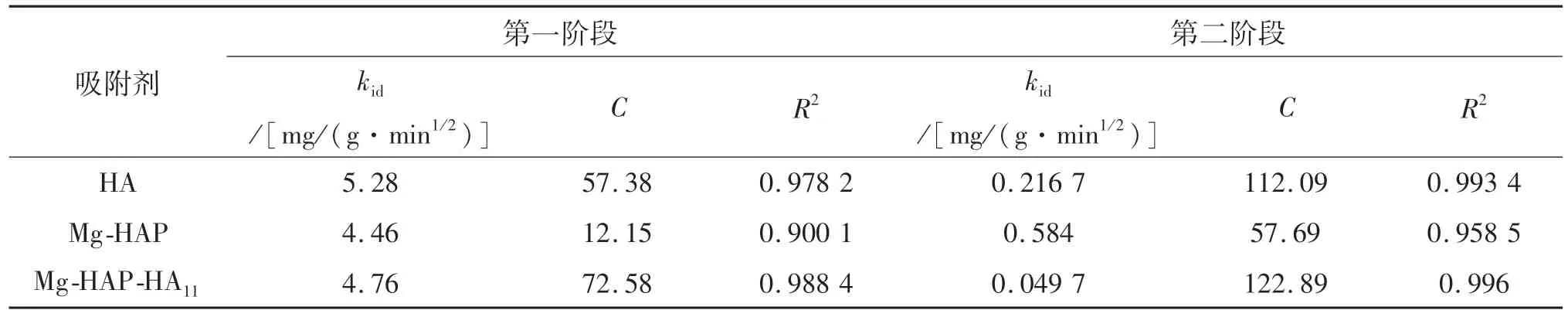
表6 吸附亚甲基蓝的W eber-M orris内扩散模型参数表Tab.6 Parameters of W eber-M orris internal diffusion model for adsorbing methylene blue
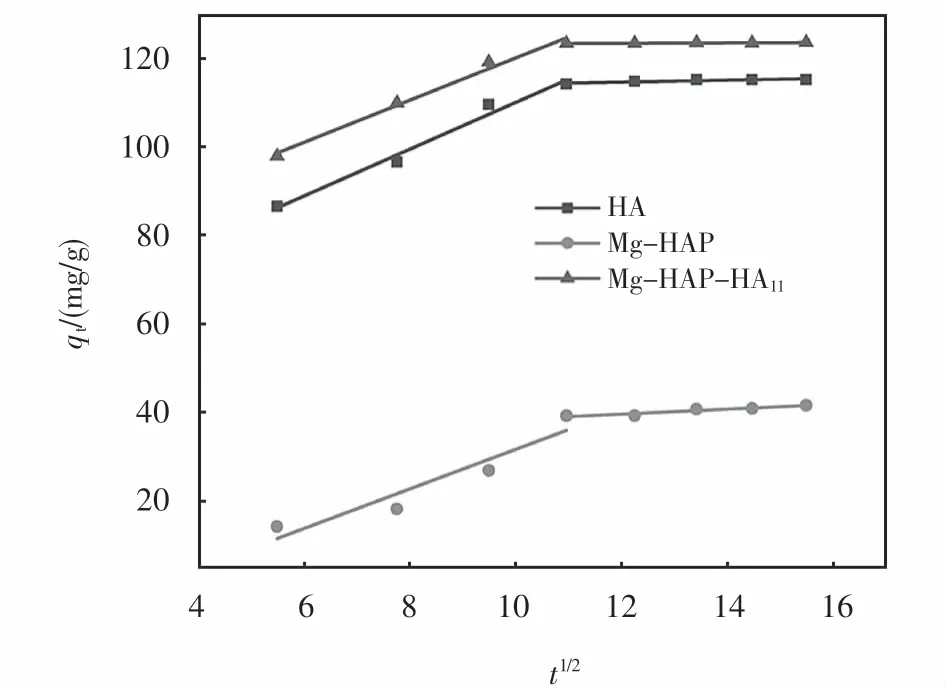
图15 吸附亚甲基蓝的Weber-M orris内扩散模型Fig.15 Regression of order kinetic equations for adsorption of methylene blue
2.4 吸附亚甲基蓝机理分析
为了进一步探讨Mg-HAP-HA11对亚甲基蓝的吸附机理,对吸附亚甲基蓝后的Mg-HAP-HA11复合吸附剂进行了FT-IR以及XRD表征,如图16和图17所示.
2.4.1 FT-IR分析
从图16可以看到,吸附亚甲基蓝后的Mg-HAPHA11复合吸附剂,处于3 420 cm-1处的-OH伸缩振动吸收峰强度变低,峰面积增大并且出现了位移,说明-OH基团参与了吸附.在吸附MB后的红外谱图中出现了两个新的特征峰,1 332 cm-1处,归属于NCH3的伸缩振动,1 230 cm-1处,归属于MB上的C=N伸缩振动,说明MB分子被吸附至Mg-HAP-HA11复合吸附剂表面[20-21].而原本处于 1 050 cm-1、556 cm-1处的PO34-特征吸收峰,785 cm-1芳环CH面外变形振动吸收峰,均有不同程度的位移,说明在对亚甲基蓝的吸附过程中,有较多的基团参与反应.Mg-HAP-HA11表面含有大量的羟基、羧基等活性官能团,在pH为6时,吸附剂表面电负性数值增大,利用静电引力把阳离子染料亚甲基蓝吸附到其表面后,吸附剂表面官能团与亚甲基蓝中的N+会形成氢键吸附[22-23].同时亚甲基蓝可以与吸附剂含有的芳香环结构通过π-π相互作用被吸附[24].
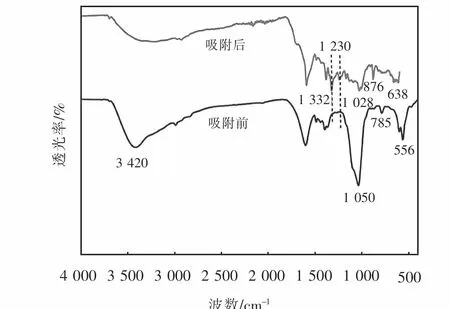
图16 M g-HAP-HA 11吸附亚甲基蓝前后的FT-IR图Fig.16 FT-IR images before and after methylene blue adsorp tion by M g-HAP-HA 11
2.4.2 XRD分析
图17是Mg-HAP-HA11复合吸附剂吸附MB前后的XRD图谱,从图中可以看到,Mg-HAP-HA11复合吸附剂未吸附MB前,在26.2°和32°附近的位置处出现了相对应的羟基磷灰石的衍射峰,而吸附后,仅在25°左右有一个包峰,为腐植酸的晶面衍射峰,峰形较差,表明Mg-HAP-HA11复合吸附剂在吸附MB过程中破坏了原有的晶体结构.这是因为MB是有机染料,在吸附过程中,不会发生离子交换或溶解沉淀等反应而生成新的物相,吸附后并未出现新的特征衍射峰.同时,根据吸附MB前后的FT-IR图分析得到,吸附剂表面官能团与亚甲基蓝中的N+会形成氢键吸附,且MB可以与吸附剂含有的芳香环结构通过π-π相互作用被吸附.综上所述,可以推断出Mg-HAP-HA11对MB的吸附过程主要是吸附剂表面的活性基团起主要作用.
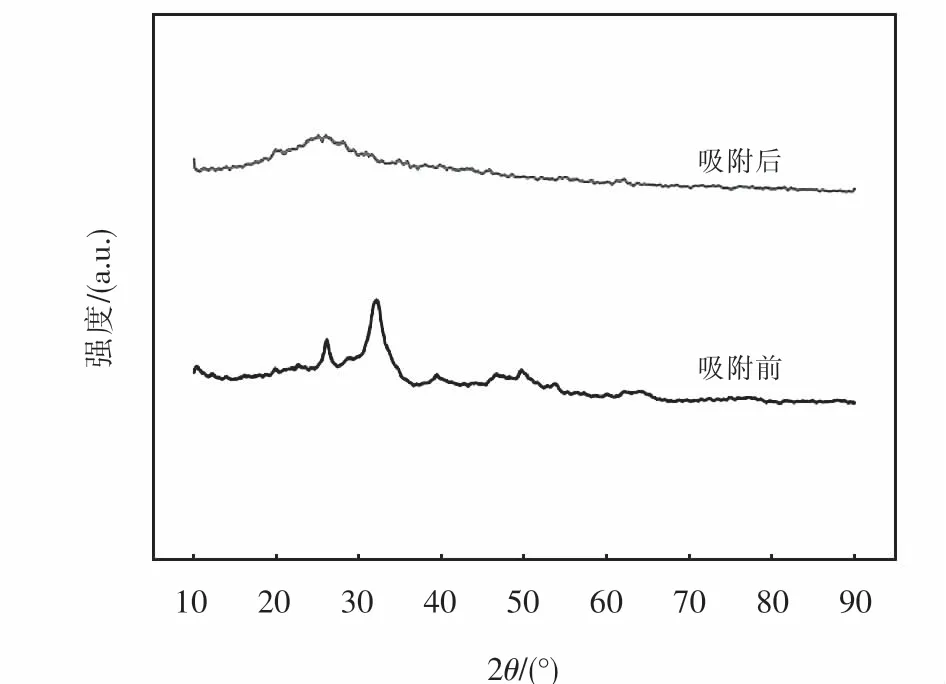
图17 Mg-HAP-HA 11吸附亚甲基蓝前后的XRD图Fig.17 XRD images before and after methylene blue dsorption by M g-HAP-HA11
3 结论
1)Mg-HAP-HA11复合吸附剂对亚甲基蓝的吸附,在120 min时达到吸附平衡,当亚甲基蓝浓度为250 mg/L,吸附剂投加量为0.1 g,温度为35℃,pH值为6时,吸附效果最好,吸附率可达到98.79%,吸附量可达到123.49 mg/g.
2)选用4种脱附剂对Mg-HAP-HA11复合吸附剂进行脱附,其中甲醇和乙酸(9:1)混合液的脱附效果最佳,可有效循环吸附3次.
3)对Mg-HAP-HA11吸附亚甲基蓝的吸附过程进行了动力学分析,Mg-HAP-HA11对亚甲基蓝的吸附符合准二级动力学模型.
4)对吸附亚甲基蓝后的Mg-HAP-HA11进行了XRD以及FT-IR表征,通过分析,可以推断出Mg-HAP-HA11对亚甲基蓝的吸附主要为物理吸附、静电吸附、氢键作用以及π-π键相互作用.

