重组猪链球菌2型溶血素的表达及其溶血活性和致炎作用
王俊捷,王 洋,柳增善
(吉林大学 动物医学学院 人兽共患病研究教育部重点实验室, 吉林 长春 130062)
猪链球菌(Streptococcussuis,S.suis)是一种重要的人兽共患病病原菌[1],其所致感染的暴发给养猪业造成巨大经济损失,且可以传染给人类,从而严重威胁公共卫生安全。在其35个血清型中,2型猪链球菌(S.suistype 2,SS2) 毒力最强,是最常见的患病宿主分离株的血清型[2]。SS2可诱发仔猪脑膜炎、关节炎、败血症、急性死亡等,感染猪链球菌的人可诱发脑膜炎和败血症[3]。SS2有多种毒力因子,其中溶血素(suilysin,SLY)最受关注。SLY是细胞溶素(cytotoxin),属于穿孔毒素(pore-forming toxin),又称攻膜毒素(membrane disrupting type)。SLY属于硫醇活性胆固醇依赖型细胞溶素(cholesterol-dependent cytolysins,CDC)家族。已有试验证明,敲除SLY基因会降低细菌毒力[4-6],细菌毒力和SLY基因的表达量呈正相关[7-8]。此外,在体内体外试验中,使用可以结合胆固醇的化合物会降低猪链球菌毒力[9-14],其机制是抑制SLY聚合作用改善猪链球菌感染进程[15]。目前,关于SLY的研究大多关注于SLY本身、SLY产生的毒性、SLY对于细菌在体内定植和繁殖的作用、SLY在免疫逃逸中的作用和SLY在细菌突破血脑屏障致脑膜炎这一过程和内皮细胞的相互作用等,但是尚未见到关于2型猪链球菌导致的菌血症期间SLY可引起内环境紊乱这一关键过程的报道。我们的前期研究发现,在SS2菌血症期间,菌体释放的SLY可能首先与机体内环境中占有绝对数量的红细胞之间发生相互作用,对机体产生风暴式的破坏,导致细胞炎症的瞬间暴发。然而这一过程并不明晰,为了进一步探究机体的红细胞及其分解产物在SS2感染过程中的作用,我们首先构建了原核表达载体pET28a-SLY,对SLY进行原核表达和纯化,获得了可溶性SLY蛋白。然后,通过定量分析明确了SLY的细胞毒性和溶人红细胞活性。最后,在转录水平对SLY-红细胞互作的致炎症能力进行了初步探究。
1 材料与方法
1.1 菌种和细胞大肠埃希菌BL21(DE3) 购自中国兽医药品监察所;hCMEC/D3细胞由本实验室保存。
1.2 血液样本及主要试剂pET28a-SLY质粒自行构建;溶血试验血液样本由吉林大学第一附属医院惠赠;氯化钠、氯化钾等基础材料购自北京鼎国生物试剂公司;卡那霉素、异丙基-β-D-硫代半乳糖苷(IPTG) 购自宝泰克生物公司;乙二胺四乙酸 (EDTA) 购自海博生物;DMEM/F12培养基干粉和胰酶购自Gibco公司;反转录试剂盒、DEPC水、RNAiso Plus裂解液购自TaKaRa公司;SYBR荧光定量试剂盒购自Roche公司。
1.3 缓冲液的配制
1.3.1Lysis平衡缓冲液 分别称取7.1 g Na2HPO4和17.5 g NaCl加入烧杯中,加入700 mL ddH2O,用玻璃棒搅拌至固体全部溶解后定容体积至1 L (50 mmol/L Na2HPO4,0.3 mol/L NaCl)。
1.3.2250 mmol/L咪唑缓冲液 称取17 g咪唑粉末放入烧杯中,加入700 mL Lysis平衡缓冲液,搅拌至固体溶解后定容体积至1 L。
1.3.310 mmol/L咪唑缓冲液 量取40 mL的250 mmol/L咪唑缓冲液,加入960 mL Lysis平衡缓冲液。
1.4 SLY蛋白的诱导表达与纯化首先使用化学转化法将测序鉴定无误的pET28a-SLY质粒转化入大肠杆菌BL21感受态中,将转化后的菌液涂于含有50 mg/L卡那霉素的抗性LB平板上,过夜培养并挑取单菌落加入LB液体培养基,菌液浑浊后以1%的体积转接入200 mL(1‰贮存浓度卡那霉素抗性)LB液体培养基中,37℃、160 r/min培养至液体D600 nm在0.4~0.6之间,加入终浓度为1 mmol/L 的IPTG,16℃、140 r/min过夜培养。收集菌体,40 mL PBS重悬沉淀,超声破碎至液体澄清接近透明,8 000 r/min离心后取上清加入Ni-NTA亲和层析介质,10 mmol/L咪唑缓冲液洗涤镍柱,250 mmol/L咪唑缓冲液洗脱目的蛋白,SDS-PAGE检测表达产物纯度。
1.5 重组SLY细胞毒性的分析为了更直观地检测重组SLY对人源细胞杀伤活性,使用胰酶将生长状况良好的hCMEC/D3细胞进行消化,多次吹打混匀后将细胞悬液加入6孔细胞培养板中,每孔铺约3×103个细胞,培养48 h至细胞贴满底壁,显微镜观察并拍照。将1 μL 0.8 g/L SLY加入50 μL PBS溶液中,吹打混匀后将总体系缓慢加入每一孔中,轻微振荡混匀液体,将细胞置于37℃下,30 min和2 h后分别观察并拍照。
1.6 重组SLY的细胞毒性及溶血能力分析取1 mL 抗凝血(EDTA抗凝),4℃、3 000 r/min离心10 min,吸去上层血清,用无菌PBS将其补至1 mL,重悬体系;再4℃、3 000 r/min离心10 min,吸去上层液体(洗涤),用无菌PBS将体系补至1 mL,定义这1 mL体系为体积1 mL、浓度为100%的红细胞。使用无菌PBS将红细胞浓度稀释为50%,25%,12.5% 和6.25%,使用Lysis平衡缓冲液将SLY蛋白溶液稀释至质量浓度为0.500 0,0.250 0,0.125 0,0.062 5 mg/L,不同质量浓度蛋白溶液和不同浓度红细胞一一对应,将50 μL SLY加入450 μL红细胞中,37℃避光孵育1 h,不间断温和颠倒混匀,12 000×g离心,取上清测D570 nm值。
1.7 Real-time RT-PCR检测炎性因子IL-8、IL-6、MCP1(单核细胞趋化蛋白1)的转录水平
1.7.1细胞处理 采用hCMEC/D3细胞,给予其不同刺激,检测细胞3种炎症细胞因子的转录水平(IL-6、IL-8、MCP1),证明SLY的特殊作用。Control组加入200 μL PBS;RBC组加入200 μL红细胞(浓度50%);Broken RBC组加入200 μL超声破碎的红细胞(浓度50%);RBC+SLY组将2 mL红细胞(浓度50%)和50 μL 2 mg/L SLY混合,37℃ 1 h后8 000 r/min离心10 min,加入200 μL上清液。
1.7.2RNA的提取及反转录 在作用3,6 h后,每孔分别弃去上清并使用PBS洗涤,加入1 mL RNAiso Plus裂解液,快速匀浆后转移至1.5 mL EP管中。参照RNAiso Plus使用说明书,提取细胞样品中的总RNA,最后重悬于35 μL DEPC水中,检测终浓度并使用DEPC水将不同组别RNA质量浓度稀释为600 mg/L,不足600 mg/L不作处理。每组RNA取1 μL作为模板按照说明书的量依次加入5×DNA Eraser Buffer、g DNA Eraser、RNase Free H2O,42℃、2 min以除去基因组DNA,再依次加入PrimeScript MixⅠ、RT Prime Mix、5×Buffer、RNase Free H2O,混匀后37℃ 15 min、85℃ 5 s进行cDNA的反转录。制备好的cDNA-80℃保存。
1.7.3Real-time RT-PCR 以各样品cDNA为扩增模板,Real-time RT-PCR测定细胞样品中IL-8、IL-6 和MCP1的转录水平,根据待测样品的Ct值,GAPDH为内参对照,采用相对定量法,以2-△△Ct表示样品目的基因的相对表达量,每组模板做3次重复。PCR反应体系:模板1 μL,上、下游引物(10 μmol/L)各0.8 μL,2×TB Green Premix Ex Taq DNA 聚合酶10 μL,ddH2O补足至20 μL。反应程序:94℃预变性30 s;94℃ 15 s;60℃ 32 s;反应42个循环,引物序列如表1。
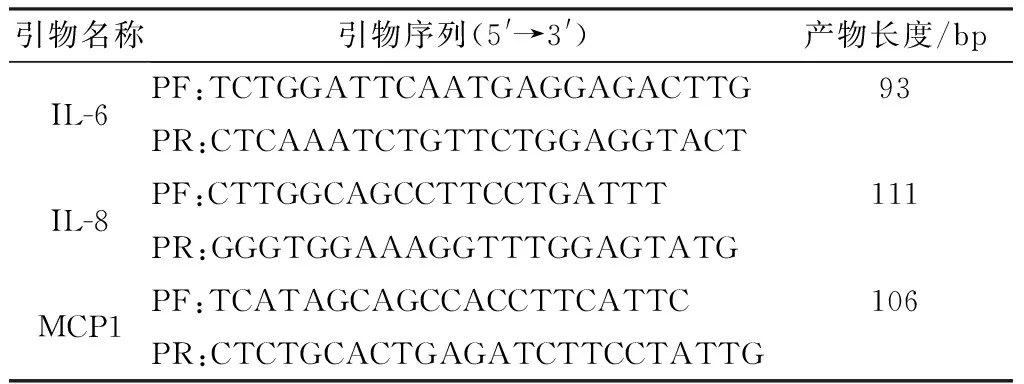
表1 Real-time RT-PCR引物序列及产物长度
2 结果
2.1 SLY基因克隆及载体构建首先基于几种熟知猪链球菌SC19、P1/7、05ZYH33、BM407、ST1菌株SLY基因比对,完成表达载体中SLY基因的同源性分析;然后针对同源部分序列设计引物,以猪链球菌SC19基因组作为模板,对SLY基因进行扩增,将其连入表达载体pET-28a多克隆位点。然后对连接成功pET28a-SLY载体进行测序,将SLY基因进行Blast,在克隆菌株中,将同源性不低于99.15%的认定为保守序列,具有普适性。
2.2 SLY蛋白的表达纯化SDS-PAGE结果显示(图1),经过1 mmol/L IPTG诱导,蛋白相对分子质量在70 ~55 kDa之间,SLY蛋白位于大约60 kDa 的位置,且SLY蛋白为可溶性表达,破碎离心后几乎全部留存于上清之中,洗脱的目的蛋白无杂带,特异性强,多次表达纯化证明在16,37℃的诱导温度下都可以得到相同结果,纯化的蛋白较为稳定。
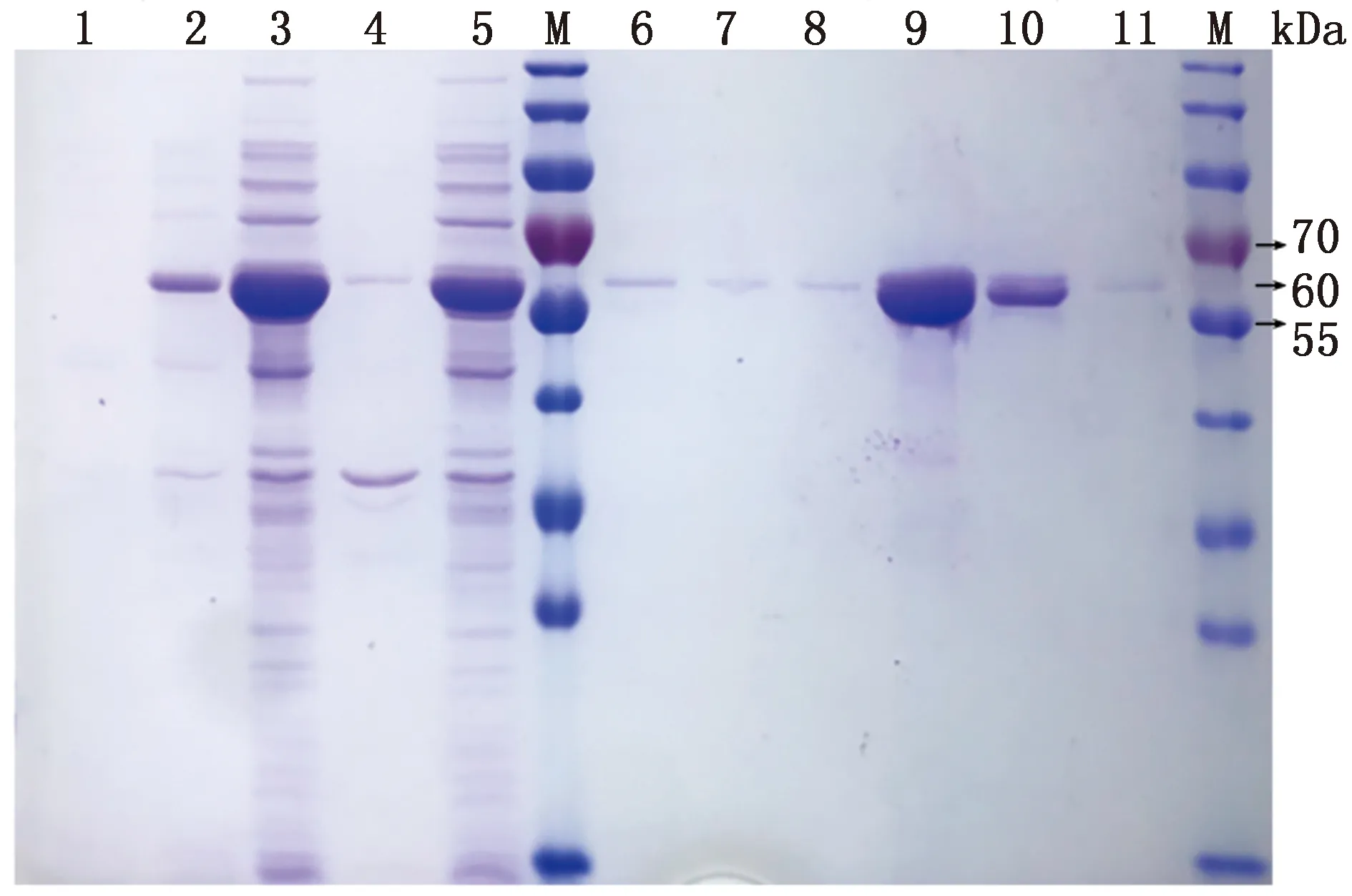
M.蛋白Marker;1.未诱导;2.诱导后;3.上清;4.沉淀;5.流出液;6~8.10 mmol/L咪唑缓冲液洗脱;9~11.250 mmol/L咪唑缓冲液洗脱
2.3 重组SLY蛋白的细胞毒性显微镜观察结果表明,铺满底壁的正常hCMEC/D3细胞为梭形(图2A);当于2 mL总体积培养基中加入1 μL 0.8 g/L SLY,即SLY质量浓度为0.4 mg/L、37℃作用30 min 后,细胞发生皱缩,开始有部分细胞漂浮,由于细胞不再铺满底壁而使视野颜色发生变化(图2B);当温度为37℃且作用时间升至2 h时,所有细胞发生破碎,碎片漂浮,无细胞存活,细胞残骸的瘢痕留于细胞板底壁(图2C)。该结果表明,重组SLY蛋白具有极高的细胞杀伤活性。

A.不处理正常生长内皮细胞;B.加入SLY 30 min后的内皮细胞;C.加入SLY 2 h后的内皮细胞
2.4 重组SLY蛋白的溶血活性在溶血试验中,沉淀为未反应的人红细胞,上清红色深度和血红蛋白浓度呈正相关,当不加入SLY时,红细胞几乎不发生溶血(图3);在分光光度法测定重组SLY对人红细胞的溶血活性试验中,使用离心后上清液D570 nm的值代表血红蛋白浓度,即溶血反应程度,D570 nm的值和反应程度呈正相关(表2)。溶血分析结果表明,12.5 ng SLY在37℃ 1 h条件下可以使450 μL浓度为12.5%的红细胞溶解完全,即0.2 mg/L重组SLY对人血红细胞具有完全溶解的能力。

图3 SLY溶血试验结果
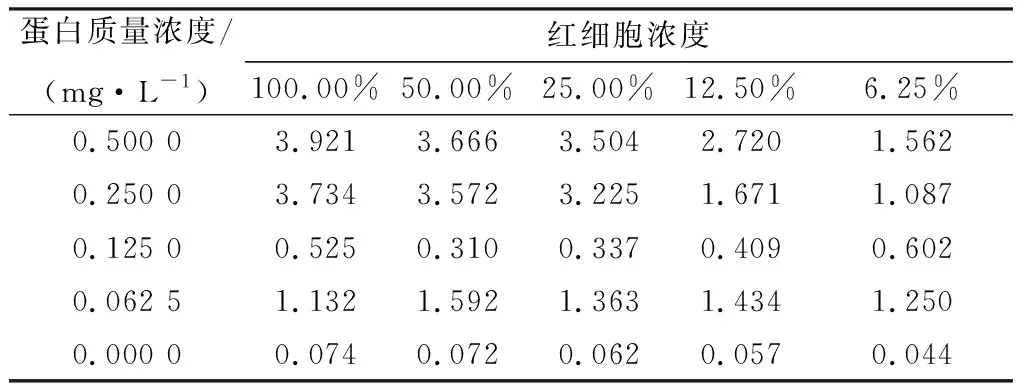
表2 上清D570 nm值
2.5 重组SLY刺激hCMEC/D3细胞产生炎症因子不同红细胞处理hCMEC/D3细胞试验组(红细胞组、红细胞超声破碎组),IL-6、IL-8的转录水平具有相同趋势,即单纯在hCMEC/D3细胞反应体系中加入红细胞或是红细胞破碎后的释放产物,无论是3 h还是6 h都会使IL-6和IL-8的转录水平升高,SLY+RBC组具有同样的作用,且效果极为显著(图4,5)。

***示P<0.001。下同
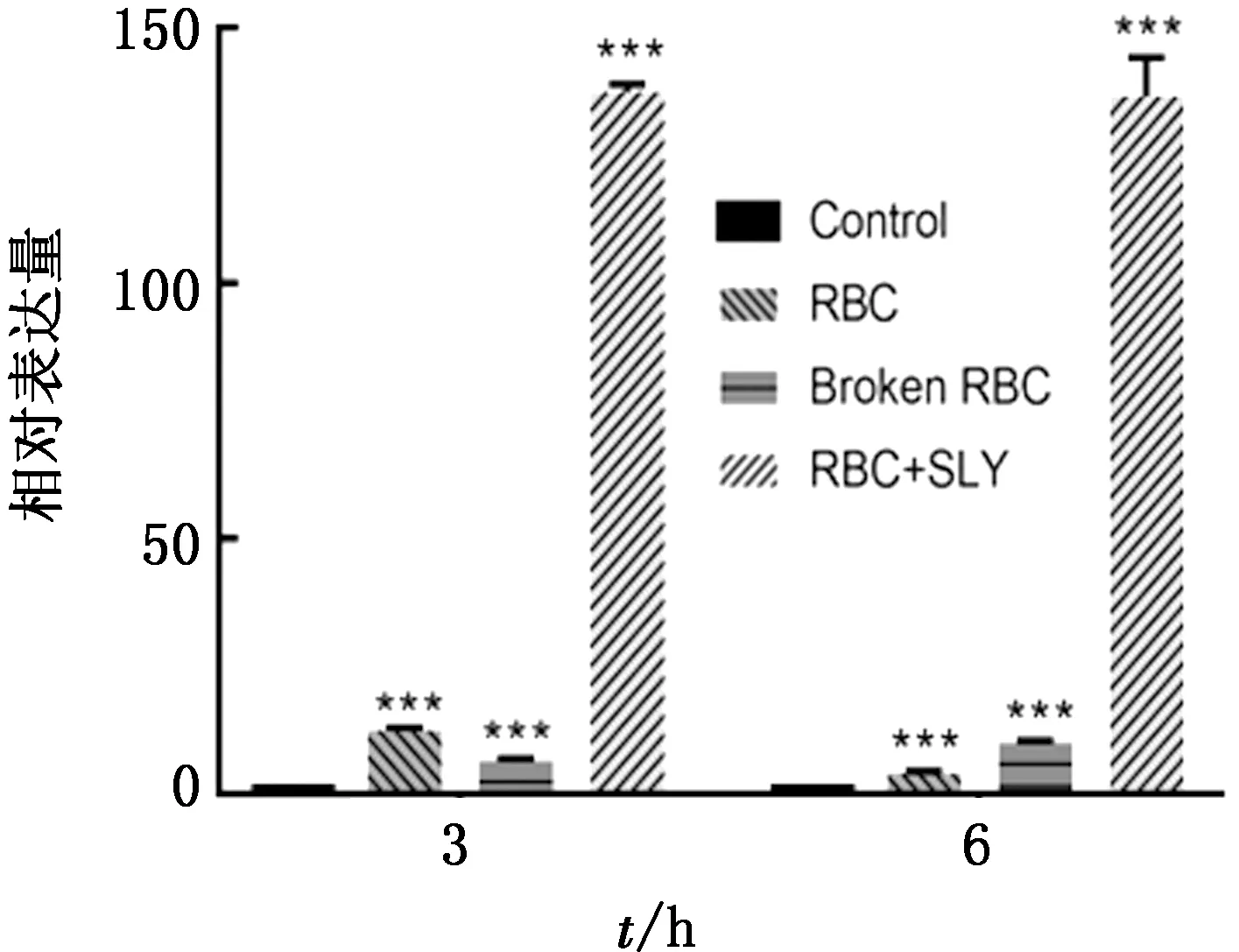
图5 IL-8转录水平
重组SLY破碎完整红细胞(非超声法破碎)离心后取上清加入到hCMEC/D3细胞反应体系中,IL-6的mRNA表达量为对照组的80倍以上,IL-8的mRNA表达量为对照组的100倍以上,该结果显著高于红细胞组或者红细胞超声破碎组,这表明与物理方法破碎红细胞相比,SLY具有某种独特的促红细胞诱导炎症作用。
MCP1的结果和IL-6、IL-8不同,各试验组(红细胞组、红细胞超声破碎组、重组SLY处理红细胞组)最高的转录水平也不会超过15倍(图6),结果表明在内皮细胞炎症发生机制中,MCP1和IL-6、IL-8可能是由不同的通路和诱因介导。
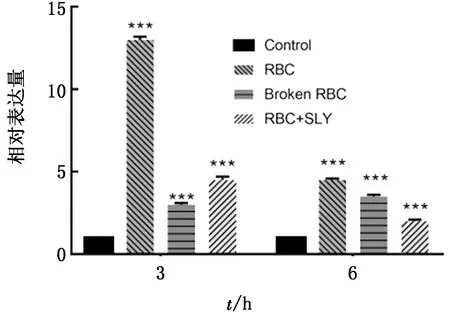
图6 MCP1转录水平
3 讨论
S.suisSLY作为猪链球菌最重要毒力因子之一,其功能已被大量文献报道,但对于SLY基因和SS2的致病性之间的必然关系,尚无确切证明。原核表达的SLY由497个氨基酸组成,理论相对分子质量为55 kDa,而从本试验SDS凝胶中(图 1)可以看出其实际为60 kDa左右,SLY基因非常保守,SC19、P1/7、05ZYH33、BM407、ST1这些经典菌株中SLY基因具有很高的同源性。有研究表明,没有致病性的S.suis也表达SLY基因,这使得我们重新考量SLY基因与致病性的关系。重组SLY蛋白的毒性表现在细胞溶性,即对于细胞膜的破坏,试验证明SLY破坏细胞膜具有通适性,对所有种类的细胞都有作用,这表明在机体感染S.suis造成菌血症后,由于SLY的存在,内环境将会十分混乱。据报道,SLY重组蛋白质量浓度为1~5 mg/L可检测细胞毒性,32 mg/L可进行LDH试验,0.5 g/L可检测细胞毒性、融合、脱颗粒[16-17]。而本试验重组蛋白质量浓度为0.4 mg/L时,SLY会使hCMEC/D3细胞完全死亡,尾静脉注射2 μg重组SLY蛋白对于C57BL6/J小鼠具有100%的致死率,由此可见本试验重组的SLY蛋白具有较高的生物活性,且SLY对于人红细胞的作用量化为1 μg,重组 SLY在37℃ 1 h条件下可以使2.25×1010个红细胞溶解完全。
据报道,SLY有刺激宿主产生强烈炎症反应以及影响各趋化因子水平升高的现象[18],因此在本试验中着重关注了hCMEC/D3不同试验组中IL-6、IL-8和MCP1的转录水平变化。RT-PCR结果显示,MCP1的转录水平显著升高,除此之外,内皮细胞的IL-6和IL-8,在3,6 h的转录水平都极显著升高,分别达到80倍和100倍以上,证明了红细胞可能介导了SLY刺激机体产生炎症反应过程。此外我们还发现单纯红细胞组也会使内皮细胞的炎症转录升高,这种现象可能是因为在试验过程中发生了红细胞的自然破碎,这也证明了红细胞释放的内容物会诱使内皮细胞产生炎症反应。
本试验用SS2可能的重要毒力因子SLY基因原核表达SLY蛋白,通过溶血试验等鉴定其具有很高的生物活性,并在体外试验中初步证明了SLY通过SLY-红细胞互作的方式在内皮细胞的炎症激活上有独特作用。本试验对于SLY介导的SS2感染机制探索和开发抗SS2药物具有重要意义,也为后续深入开展体内外研究奠定了基础。

