1株动物双歧杆菌的分离鉴定及其对小鼠溃疡性结肠炎的调理作用
陈甜甜,谢全喜,张海霞,孙尹双,白冬红
(1.山东宝来利来生物工程股份有限公司 山东省动物微生态制剂重点实验室,山东 泰安 271000;2.山东农业大学 校医院,山东 泰安 271000)
溃疡性结肠炎(ulcerative colitis,UC)是一种慢性肠道疾病,病因尚不清楚[1],有人认为是遗传、环境和个人相关因素引起的[2-3]。也有研究认为,肠道中的微生物群由于宿主的饮食、抗生素的使用或疾病引起的菌群失调,破坏了机体免疫而参与了肠炎的发病,导致炎症的发生[4]。传统的UC治疗方案主要是抑制肠道炎症,采取的治疗制剂主要有5-氨基水杨酸复合物、皮质类固醇和一些免疫抑制剂[5]。然而,由于肠道中有害菌的持续存在,这些治疗方法治标不治本,而且具有很大的不良反应。因此,从理论上来说,选择直接调节肠道微生物的治疗方法代替传统疗方法对UC的治疗更直接、更有效[6-8]。益生菌是正常动物肠道菌群的有益微生物,能够定植于肠道中,维持肠道微生态平衡,调节免疫反应、抑制炎症反应[9]、增强肠道黏膜屏障功能[10],对肠道炎症有较好的预防和治疗作用[11-12]。目前,已知的益生菌多为细菌,大多为乳酸菌属和双歧杆菌属[13]。双歧杆菌最早是在1899年从母乳喂养的婴儿粪便中分离出来的,是人类肠道中的固有菌群。动物双歧杆菌是双歧杆菌的一个亚种[13],能够增强肠道屏障功能,提高机体免疫力,抑制病原体的生长,显著改善肠道功能,尤其对腹泻具有良好的缓解作用。本试验从3个月婴儿粪便中分离出1株双歧杆菌,对其进行鉴定并评价该菌对硫酸葡聚糖钠盐(dextransulfatesodium,DSS)引起的小鼠UC的预防治疗作用。
1 材料与方法
1.1 培养基及主要试剂TPY液体培养基、TPY固体培养基、革兰染色液、细菌微量生化鉴定管购自青岛海博生物技术有限公司;细菌基因组 DNA提取试剂盒购自天根生化科技有限公司;TNF-α、IL-6 ELISA试剂盒购自南京建成生物工程研究所。DSS(Mr:36 000~50 000)购自上海翊圣生物科技有限公司。昆明系小鼠,雌性,体质量18~20 g,购自济南朋悦实验动物繁育有限公司[动物合格证号SCXK(鲁)20140007]。
1.2 双歧杆菌的分离培养取3月龄健康婴儿新鲜粪便5 g,将其溶于45 mL无菌生理盐水中并充分混匀,然后用生理盐水进行梯度稀释,稀释至10-5,利用平板划线法在TPY培养基上划线,置于37℃厌氧环境下过夜培养。次日,取典型疑似菌落进行纯化培养,在TPY固体培养基上纯化3~4次得到单菌落。
1.3 菌种的鉴定取纯化后的单菌落涂片,革兰染色并镜检观察。取菌液用DNA提取试剂盒进行基因组DNA的提取。用16S RNA通用引物进行PCR扩增,扩增后的产物交于上海生工生物工程股份有限公司测序。测序结果与GenBank数据库进行比对。
1.4 生化试验用接种针从平板上挑取纯化的单个菌落到生化管中,37℃厌氧培养48 h。观察对纤维二糖、麦芽糖、甘露醇、水杨苷、山梨醇、蔗糖、棉子糖、菊糖和乳糖的发酵情况,与GB4789.34-2016双歧杆菌菌种的生化反应进行比对。
1.5 生长曲线的测定将分离并鉴定的菌株按2%的接种量分别接入TPY液体培养基中,37℃恒温培养24 h,每4 h取样利用梯度稀释法,取1 mL菌液至9 mL生理盐水中充分振荡混匀,从中再取1 mL至9 mL生理盐水中振荡混匀,由此稀释至10-7,取1 mL稀释倍数为107的菌液至灭菌玻璃平皿中,加入LB固体培养基,37℃培养24 h计数,根据计数结果绘制细菌生长曲线。
1.6 产酸能力测定将分离并鉴定的菌株按2%的接种量分别接入TPY液体培养基中,37℃恒温培养,每隔2 h测定不同菌株发酵液pH,绘制的产酸速率曲线是不同发酵时间(h)对应发酵液pH值的变化。
1.7 菌粉的制备将培养24 h的液体发酵液离心取菌泥,加入适量冻干保护剂进行冷冻干燥。冻干的菌粉粉碎过80目筛。取混合均匀的菌粉1 g,采用倍比稀释的方法进行计数,菌粉用麦芽糊精稀释到1×109CFU/g,将其置于-20℃冰箱保存。
1.8 对DSS引起结肠炎的作用购买的小鼠适应性饲喂1~2 d,将初始体质量约21 g的昆明小鼠随机分为3组,分别为空白对照组、模型组、菌粉组,每组10只。空白对照组和模型组灌胃纯净水每只每天0.5 mL,菌粉组小鼠按每只每天给予4×107CFU/g的NFTY9菌粉,用纯净水溶解菌粉进行灌胃,每天每只0.5 mL,连续灌胃14 d。第15天,模型组和菌粉组将饮用水更换为5%DSS,连续饮用7 d,空白对照组正常饮水,同时菌粉组仍然给予4×107CFU/g菌粉。每天观察小鼠体质量变化、腹泻和便血等情况,7 d后测定结肠长度、观察十二指肠和结肠肠道HE染色切片、结肠组织中TNF-α和IL-6含量。数据均采用SPSS 16.0,One-Way ANOVA进行分析。在试验期间,按照DAI(疾病指数)评分标准每天对各组小鼠进行评分。DAI评分标准为:体质量:0 分(无失重)、1 分(失重1%~5%)、2 分(失重5%~10%)、3 分(失重10%~20%)和4 分(失重>20%);大便稠度:0 分(正常)、2 分(稀便)和4 分(腹泻);便血:0 分(无血)、4 分(大出血,肛门周围有血)。数据采用SPSS 16.0T-test分析。
2 结果
2.1 菌落形态在TPY固体平板上单菌落划线37℃ 厌氧培养48 h后,该菌落呈白色圆形单菌落,表面湿润光滑。经革兰染色镜检发现(图1),该菌为革兰阳性菌,菌体有的呈一头大的棒球杆状、有的为两头粗大的“V”字型,该菌被命名为NFTY9,被保藏于中国典型培养物保藏中心[14],保藏编号为CCTCC NO:M2019454。
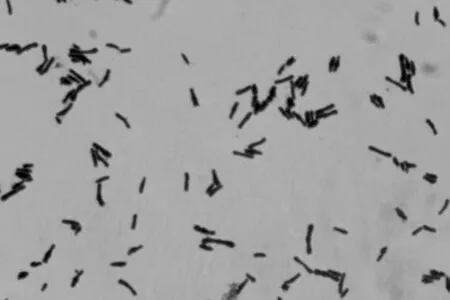
图1 菌体形态(×1 000)
2.2 测序结果PCR产物经测序在NCBI上BLAST结果显示,NFTY9的16S RNA与动物双歧杆菌乳亚种基因的同源性为99.4%(图2,3),判定该菌株为动物双歧杆菌。

图2 同源性分析结果

图3 系统进化树
2.3 生化试验结果棉子糖、乳糖、蔗糖、麦芽糖、水杨苷发酵后发酵液体颜色变黄,结果为阳性,菊糖、甘露醇、纤维二糖和山梨醇发酵后发酵液体变为灰紫色,与国标GB4789.34-2016中双歧杆菌生化反应结果一致。
2.4 生长曲线和产酸曲线的测定结果每隔4 h取样测定NFTY9的生物量和pH值,由图4,5可知,该菌在4~8 h呈对数期生长,发酵到12 h以后到达平台期。培养24 h的生物量能达到1.6×109CFU/mL。发酵液pH值由初始的6.5发酵24 h后逐渐降到3.46。生物量与发酵液pH值呈反比关系。

图4 NFTY9生长曲线
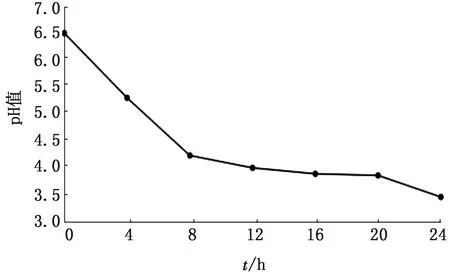
图5 NFTY9产酸曲线
2.5 动物试验结果
2.5.1体质量变化 如图6所示,随着日龄的增加,空白对照组小鼠体质量在逐渐上升。模型组在DSS诱导后的第3 天,体质量出现显著下降现象;在第3~7 天体质量均显著低于空白对照组,下降不明显。NFTY9组小鼠在灌胃NFTY9菌的14 d后体质量与空白对照组比较差异不显著,在饮用DSS后体质量在第3天略微有所下降,但和对照组比较差异不显著;在饮用DSS的7 d中,小鼠体质量变化不大。

图6 小鼠体质量变化趋势
2.5.2DAI评分 饮用DSS后第 1天,模型组和NFTY9组小鼠体质量和粪便均无明显变化。第2天,模型组普遍稀便,第3天出现便血现象,之后便血小鼠数量持续增加,第4~7天血便率均达到40%;NFTY9组小鼠在饮用DSS后第2天无稀便现象,第3天出现少量稀便,第4~7天血便率均为10%,体质量在饮用DSS期间变化不明显。从表1可以看出统计各组小鼠体质量和粪便评分情况,在饮用DSS后第2天到第4天模型组DAI评分极显著高于NFTY9组(P<0.01),第5天到第7天模型组DAI评分显著高于NFTY9组(P<0.05)。

表1 小鼠DAI评分
2.5.3结肠中TNF-α含量变化 模型组小鼠结肠组织中TNF-α显著性的高于空白对照组(P<0.05)(图7),NFTY9组小鼠结肠中TNF-α显著低于模型组(P<0.05),与空白组比较差异不显著(P>0.05)。
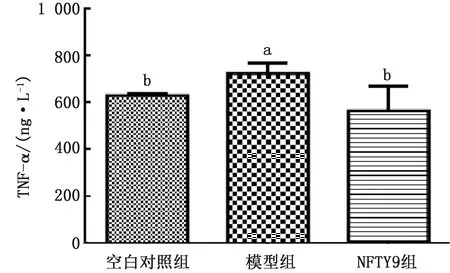
相同字母表示差异不显著(P>0.05);不同字母差异显著(P<0.05)。下同
2.5.4结肠中IL-6含量变化 模型组小鼠结肠组织中IL-6显著性的高于空白对照组(P<0.05)(图8),NFTY9组小鼠结肠中IL-6显著低于模型组(P<0.05),但仍高于空白组,且差异显著(P<0.05)。

图8 结肠组织中IL-6含量
2.5.5结肠长度变化情况 模型组结肠长度较空白对照组显著变短(P<0.05);饲喂NFTY9菌粉结肠长度虽然显著短于空白对照组,但其显著长于模型组,说明NFTY9可显著性改善因DSS引起的结肠变短现象(表2)。

表2 小鼠结肠长度 cm
2.5.6结肠组织病理切片观察结果 小鼠结肠组织病理切片HE 染色结果(图9)显示,空白对照组小鼠结肠组织结构完整,未见溃疡、坏死,腺体排列整齐完整;模型组低倍镜下箭头处肠黏膜上皮细胞坏死、脱落,黏膜固有层内组织变性、坏死,肠道隐窝消失,损伤呈多灶性。NFTY9组小鼠结肠组织的结构大体完整,肠腺大致排列整齐,固有层及黏膜下层淋巴细胞浸润较模型组减少。

图9 小鼠结肠组织病例切片(×40)
2.5.7十二指肠绒毛长度及隐窝深度 饮用DSS后,十二指肠绒毛变短,隐窝深度变浅,肠绒毛脱落严重;NFTY9组小鼠十二指肠绒毛与空白组长度差异不显著,说明NFTY9具有修复肠绒毛的作用(表3,图10)。

表3 小鼠十二指肠绒毛长度和隐窝深度 mm
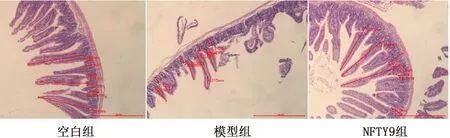
图10 十二指肠长度和隐窝深度(×40)
3 讨论
UC是一种常见的消化系统疾病,常常引起结肠和直肠的以黏膜和黏膜下层浸润为主的慢性肠道炎症。由DSS诱导的小鼠结肠炎模型因与人类UC病理变化较为相似,常常作为研究UC的主要动物模型[15]。DSS对肠道有直接毒性作用,导致广泛的隐窝和上皮细胞损伤引起肠上皮的糜烂、肠道黏膜屏障受到破坏[16]。本试验采用昆明小鼠自由饮用含5% DSS的纯净水,在饮用第3天时,模型组出现小鼠便血现象,到第4天血便率高达40%。并且,DSS诱导的模型小鼠体质量在第3天显著减轻,软便、稀便、血便现象严重。结肠长度显著变短,肠道黏膜上皮结构不完整,绒毛变短,腺体隐窝结构消失。DSS诱导处理的动物会出现结肠组织髓过氧化物酶(MPO)活性显著升高,促炎细胞因子IL-1β、IL-6、TNF-α水平显著升高[15-17]现象。
结肠炎患者肠道内微生物菌群与健康人群不同[18],双歧杆菌、球菌科、梭状芽胞杆菌和类杆菌减少,有害菌增多,肠道菌群失调与宿主之间的平衡被打破,先天和适应性免疫系统被激活,导致慢性炎症。据报道,酪酸梭状芽孢杆菌可以预防溃疡性结肠炎并改变UC患者的微生物群[19]。临床试验结果显示,补充长双歧杆菌536(BB536)对日本UC患者病情有缓解作用[20]。多种研究证明,益生菌可以缓解肠炎症状,可以作为一种替代缓解肠炎症状的药物[21]。这些研究在临床上显示了益生菌对肠炎的缓解作用,但益生菌发挥其对肠炎作用的生物学机制仍然不太明确。
有研究认为,乳酸菌和双歧杆菌作为结肠道的固有菌群,可抑制炎症或激活先天免疫,黏附并定殖于肠道中,恢复宿主肠道微生物群,进而缓解肠道炎症[22-24]。据报道,双歧杆菌ATCC 29521改变了小鼠的肠道微生物群,显著减轻了由DSS引起的急性结肠炎的严重程度[25]。服用复合益生菌VSL#3后,肠道黏膜中双歧杆菌增加,说明双歧杆菌可以定植于肠道,进而调节有益菌和有害菌的比例缓解炎症[26]。婴儿双歧杆菌也被证明了对黏液杯状细胞和上皮细胞层具有保护作用[27]。本试验结果表明,通过提前饲喂小鼠双歧杆菌NFTY9 菌粉14 d,推迟了小鼠出现腹泻和便血的时间,显著降低了小鼠的便血率。推测缓解肠炎症状的原因可能在造模前NFTY9已经定殖于小鼠肠道黏膜上,NFTY9在肠黏膜上生长后,酸化了肠道内环境,同时激活了动物机体的免疫系统,在肠黏膜被外界因素破坏时,能够及时抑制有害菌的生长,保护肠道上皮细胞,维持肠道屏障的完整性,进而减缓炎症的发生。
益生菌还可以调控NF-κB信号通路,调节肠道的炎症反应。研究表明,UC 患者上皮细胞中NF-κB 过度表达,并且细胞核中 NF-κB表达水平明显高于细胞浆和细胞质,诱导产生 IL-1β、INF-γ、TNF-α炎症细胞因子,乳酸菌L.plantarumHY115 和L.brevisHY7401通过抑制I-κB磷酸化而抑制NF-κB途径,从而抑制IL-1β、TNF-α和IFN-γ等的表达[28]。双歧杆菌还可以通过调节促凋亡细胞因子的表达来提高肠细胞的存活率。使用BB-02的小鼠结肠炎症状有所减轻,中性粒细胞浸润和KC/CXCL-1水平降低,肠上皮细胞凋亡减少,TNF-α水平降低,改善了炎症引起的肠道通透性的增加[29]。口服动物双歧杆菌BB12可显著改善DSS诱导的结肠炎,同时降低TNF-α介导的细胞凋亡[30]。本试验结果表明,NFTY9也可以显著降低结肠中炎性因子TNF-α和IL-6的含量,推测NFTY9可通过NF-κB信号通路调节肠道炎症反应,通过降低TNF-α,减少肠道细胞的凋亡,从而减轻了DSS诱导的肠道组织的病变,起到了缓解结肠炎的作用。本试验分离的动物双歧杆菌NFTY9在试验中表现出良好的预防缓解结肠炎的作用,为溃疡性结肠炎的预防性治疗和调理提供了参考依据,但该菌改善结肠炎的具体作用机理还不清楚,还需要进一步的研究。

