诱导痰CTGF mRNA、炎性因子及肺功能与呼吸窘迫综合征早产儿危险分级及预后的相关性分析
吉翔,秦巧稚,孙雪,华芸
(1.江苏省扬州市第二人民医院·苏北人民医院北区医院检验科; 2.江苏省苏北人民医院儿科,江苏 扬州 225007)
呼吸窘迫综合征为一种常见呼吸系统疾病,由非心源性肺水肿引起,其主要表现为呼吸窘迫及低血氧症,并且其发病急,且患儿病程进程较快,具备较高发病率及死亡率,对新生儿生命安全造成严重威胁[1-4]。而早产儿肺部组织发育不完全,故缺乏足够肺表面活性物质,则更易发生呼吸窘迫综合征。患儿发病后,其肺血管内皮通透性及血管外肺水增加,则造成机体炎性因子大量被释放,从而将进一步加剧患儿病情。其次,患儿发病后,临床表现为进程性呼吸困难,则患儿肺功能将受到影响。另外,有研究表明结缔组织生长因子(connective tissue growth factor,CTGF)为参与气道重塑关键因素,并且患儿患病后,则将造成CTGF mRNA水平上升[5]。故本次研究将探讨诱导痰CTGF mRNA、炎性因子及肺功能对呼吸窘迫综合征早产儿危险分级及预后的相关性分析,以期改善患儿预后。
1 资料与方法
1.1 一般资料
选取2020年10月至2022年4月在江苏省苏北人民医院就诊的患呼吸窘迫综合征早产儿80例,分为轻度组(n=28)、中度组(n=38)及重度组(n=14),同时根据患儿预后状况划分为预后良好组(n=56)及预后不良组(n=24)。纳入标准:(1)患儿家属知情同意;(2)患儿为早产儿;(3)符合呼吸窘迫综合征诊断标准;(4)急性起病。排除标准:(1)患有先天性肺部疾病;(2)患有其他免疫系统疾病;(3)中途转院而缺乏临床结果者。诊断标准参考《新生儿急性呼吸窘迫综合征"蒙特勒标准(2017年版)》[6]:(1)明确或出现可疑临床损伤后,1周内急性发作;(2)排除患儿因先天畸形引发的呼吸困难;(3)经肺部影像学分析,呈现双侧弥散性不规则透明度降低、渗出或白肺;(4)经心脏超声,排除因先天性心脏疾病引发的肺水肿;(5)患儿出生24 h内出现呼吸窘迫症状。根据患儿氧合指数进行症状程度划分[4]:(1)轻度:患儿氧合指数≥201 mmHg且≤300 mmHg;(2)中度:患儿氧合指数≥101 mmHg且≤200 mmHg;(3)重度:患儿氧合指数≤100 mmHg。预后良好:患儿经治疗后症状减轻或恢复正常;预后不良:患儿经治疗后症状未发生变化或持续加重。收集性别、胎龄、围产期是否窒息、是否发生溶血、预后情况、生产方式、二氧化碳分压、动脉血氧分压、是否为高龄孕妇、是否发生妊娠高血压及是否发生妊娠糖尿病等一般资料。见表1。研究经本院伦理委员会批准同意下进行。
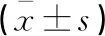
表1 各组一般资料比较
1.2 方法
1.2.1 前期准备诱导痰 选用3%高渗氯化钠溶液,对纳入所有患儿进行雾化操作,操作时间15 min;随即采用矿泉水对患儿进行漱口操作,直至患儿咳出痰液;将痰液收集,并置于消毒平皿中,做好标记后置于4 ℃下保存备用;将备用痰液取出,采用Eppendorf移液枪移取其中透明且浓度较高溶液,随后加入0.1%二硫苏糖醇试剂,加入量为所取痰液量的4倍;充分震荡后,在37 ℃恒温水浴加热10 min,随即过滤;静置后离心15 min,3 000 rpm,取上清液置于-80 ℃下保存备用。
1.2.2 检测方案及指标 采用RT-qPCR法检测CTGF mRNA:取出备用上清液,采用总RNA提取试剂盒(北京索莱宝科技有限公司,货号:R1200)进行总RNA提取操作,并采用微量紫外分光光度计测量总RNA纯度及浓度;若浓度>4 μg/mL,且D260/280为1.8~2.0,则所取总RNA符合测量标准;随即进行逆转录操作,采用M-MuLV第一链cDNA合成试剂盒(北京百奥莱博科技有限公司,货号:GS0147),在42 ℃下反应50 min,随即以RNA为模板进行逆转录操作,从而合成cDNA,随即在70 ℃下反应70 min,并终止反应;随后进行PCR扩增,产物长度213 bp,正向引物(5′-3′):CACCGCACAGAACCACCACAC,反向引物(5′-3′):GGCAGGCACAGGTCTTGATGAAC,扩增条件:先于95 ℃下预变热3 min,随后再于94 ℃下变性20 s,之后于56 ℃下退火40 s,并延伸30 s,重复次操作39个循环;经3次PCR操作后,取其平均值。以GAPDH为内参,采用2-△△Ct法计算CTGF mRNA相对表达量。
炎性因子检测:收集所有患儿空腹静脉血3 mL,静置后离心10 min,3 000 rpm,随即收集上清液置于-30 ℃下保存备用;取出待测上清液,采用BS-1101 ELISA酶标分析仪(临沂正衡化玻仪器有限公司)测定人转化生长因子β1(TGF-β1)含量:取酶标包被板进行标准液稀释,并设置空白孔及待测样品孔后加样,随后进行温育、配液及洗涤操作,完成后,除空白孔外均加入酶标试剂,再次温育及洗涤后,加入显色剂,避光显色15 min后加入终止液,15 min后采用酶标分析仪检测450 nm处吸光度值。白细胞介素6(IL-6)、肿瘤坏死因子(TNF-α)用ELISA测量试剂盒(上海酶联生物科技有限公司)测量。
肺功能测量:采用耶格肺功能仪PAED(上海医疗设备有限公司)检测所有纳入患儿达峰时间(TPTEF)、达峰容积比(VPEF/VE)及呼吸峰流速(PEF),给予患儿经鼻间歇正压通气,并在初始参数中将吸入氧浓度设为0.20%~0.30%,呼吸频率为40~60次/min,吸气时间为0.40 s,呼气末正压为0.392~0.588 kPa。
1.3 统计学分析

2 结果
2.1 各组患儿CTGF mRNA及炎性因子水平比较
CTGF mRNA、TGF-β1、TNF-α及IL-6在组间比较,水平从高到低依次为重度组、中度组及轻度组,差异有统计学意义(P<0.05)。见表2。
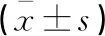
表2 各组患儿CTGF mRNA及炎性因子水平比较
2.2 各组患儿肺功能情况比较
TPTHE、VPEF/VE及PEF在组间比较,水平从高到低依次为轻度组、中度组及重度组,差异有统计学意义(P<0.05)。见表3。
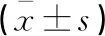
表3 各组患儿肺功能情况比较
2.3 不同预后患儿各指标水平比较
预后良好组与预后不良组相比,CTGF mRNA、TGF-β1、TNF-α及IL-6较低,TPTHE、VPEF/VE及PEF较高,差异有统计学意义(P<0.05)。见表4。
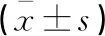
表4 不同预后患儿各指标水平比较
2.4 相关性分析
根据患儿病症不同程度进行赋值,轻度为1,中度为2,重度为3,随即进行Spearman相关性分析。CTGF mRNA、TGF-β1、TNF-α及IL-6与病症程度呈正相关(rCTGF mRNA=0.800,rTGF-β1=0.353,rTNF-α=0.256,rIL-6=0.342,均P<0.05),TPTHE、VPEF/VE及PEF与病症程度呈负相关(rTPTHE=-0.598,rVPEF/VE=-0.432,rPEF=-0.385,均P<0.05)。
2.5 ROC曲线分析
根据患儿不同预后状态进行赋值,预后良好为0,预后不良为1,随即进行ROC曲线分析。ROC结果显示,CTGF mRNA、TGF-β1、TNF-α、IL-6、TPTHE、VPEF/VE及PEF曲线下AUC面积分别为0.784、0.878、0.813、0.827、0.750、0.776及0.783,灵敏度和特异度分别为1.000和0.554、1.000和0.714、0.875和0.643、0.708和0.857、0.607和0.958、0.661和0.875、0.536和0.958。见表5。

表5 ROC曲线分析
2.6 影响患儿预后单因素分析
单因素分析结果显示,预后良好组CTGF mRNA、TGF-β1、TNF-α、IL-6、TPTHE、VPEF/VE、PEF及胎龄与预后不良组相比,差异有统计学意义(P<0.05)。见表6。
表6 影响患儿预后单因素分析
2.7 影响患儿预后多因素分析
以患儿预后状况最为因变量,进行赋值:预后良好为0,预后不良为1;以CTGF mRNA、TGF-β1、TNF-α、IL-6、TPTHE、VPEF/VE、PEF及胎龄作为协变量,进行Logistics回归分析。Logistics分析结果得出,TGF-β1、TNF-α、IL-6及胎龄为影响患儿预后的主要因素。见表7。
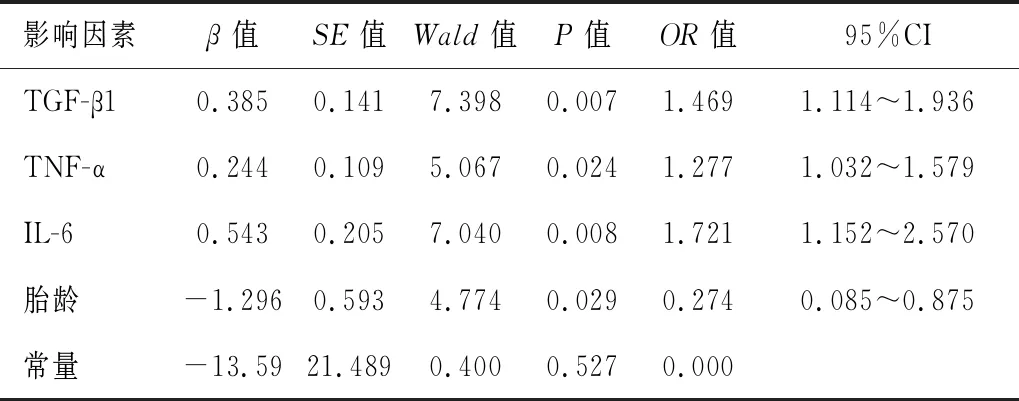
表7 影响患儿预后多因素分析
3 讨论
呼吸窘迫综合征为新生儿中较常见的临床危重症,患儿主要表现为呼吸困难等临床症状,且该疾病发生率较高,同时致死率可达13.5%~21.7%,严重威胁我国新生儿生命安全[7-8]。患儿发生呼吸窘迫综合征病因较多,其中以患儿肺部表面活性物质不足、肺不张及肺部发育不完整为主要病因[9]。有研究[10]表明,呼吸窘迫发病机制与机体炎症反应有关。该疾病为一种临床综合征,故在临床上较难与其他疾病鉴别区分,因此对呼吸窘迫综合征进行有效鉴别,并对疾病程度进行区分,为临床治疗的重要举措。
诱导痰检测为一种安全有效的气道炎症评价方法,且机体对诱导痰影响较小,故适用于新生儿疾病检测[11]。CTGF为一种基质细胞蛋白,可促进或加速纤维化或病理性气道重塑,故患儿发生呼吸窘迫综合征时,其水平在机体内有所升高,而CTGF mRNA作为CTGF转录模板,其水平亦随之升高[12-13]。患儿发生呼吸窘迫后,机体内将释放大量炎性因子。有研究[14]表明,TGF-β1作为一种趋化因子,可加剧患儿肺部炎症及纤维化进程,进而造成患儿发生呼吸窘迫。TNF-α为一种多效应细胞因子,若过量表达,则会引起严重炎性反应。IL-6为一种促炎因子,可导致肝脏分泌急性蛋白,从而引起急性炎症反应。此外,患儿发病时,将出现呼吸困难等症状,究其原因为患儿肺部功能受限,TPTHE、VPEF/VE及PEF为肺部功能相关指标,可反馈患儿肺部功能状况,对患儿疾病程度诊断具有一定鉴别意义[9]。
本研究结果显示,CTGF mRNA、TGF-β1、TNF-α及IL-6在组间比较,轻度组水平均最低,重度组水平均较高,分析原因可能为病症程度较重患儿,其肺部组织损伤程度较高,故机体释放大量CTGF mRNA以进行气道重组,同时重度病症患儿因组织受损程度较高,则机体内炎症反应程度强烈,从而表现为TGF-β1、TNF-α及IL-6水平较高,该结果与卢玉朱等[9,15-16]研究结果相似。其次,TPTHE、VPEF/VE及PEF在组间比较,轻度组水平均最高,重度组水平均最低,并且该类指标水平越高,表明患儿肺功能越好,分析原因可能为重度病症患儿肺部损伤程度较高,故对患儿呼吸功能造成影响,则表现为TPTHE、VPEF/VE及PEF等肺功能指标水平较低。许冬梅等[17]研究亦表明,患儿病症程度越低,其各项肺功能指标水平越高。另外,预后良好组与预后不良组相比,CTGF mRNA、TGF-β1、TNF-α及IL-6较低,TPTHE、VPEF/VE及PEF较高,该结果表明该类指标与患儿预后有一定关联,并且患儿预后越差,其CTGF mRNA及炎性因子水平越高,肺功能越低。同时,Spearman相关性分析显示,CTGF mRNA、TGF-β1、TNF-α及IL-6与患儿病症程度呈正相关,TPTHE、VPEF/VE及PEF与患儿病症程度呈负相关,说明该类指标可对患儿疾病程度进行一定反馈,其中CTGF mRNA、TGF-β1、TNF-α及IL-6水平随患儿疾病程度加重而升高,TPTHE、VPEF/VE及PEF则随患儿疾病程度加重而降低。另一方面,ROC结果显示,CTGF mRNA、TGF-β1、TNF-α、IL-6、TPTHE、VPEF/VE及PEF曲线下AUC面积均高于0.70,提示该类指标用于预测患儿预后有较好价值。此外,Logistics分析结果得出,TGF-β1、TNF-α、IL-6及胎龄为影响患儿预后的主要因素,分析原因可能为炎症反应程度较深,则对患儿机体损伤程度大,而新生儿自我修复能力较弱,则易发生不良结局,同时胎龄较小患儿可能存在机体发育不全等问题,相对于正常胎龄新生儿,其身体更孱弱,则更易发生疾病或疾病程度更易加重。故对于炎性反应程度较高患儿,应积极进行抗炎措施,以期改善患儿预后,并加强对胎龄较小患儿的日常监测,以提前治疗或避免发生不良结局。
综上所述,诱导痰中CTGF mRNA、TGF-β1、TNF-α、IL-6、TPTHE、VPEF/VE及PEF不仅可较好评估患呼吸窘迫综合征早产儿病症危险程度,亦可用于对患儿不良预后进行合理预测,具备较高应用价值。本研究尚存有不足之处,所选病例较少,故研究结果可能存在偏倚,下次研究将扩大所选样本量,以期深入研究。

