α-苦瓜素通过激活JNK信号通路诱导口腔鳞癌细胞凋亡的机制研究
冷平,蒋佩文,杜文倩,蔡紫微,张清亮,汪林,吴泳洁,黄敏,李敏惠
(1.成都中医药大学医学技术学院,四川 成都 610075;2.金堂县第一人民医院实验医学科,四川 成都 610400;成都医学院,3.基础医学院;4.药学院;5.生物科学与技术学院;6.科研实验中心,四川 成都 610500)
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)是头颈部肿瘤中最常见的恶性肿瘤,约占口腔癌总数的90%[1]。近年来,OSCC发病率呈明显上升趋势。目前OSCC仍以外科手术辅以放射治疗和化学药物治疗为主,但由于OSCC早期隐匿、恶性程度高、生长速度快等原因,预后未见明显提升,OSCC患者5年生存率低于50%[2-3]。因此,探索安全有效的OSCC治疗方法,特别是高效、靶向、无创的OSCC治疗药物研究具有重要意义。α-苦瓜素(alpha-momorchain,α-MMC)是从苦瓜籽中提取分离的一种核糖体失活蛋白(ribosome-inactivating proteins,RIPs),具有抗病毒、抗真菌、抗生育及免疫调节等生物学功能[4]。有研究[5-6]报道α-MMC具有潜在抗肿瘤活性,而其抗OSCC的活性及机制还未见报道。因此,本研究探讨了α-MMC对OSCC HSC-3细胞的增殖抑制作用及通过激活细胞信号传导通路调控细胞凋亡的分子机制。
1 材料和方法
1.1 材料
1.1.1 药物 α-MMC由成都医学院沈富兵老师馈赠,提取及鉴定方法见参考文献[5]。
1.1.2 主要试剂 胎牛血清、DMEM基础培养基购自美国Gibco公司;CCK-8检测试剂盒购自日本同仁化学研究所;碘化丙啶(propidium iodide,PI)购自北京索莱宝科技有限公司;Annexin V-FITC/PI凋亡检测试剂盒、线粒体膜电位检测试剂盒、RIPA强效裂解液购自中国碧云天生物技术公司;BCA蛋白浓度测定试剂盒购自北京兰杰柯科技有限公司(Biosharp);实验所用相关抗体均购自美国CST公司。
1.1.3 HSC-3细胞 保存于成都医学院科研实验中心,其STR鉴定结果与ATCC一致。根据ATCC推荐的培养方法,使用含10%胎牛血清的DMEM完全培养液传代培养。
1.2 方法
1.2.1 细胞增殖抑制实验 HSC-3细胞以1×104/孔的密度接种在96孔细胞培养板中;加入供试的α-MMC,药物作用浓度分别为100.000、50.000、25.000、12.500、6.250、3.125、1.563、0.000 μg/mL,每个浓度设置3个复孔,同时设置空白孔;药物作用24、48 h后,每孔加入10 μL CCK-8试剂;孵育2~4 h后,用酶标仪(BioTek Powerwave XS,美国)检测450 nm处的OD值,计算不同药物浓度作用下细胞的存活率。通过GraphPad Prism 9.0软件绘制细胞生长抑制曲线并计算α-MMC对HSC-3细胞的半数抑制浓度(IC50)。
1.2.2 细胞周期检测 HSC-3细胞以5×105/孔的密度接种在6孔细胞培养板中;加入α-MMC(0.00、5.55、16.66、50.00 μg/mL)处理12 h后,收集细胞并用70%乙醇固定、Triton X-100打孔,PI室温避光染色30 min,使用流式细胞仪(ACEA NovoCyte,美国)检测并分析细胞周期分布比例。
1.2.3 细胞凋亡检测 α-MMC(0.00、5.55、16.66、50.00 μg/mL)作用HSC-3细胞24 h后,离心收集细胞;用含Annexin V-FITC和PI两种荧光染料的结合液重悬细胞,室温避光染色15 min;用流式细胞仪测定细胞凋亡情况。
1.2.4 线粒体膜电位检测 α-MMC(0.00、5.55、16.66、50.00 μg/mL)处理HSC-3细胞24 h后,离心收集细胞;用含有JC-1荧光染料的DMEM完全培养液重悬HSC-3细胞,37 ℃避光染色15 min;离心洗涤两次,PBS重悬,用流式细胞仪采集染色后的细胞并分析线粒体膜电位的改变情况。
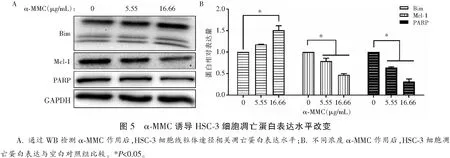
1.2.5 蛋白免疫印迹法(WB)检测 α-MMC(0.00、5.55、16.66 μg/mL)处理HSC-3细胞24 h后,用RIPA强效裂解液(已加蛋白酶及磷酸酶抑制剂)裂解细胞;4 ℃离心收集蛋白上清液,通过BCA法测定蛋白浓度;采用蛋白免疫印迹法(WB)分析细胞凋亡相关蛋白及信号通路蛋白的表达情况。以GAPDH为内参,用Image J软件分析结果。
1.3 统计学分析

2 结果
2.1 α-MMC抑制HSC-3细胞增殖
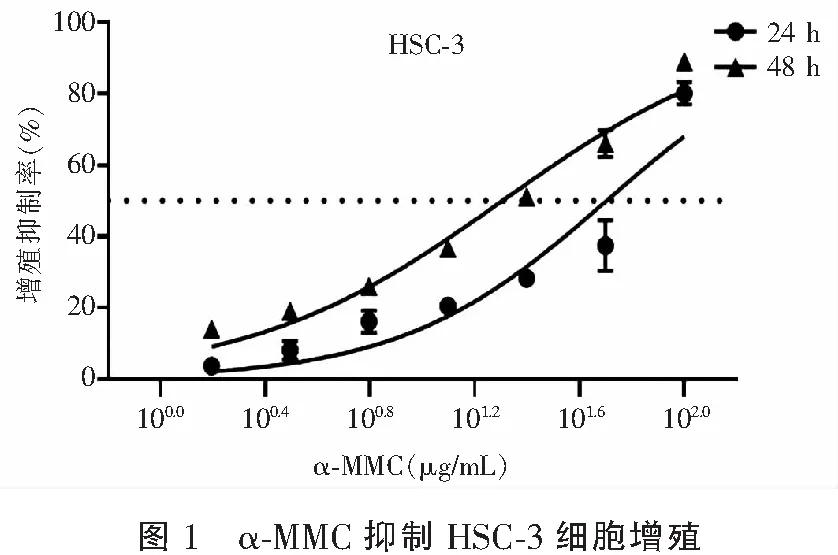
α-MMC作用HSC-3细胞24 h、48 h后,CCK-8法检测细胞活力。GraphPad Prism 9.0软件绘制细胞生长抑制曲线,计算α-MMC对HSC-3细胞的IC50值。结果发现,α-MMC以药物浓度依赖和时间依赖的方式抑制HSC-3细胞增殖,其24 h和48 h的IC50值分别为50.38 μg/mL、20.17 μg/mL。见图1。2.2α-MMC阻滞HSC-3细胞周期在G2/M期
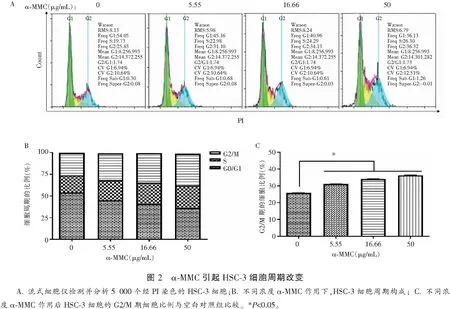
α-MMC(0.00、5.55、16.66、50.00 μg/mL)处理HSC-3细胞12 h后,PI单染法检测细胞周期比例,结果显示α-MMC作用HSC-3细胞12 h后,G2/M期的细胞比例分别为25.83%、31.10%、34.13%、36.32%;即α-MMC阻滞HSC-3细胞周期于G2/M期。见图2。
2.3 α-MMC诱导HSC-3细胞凋亡
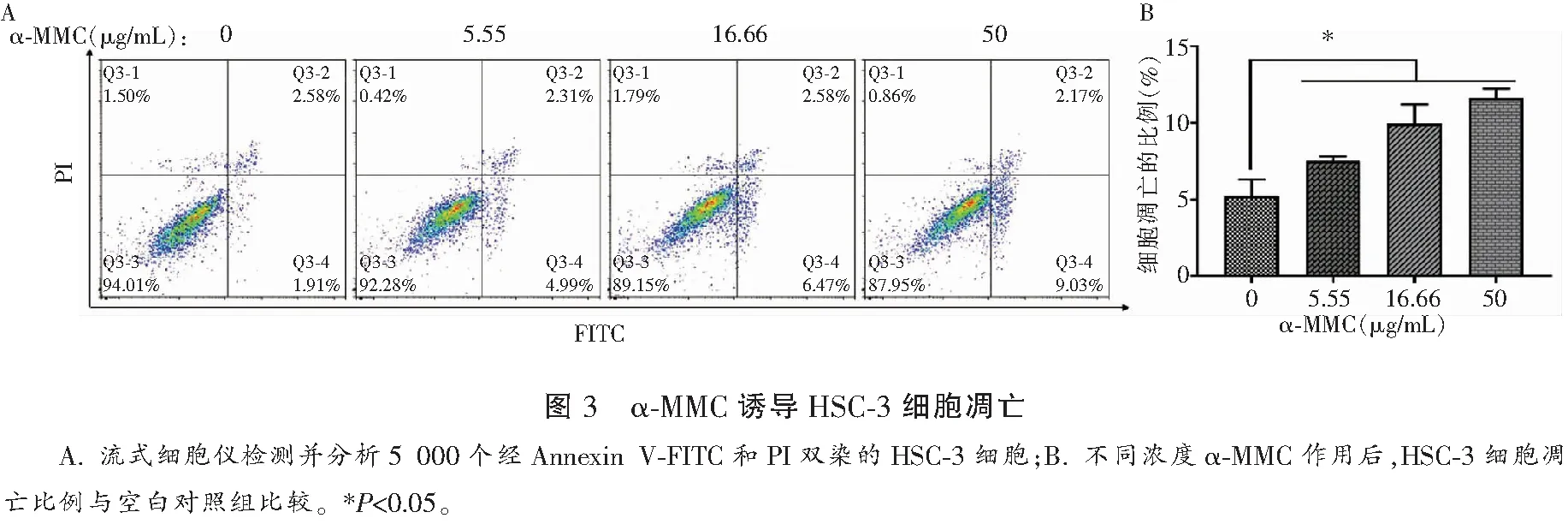
α-MMC(0.00、5.55、16.66、50.00 μg/mL)作用HSC-3细胞24 h后,对细胞进行Annexin V-FITC和PI双染,流式细胞仪检测分析发现HSC-3细胞凋亡比例分别为(5.99±1.50)%、(7.72±0.42)%、(10.84±1.79)%、(12.06±0.86)%,差异有统计学意义(P<0.05)。见图3。
2.4 线粒体途径参与α-MMC诱导HSC-3细胞凋亡
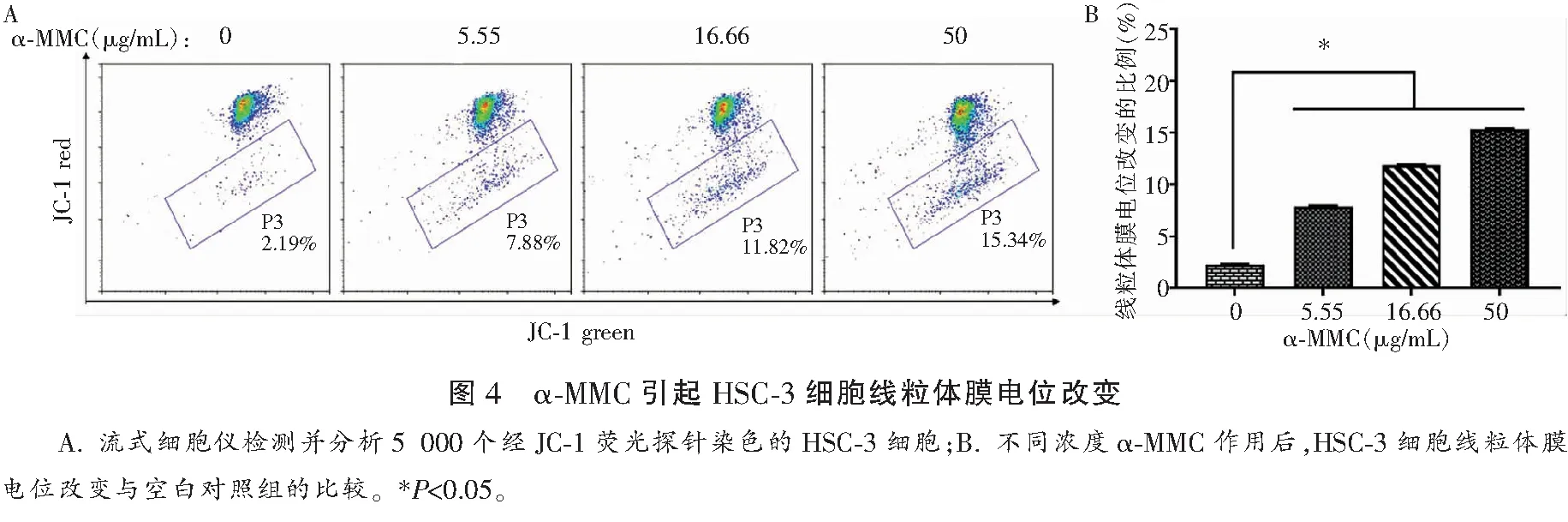
线粒体膜电位的下降是细胞凋亡早期的一个标志性事件,JC-1染色法结果显示α-MMC诱导HSC-3细胞线粒体膜电位下降,药物浓度为50.00 μg/mL的α-MMC作用HSC-3细胞24 h后,线粒体膜电位下降比例达15.34%(对照组为2.19%),差异有统计学意义(P<0.05)。见图4。
WB结果显示,α-MMC诱导HSC-3细胞线粒体途径相关蛋白表达水平改变,即促凋亡蛋白Bim的表达增加,抗凋亡蛋白Mcl-1的表达及凋亡蛋白PARP原片段表达降低。以上结果提示线粒体途径参与α-MMC诱导HSC-3细胞凋亡。见图5。
2.5 JNK信号通路参与α-MMC对HSC-3细胞的凋亡诱导过程
JNK信号通路参与细胞多种生理和病理过程,包括细胞增殖、细胞周期和细胞凋亡等反应过程。通过WB检测结果发现α-MMC能激活JNK信号通路,即上调p-MKK4、p-JNK、p-c-Jun的表达,差异有统计学意义(P<0.05)。研究结果提示JNK信号通路参与α-MMC对HSC-3细胞的凋亡诱导过程。见图6。

3 讨论
苦瓜在传统医学中常被用于缓解高血压、高胆固醇水平和降低血糖[7],而α-MMC是从苦瓜籽中提取的I型RIP,具有RNA/DNA水解酶活性、蛋白质合成抑制性和抗肿瘤等多种生物活性[8]。已有报道[5-6]表明,α-MMC对乳腺癌MDA-MB-231、MCF-7细胞具有抗肿瘤活性,也可以在常氧和缺氧条件下抑制人鼻咽癌CNE2、HONE1细胞。
本研究显示,α-MMC可抑制HSC-3细胞增殖,将细胞周期阻滞于G2/M期,降低细胞线粒体膜电位,诱导细胞凋亡,同时免疫印迹实验结果显示促凋亡蛋白Bim表达增加、抗凋亡蛋白Mcl-1表达降低。Bim和Mcl-1是Bcl-2家族蛋白的成员,其通过控制线粒体膜的通透性从而在线粒体凋亡通路的调控中起到重要作用。Bim与Mcl-1相互作用,可使Bak从Mcl-1上解离,激活Bak,引起线粒体外膜通透性改变,从而活化线粒体凋亡途径[9-10]。Wang等[11]研究显示,α-MMC通过LRP1介导的内吞作用和JNK的激活诱导L02细胞凋亡,提示JNK的激活在α-MMC诱导的细胞毒性中可能起着重要作用。JNK是有丝裂原活化蛋白激酶(MAPKs)家族的成员,而MKK4是第一个被鉴定的JNK激活剂[12],MKK4通过磷酸化JNK的Tyr(酪氨酸)残基直接激活JNKs,进而激活转录因子或凋亡前蛋白等底物(如:c-Jun、ATF2、p53、Bim、Bax、Bid等),从而在细胞增殖、分化和凋亡等过程中发挥着至关重要的作用[13-14]。故本研究通过WB检测JNK信号通路相关蛋白的表达情况,显示α-MMC可上调p-MKK4、p-JNK、p-c-Jun的表达,从而激活MKK4/JNK信号通路。
综上,α-MMC对口腔鳞状细胞癌HSC-3细胞具有增殖抑制作用,其可能机制是α-MMC激活JNK信号通路触发细胞周期阻滞、并通过线粒体途径诱导细胞凋亡。

