当归红芪超滤物对X射线引起人脐静脉内皮细胞损伤的保护作用及其机制
武兵兵,张爱平,赵信科,李应东,刘 凯,
(1.甘肃中医药大学中西医结合学院 中西医结合临床重点实验中心,甘肃 兰州 730000;2.甘肃中医药大学附属医院心血管内科,甘肃 兰州 730000)
放射治疗(简称放疗),是通过辐射所产生的能量使细胞染色体损伤,致细胞停止生长,达到快速消灭癌细胞的一种治疗疾病方式。尽管放疗对于治疗肿瘤效果显著,但对周围正常组织造成的辐射损伤不容忽视,尤其是胸腔纵膈肿瘤放疗后常导致放射性心血管损伤。研究[1-2]表明:心血管内皮细胞对放疗辐射的敏感性高于心肌细胞,长期放疗的辐射对心血管内皮细胞的损伤可诱发其功能障碍,从而促进多种心血管疾病发生。目前其确切的发病机制尚未阐明,而相关中医药防治机理研究尤为薄弱。中医学研究[3]显示:辐射为外来“毒邪”范畴,气虚血瘀为其致病的基本病机。当归和红芪是我国传统的益气活血类中药,本课题组前期研究[4-5]表明:复方制剂当归红芪超滤物(ultrafiltration extract from Angelica Sinensis Radix and Hedysari Radix,UFE-AH)对X射线辐射损伤心肌细胞有较强的防护作用,但其对X射线辐射导致心血管内皮细胞损伤作用及其机制的研究尚未见报道。因此,本研究建立X射线辐射人脐静脉内皮细胞 (human umbilical vein endothelial cells,HUVECs)损伤模型,探讨UFE-AH对辐射损伤HUVECs的保护作用及机制,为甘肃道地药材的开发和临床应用提供依据。
1 材料与方法
1.1 细胞、主要试剂和仪器HUVECs(上海富衡细胞库)。UFE-AH由甘肃中医药大学科研实验中心和甘肃省膜科学研究院联合制备。内皮细胞培养基(美国ScienCell公司),细胞凋亡检测试剂盒(上海翊圣公司),血管内皮生长因子(vascular endothelial growth factor,VEGF)抗体、磷酯酰肌醇-3激酶(phosphatidylinosital-3 kinase,PI3K)抗体、蛋白激酶B(protein kinase B,Akt)抗体、磷酸 化Akt(phosphorylated Akt,p-Akt)抗 体 和 兔抗人GAPDH抗体(美国Gene Tex公司),兔抗人B细胞淋巴瘤2(B-cell lymphoma-2,Bcl-2)抗体、兔抗人Bcl-2相关X蛋 白(Bcl-2 associated X protein,Bax)抗体和兔抗人含半胱氨酸的天冬氨酸 蛋 白 水 解 酶3(cysteinyl aspartate specific proteinase-3,caspase-3)抗体(杭州华安生物技术有限公司),HRP标记的山羊抗兔IgG(美国Immuno Way公司)。酶标仪和凝胶成像系统(美国Bio-Rad公司),流式细胞仪(型号:FACSVerse)(美国BD公司),细胞培养箱(美国Thermo Fisher公司),投射电子显微镜(型号:HT7700)(日本HITACHI公司),X射线辐照仪(美国Faxitron公司)。
1.2 细胞培养常规复苏HUVECs,将其接种于25 cm2培养瓶中,采用含5%胎牛血清(fetal bovine serum,FBS)和1%青-链霉素的内皮细胞培养基,37℃、5% CO2条件下在细胞培养箱中培养,细胞生长融合至80%~90%时,进行传代。
1.3 CCK-8法检测X射线辐射后HUVECs的抑制率取对数生长期的HUVECs,以每孔5×103个细胞的密度接种于96孔细胞培养板,每组设6个复孔,培养24 h后给予0、2、4、6、8和10 Gy不同剂量X射线辐射,于培养箱内分别培养24、48和72 h后 向 每 孔 加 入10 μ L CCK-8试 剂,37℃孵育2 h。采用酶标仪于450 nm波长处测定吸光度(A)值,计算细胞抑制率。细胞抑制率=(未辐射孔A值-辐射孔A值)/(未辐射孔A值-空白孔A值)。
1.4 CCK-8法检测不同浓度UFE-AH作用后HUVECs的存活率取对数生长期HUVECs,以每孔2.5×103个细胞的密度接种于96孔细胞培养板,分别加入0、50、100、200、400、600、800和1 000 μg·L-1UFE-AH,每个浓度组设置6个复孔,置于细胞培养箱中分别培养24、48和72 h。采用酶标仪于450 nm波长处测定A值,计算细胞存活率,确定本实验UFE-AH的最佳干预剂量。细胞存活率=(加药孔A值-空白孔A值)/(未加药孔A值-空白孔A值)。
1.5 CCK-8法检测各组细胞存活率实验分为空白组、模型组(6 Gy X射线)、低剂量UFE-AH组(6 Gy X射 线+100 μg·L-1UFE-AH)、中 剂 量UFE-AH组(6 Gy X射线+200 μg·L-1UFE-AH)和 高剂量UFE-AH组(6 Gy X射线+400 μg·L-1UFE-AH)。以每孔5×103个细胞接种于96孔细胞培养板,培养24 h后,空白组和模型组正常换液处理,药物干预组分别给予100、200和400 μg·L-1UFE-AH干预24 h,除空白组外其余各组均给予6 Gy X射线辐射,继续培养48 h后采用CCK-8法检测各组细胞A值,计算细胞存活率,每组设6个复孔。细胞存活率=(加药孔A值-空白孔A值)/(未加药孔A值-空白孔A值)。
1.6 流式细胞术检测各组细胞凋亡率各组HUVECs干预后采用无EDTA胰酶消化,收集各组细胞及上清液,1 000 r·min-1离心5 min;采用1×Binding Buffer重悬细胞,使细胞密度约为1×106mL-1,各 组 加 入AnnexinV-FITC(5 μ L)和PI(5 μL),避光孵育15 min后上机,1 h内采用流式细胞仪分析。细胞凋亡率=(早期细胞凋亡数+晚期细胞凋亡数)/细胞总数×100%。
1.7 透射电子显微镜下观察各组细胞超微结构收集各组HUVECs,戊二醛4℃避光固定,过夜,锇酸固定,再经梯度乙醇及丙酮脱水,浸透,包埋,切片,采用铀铅双染色,透射电子显微镜下观察并拍照。
1.8 Western blotting法检测各组细胞中PI3K、Akt、p-Akt、VEGF、Bcl-2、Bax和caspase-3蛋白表达水平取各组HUVECs,预冷PBS缓冲液洗涤2次,加入组织细胞裂解液,12 000 r·min-1离心15 min,吸取上清液,取少量上清采用BCA法测定蛋白浓度,等量上样,SDS-PAGE电泳、PVDF转膜和5%脱脂奶粉封闭后,TBST洗膜3次,每 次8 min。然 后 一 抗4℃孵 育 过 夜(GAPDH 1∶5 000稀 释,PI3K、Bcl-2、Bax和caspase-3 1∶1 000稀释,Akt、p-Akt和VEGF 1∶500稀释),TBST洗膜3次,每次8 min。二抗室温摇床孵育2 h、TBST洗膜3次,每次10 min。采用ECL化学发光法和凝胶成像仪进行曝光,以GAPDH为内参,采用Image J软件分析蛋白条带灰度值,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH蛋白条带灰度值。
1.9 统计学分析采用GraphPad Prism 8.0.2统计软件进行统计学分析。各组细胞抑制率,细胞存活率,细胞凋亡率,细胞中PI3K、Akt、p-Akt、VEGF、Bcl-2、Bax和caspase-3蛋白表达水平均符合正态分布,以-±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 X射线辐射后各组细胞抑制率采用0、2、4、6、8和10 Gy X射线辐射HUVECs后,CCK-8法检测结果显示:在辐射后24 h,各组HUVECs的细胞抑制率为负值;辐射后48和72 h,当辐射剂量大于2 Gy时,与0 Gy X射线组比较,各组HUVECs的细胞抑制率呈剂量依赖性增加,其中4、6、8和10 Gy均可抑制细胞生长(P<0.05或P<0.01),6、8和10 Gy抑制细胞生长作用更明显(P<0.01)。因此,可选择6 Gy作为辐射造模剂量。见表1。
表1 CCK-8法检测X射线辐射后各组HUVECs的抑制率Tab.1 Inhibitory rates of HUVECs after irradiated with X-ray detected by CCK-8 assay (n=6,-±s,η/%)

表1 CCK-8法检测X射线辐射后各组HUVECs的抑制率Tab.1 Inhibitory rates of HUVECs after irradiated with X-ray detected by CCK-8 assay (n=6,-±s,η/%)
*P<0.05,**P<0.01 compared with 0 Gy X-ray group.
Group 0 Gy X-ray 2 Gy X-ray 4 Gy X-ray 6 Gy X-ray 8 Gy X-ray 10 Gy X-ray Inhibitory rate(t/h)24 0-7.64±6.60-15.23±4.49-11.05±5.55-8.06±4.31-16.73±6.97 48 0 9.20±3.69 13.42±3.85*21.40±3.78**23.17±2.76**28.76±2.93**72 0 17.43±7.33 30.52±3.40**35.64±3.59**35.27±5.79**46.72±8.47**
2.2 UFE-AH促进细胞增殖最佳干预剂量不同浓度UFE-AH干预HUVECs 24、48和72 h后,与0 μg·L-1UFE-AH组 比 较,100、200、400和600 μg·L-1UFE-AH组细胞存活率升高(P<0.05或P<0.01),100、200和400 μg·L-1UFE-AH组细胞存活率明显升高(P<0.01)。因此,本研究选 择100、200和400 μg·L-1UFE-AH为 最 佳 干 预浓度,并在X射线辐射前干预24 h,辐射后干预48 h。见表2。
表2 不同浓度UFE-AH作用后各组细胞存活率Tab.2 Survival rates of cells in various groups after treated with different concentrations of UFE-AH(n=6,-±s,η/%)
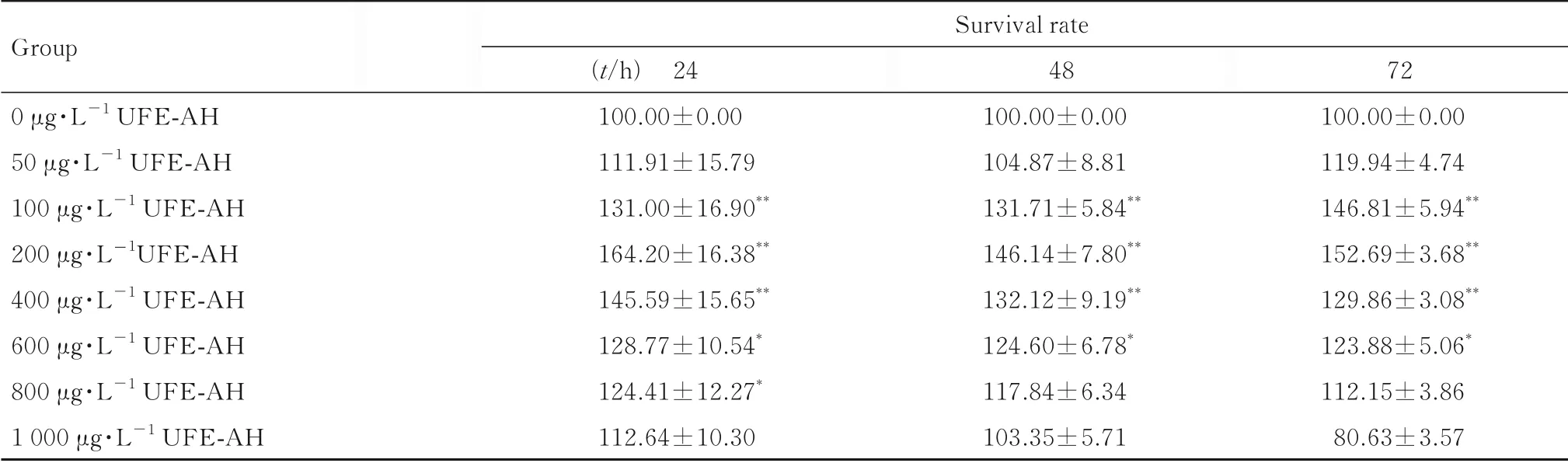
表2 不同浓度UFE-AH作用后各组细胞存活率Tab.2 Survival rates of cells in various groups after treated with different concentrations of UFE-AH(n=6,-±s,η/%)
*P<0.05,**P<0.01 compared with 0 μg·L-1 UFE-AH group.
Group 0 μg·L-1 UFE-AH 50 μg·L-1 UFE-AH 100 μg·L-1 UFE-AH 200 μg·L-1UFE-AH 400 μg·L-1 UFE-AH 600 μg·L-1 UFE-AH 800 μg·L-1 UFE-AH 1 000 μg·L-1 UFE-AH Survival rate(t/h)24 100.00±0.00 111.91±15.79 131.00±16.90**164.20±16.38**145.59±15.65**128.77±10.54*124.41±12.27*112.64±10.30 48 100.00±0.00 104.87±8.81 131.71±5.84**146.14±7.80**132.12±9.19**124.60±6.78*117.84±6.34 103.35±5.71 72 100.00±0.00 119.94±4.74 146.81±5.94**152.69±3.68**129.86±3.08**123.88±5.06*112.15±3.86 80.63±3.57
2.3 各组细胞存活率CCK-8法检测结果显示:与空白组比较,模型组细胞存活率明显降低(P<0.01);与模型组比较,中和高剂量UFE-AH组细胞存活率明显升高(P<0.01)。见图1。
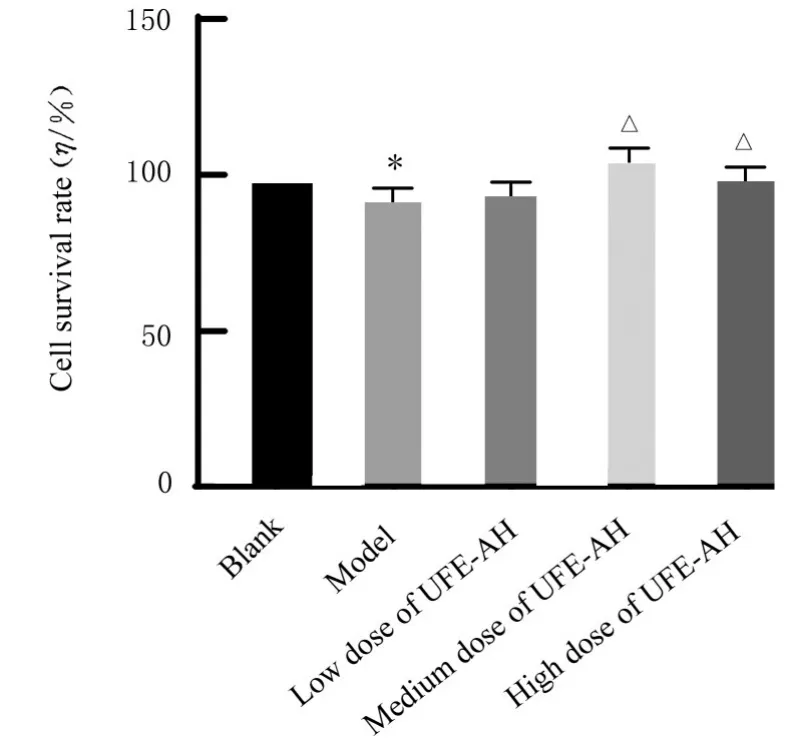
图1 CCK-8法检测各组细胞存活率Fig.1 Survival rates of cells in various groups detected by CCK-8 assay
2.4 各组细胞凋亡率AnnexinV-FITC/PI双染法检测结果显示:与空白组比较,模型组细胞凋亡率明显升高(P<0.01);与模型组比较,低、中和高剂量UFE-AH组细胞凋亡率均明显降低(P<0.01)。见图2。
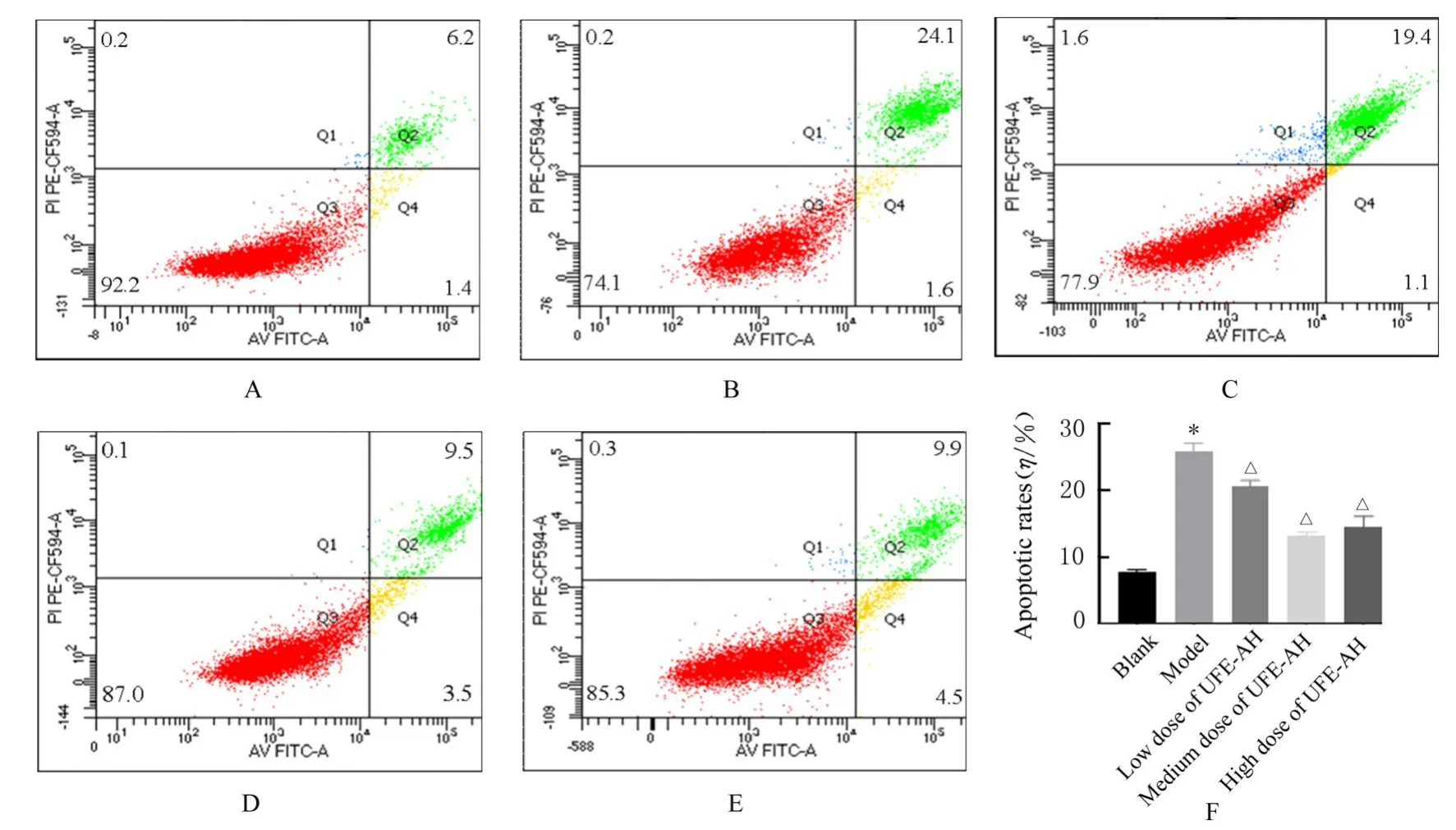
图2 流式细胞术检测各组细胞凋亡率Fig.2 Apoptotic rates of cells in various groups detected by flow cytometry
2.5 各组细胞超微结构空白组细胞呈长梭形,细胞膜完整,胞质较均匀,细胞核呈长圆形,核膜清晰,核周隙未见增宽,线粒体呈卵圆形,未见明显肿胀,基质较均匀,嵴略模糊,少量变短,胞内可见少量溶酶体。与空白组比较,模型组细胞重度肿胀,细胞膜多处破损,胞质稀松且出现多个空泡区,细胞核呈轻度不规则形,线粒体数量明显减少,呈轻度或中度肿胀,基质变浅且不均,线粒体少部分嵴局部断裂、变短,胞内可见大量自噬溶酶体(autolysosomes,ASS)。与模型组比较,低剂量UFE-AH组细胞中度肿胀,胞内可见较多细胞器空泡,线粒体数量减少,部分出现轻度肿胀,嵴模糊,胞内可见一定量ASS;中剂量UFE-AH组细胞轻微肿胀,线粒体数量较多,无明显肿胀,基质均匀,嵴排列较整齐,胞内可见一定量ASS;高剂量UFE-AH组细胞轻微肿胀,胞内局部可见细胞器空泡,线粒体轻微肿胀,基质密度较均匀,嵴结构清晰,少量断裂,胞内可见一定量ASS。见图3。
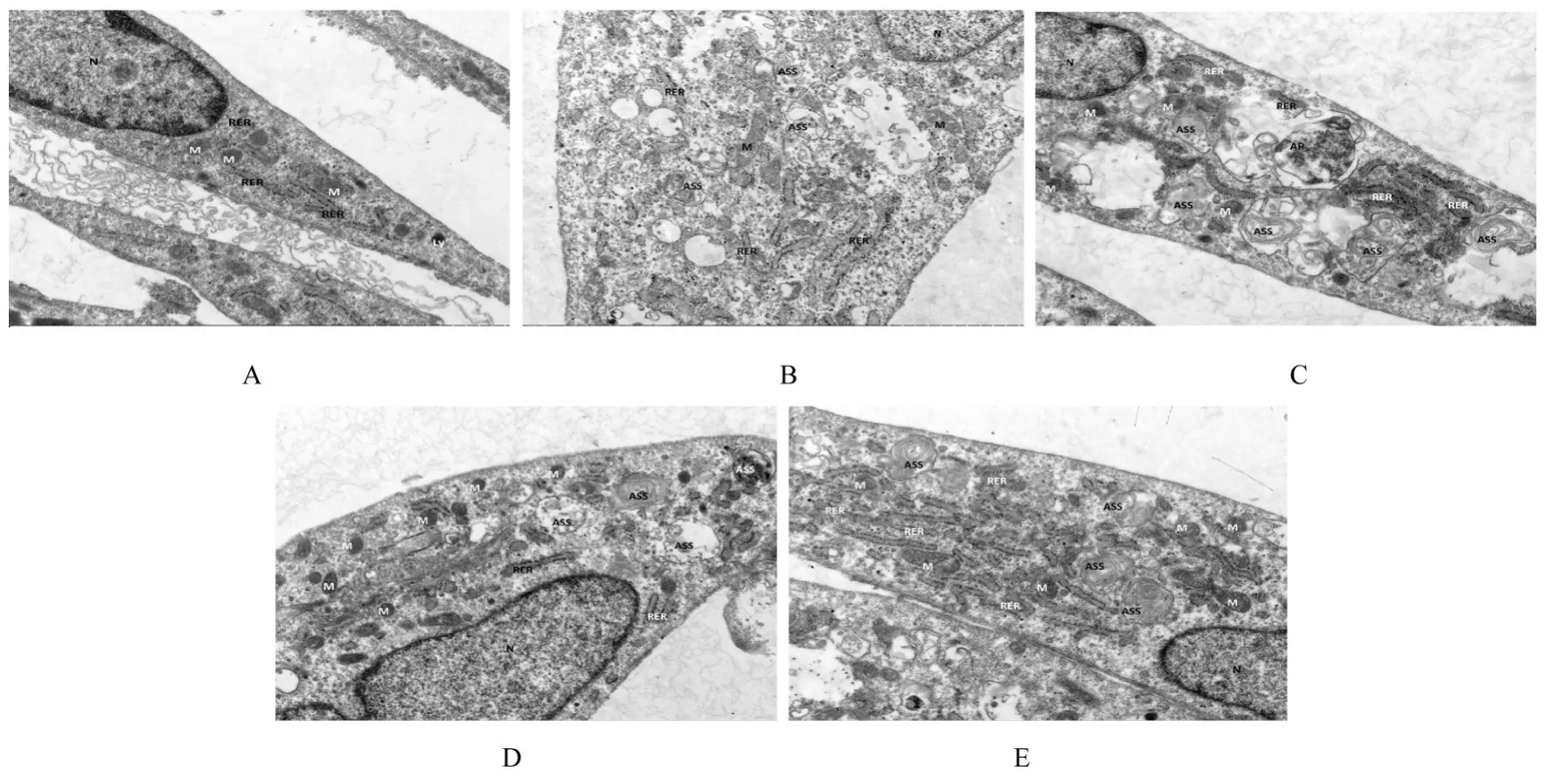
图3 各组HUVECs超微结构(×7 000)Fig.3 Ultrastructures of HUVECs in various groups(×7 000)
2.6 各组细胞中PI3K、Akt、p-Akt、VEGF、Bcl-2、Bax和caspase-3蛋白表达水平与空白组比较,模型组细胞中PI3K、p-Akt、Bcl-2和VEGF蛋 白 表 达 水 平 明 显 降 低(P<0.01),Bax和caspase-3蛋白表达水平及Bax/Bcl-2比值明显升高(P<0.01);与模型组比较,中和高剂量UFE-AH组细胞中PI3K、p-Akt、Bcl-2和VEGF蛋白表达水平明显升高(P<0.01),Bax和caspase-3蛋白表达水平及Bax/Bcl-2比值明显降低(P<0.01)。见图4~7。
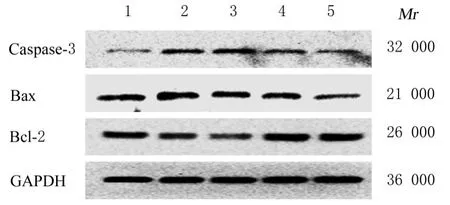
图4 各组细胞中凋亡相关蛋白表达电泳图Fig.4 Electrophoregram of expressions of apoptosisrelated proteins in cells in various groups
3 讨 论
血管内皮细胞是位于血管内壁的单层细胞,在维持血管完整性、调节血管张力和血管通透性等方面具有重要作用。辐射引起的血管内皮细胞损伤是引发心血管疾病的病理基础,其可诱导血管内皮细胞炎症、氧化应激、DNA损伤和自噬等发生,致使血管内皮细胞启动细胞凋亡途径,诱发辐射性心血管疾病[6]。近年来,中医药在防护辐射损伤方面具有突出优势,本课题组前期制备的UFE-AH由红芪和当归通过超滤截留获取,其组方来源于益气补血名方当归补血汤,采用红芪取代黄芪而成。红芪是甘肃道地药材,与黄芪功效相似,具有补气生津和利水消肿作用,当归补血活血,二药合用,共凑益气生津、补血活血和利水消肿功效[7-8]。电离辐射引起的细胞凋亡是辐射引起细胞毒性的机制之一。有研究[9-10]表明:当归多糖具有促进心肌细胞增殖和抑制细胞凋亡作用,当归红芪多糖通过抑制心肌细胞凋亡,防治辐射性心肌损伤。研究[11]显示:黄芪多糖通过下调相关因子水平,对12C6+辐射人骨髓间充质干细胞具有促增殖作用,黄芪甲苷通过减少辐射所致肺组织细胞凋亡,对辐射肺损伤起到一定的保护作用[12]。当前认为当归红芪及其活性成分具有抗辐射损伤作用,但关于UFE-AH防治辐射后血管内皮细胞损伤目前尚未见相关报道。因此,本研究旨在探讨UFE-AH对辐射后HUVECs防护作用并阐明其相关机制。
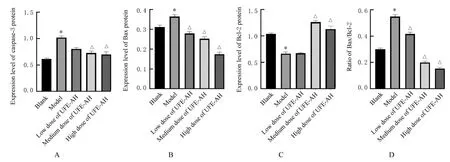
图5 各组细胞中凋亡相关蛋白表达水平Fig.5 Expression levels of apoptosis-related proteins in cells in various groups
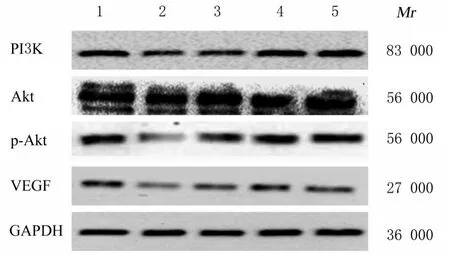
图6 各组细胞中PI3K、Akt、p-Akt和VEGF蛋白表达电泳图Fig.6 Electrophoregram of expressions of PI3K,Akt,p-Akt and VEGF proteins in cells in various groups
PI3K/Akt信号通路对细胞存活和增殖等方面至关重要,PI3K激活后,引起下游蛋白Akt活化为p-Akt,p-Akt可促进细胞生长和抑制细胞凋亡[13]。Bcl-2蛋白家族中相关蛋白在细胞凋亡的调控中起重要作用,其中Bcl-2是最重要的抗凋亡蛋白,Bax是促凋亡蛋白,caspase-3是Bcl-2家族通过线粒体途径调控细胞凋亡的下游促凋亡蛋白[14-15]。在线粒体凋亡调控通路中,Bcl-2与Bax形成异源二聚体抑制Bax基因的表达,从而抑制细胞凋亡,当Bax形成Bax-Bax同源二聚体时会促进 细 胞 凋 亡[16]。X射 线 辐 射 通 过 上 调Bax和caspase-3蛋白表达,下调Bcl-2的表达诱导细胞凋亡[17-18]。当Akt磷酸化激活时,线粒体途径的Bcl-2接着也被激活,进而启动抗凋亡作用。研究[19]表明:UFE-AH通过上调Bcl-2蛋白表达和下调caspase-3蛋白表达对X射线引起的H9C2心肌细胞凋亡具有保护作用。本研究结果显示:X射线辐射后中和高 剂量UFE-AH组HUVECs中PI3K、p-Akt和Bcl-2蛋白表达水平升高,Bax和caspase-3蛋白表达水平降低,细胞凋亡率降低,促进HUVECs增殖。因此,UFE-AH对X射线引起的HUVECs细胞凋亡具有一定的改善作用。
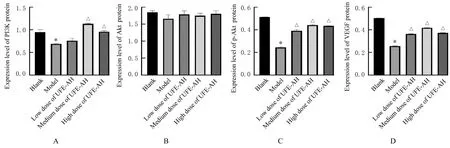
图7 各组细胞中PI3K、Akt、p-Akt和VEGF蛋白表达水平Fig.7 Expression levels of PI3K,Akt,p-Akt and VEGF proteins in cells in various groups
VEGF是一种糖基化有丝分裂原,特异性影响血管内皮细胞,促进血管内皮细胞生长、迁移和抑制其凋亡,介导血管通透性增加和诱导血管生成[20-21]。血管内皮细胞通过自分泌产生的VEGF对其生存和血管内稳态至关重要,并可抑制辐射诱导的细胞凋亡[22-23]。而PI3K和p-Akt蛋白激活可诱导VEGF表达[24-25]。本研究结果显示:中和高剂量UFE-AH能 上 调VEGF蛋 白 表 达 水 平,提 示UFE-AH可能通过上调PI3K和p-Akt蛋白表达水平,诱导血管内皮细胞自分泌VEGF进而促进HUVECs存活。
线粒体能够产生能量,维持细胞正常功能,也能参与细胞凋亡和坏死[26]。血管内皮细胞中的线粒体数量有限,且其数量或形态的改变都会影响线粒体功能。SCHILLING等[27]研究发现:细胞或组织暴露于高剂量X射线辐射后可导致线粒体功能障碍和线粒体数量减少。研究[28]表明:X射线可引起冠状动脉血管内皮细胞线粒体数量持续减少及功能障碍,导致血管内皮细胞凋亡。本研究电镜结果显示:X射线辐射后HUVECs线粒体损伤严重且数量减少,细胞质中出现较多ASS,而中和高剂量的UFE-AH使线粒体肿胀减轻和数量增加,ASS减少,提示UFE-AH可改善线粒体损伤,同时可能通过调节自噬来维持细胞内稳态,达到抗辐射损伤作用,然而其确切机制需要进一步研究。
综上所述,UFE-AH对X射线引起的血管内皮细胞损伤具有保护作用,其机制可能是通过上调血管内皮细胞中PI3K、p-Akt、VEGF和Bcl-2蛋白表达,下调Bax和caspase-3蛋白表达,抑制血管内皮细胞凋亡,减轻受损血管内皮细胞超微结构改变,发挥其抗辐射损伤的作用,本研究结果为X射线辐射防护剂的研发和临床应用提供了新的方向。

