牙龈卟啉单胞菌脂多糖对巨噬细胞中铁死亡相关因子表达水平的影响
杜雪纯,李保胜,乔树伟,欧燕珍,李 珍,孟维艳
(吉林大学口腔医院口腔种植科,吉林 长春 130021)
牙周炎是导致我国成年人牙齿缺失的首要疾病,目前认为牙周微生物与免疫系统相互影响所引发的炎症反应是牙周组织破坏的原因之一,过度的炎症反应会加重牙周软硬组织的损害[1-2]。在牙周炎发病过程中,巨噬细胞对牙周组织稳态起重要的调 节 作 用。研 究[3-4]表 明:牙 龈 卟 啉 单 胞 菌(Porphyromonas gingivalis,P.g)作为牙周炎的主要致病菌之一,其表面的脂多糖(lipopolysaccharide,LPS)可以促使巨噬细胞转变为促炎型巨噬细胞,分泌出多种炎性细胞因子进而使炎症反应加重。
铁死亡是一种依赖于铁离子的程序性细胞死亡方式,区别于细胞凋亡、焦亡和坏死等程序性细胞死亡方式,铁死亡的发生由脂质过氧化引起,从而导致活性氧(reactive oxygen species,ROS)水平升高及铁离子积累[5-6]。研究[7-8]显示:铁死亡的发生与多种炎症性疾病相关,如急性肺损伤和脓毒症等,而其在牙周炎的发病机制中研究较少。已有研究[9-10]显示:牙周炎水平的丁酸可以诱导牙周韧带成纤维细胞发生铁死亡,且牙周组织中铁死亡相关基因表达增加。有学者[11-12]发现:在大肠杆菌LPS诱导下,心肌细胞及人支气管上皮细胞发生铁死亡,而P.g-LPS是否可以引发巨噬细胞发生铁死亡尚不清楚。因此本研究初步探究P.g-LPS对巨噬细胞中铁死亡相关因子表达水平的影响,为牙周炎发病机制及治疗的研究奠定基础。
1 材料与方法
1.1 细胞、主要试剂和仪器小鼠巨噬细胞系RAW264.7细胞(上海中科院细胞所)。DMEM培养基、PBS、1%青-链霉素和胰蛋白酶(美国Hyclone公司),P.g-LPS(美国InvivoGen公司),总RNA提取试剂盒、逆转录试剂盒和实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)试剂盒(上海翌圣公司),ROS检测试剂盒、丙二醛(malondialdehyde,MDA)检测试剂盒、RIPA裂解液、SDS-PAGE蛋白上样缓冲液(5×)和BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司),亚铁离子荧光探针(Ferrousion fluorescent probe,FeRhoNox-1)(上海懋康生物技术有限公司),DAPI(北京索莱宝公司),β-actin抗体(66009-1-Ig)(美国ProteinTech公司),长链酯酰辅酶A合成酶4(long-chain acyl-CoA synthetase 4,ACSL4)抗体(ab155282)、谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)抗 体(ab125066)和 转 铁 蛋 白 受 体1(transferrin receptor 1,TfR1) 抗 体(ab214039)(美国Abcam公司),ECL化学发光液(苏州新赛美 公 司)。RT-qPCR扩 增 仪MX3005P(美 国Agilent公司),酶标仪(美国Bio-TEK公司),Vanox荧光倒置显微镜(日本Olympus公司)。
1.2 实验分组将RAW264.7细胞接种于6孔细胞培养板中,密度为每孔2×105个细胞,37℃、5% CO2条件下培养,实验分为对照组和实验组,对照组细胞不做任何处理,实验组细胞加入10 mg·L-1P.g-LPS分别处理6、12和24 h。
1.3 RT-qPCR法检测2组RAW264.7细胞中ACSL4、GPX4和TfR1 mRNA表达水平达到测定时间后弃去孔板内各孔培养液,加入PBS缓冲液冲洗3次后,再将1 mL TRIzol加入各孔中反应5 min,提取总RNA,将其反转录为cDNA,反应条件为25℃、5 min,42℃、30 min,85℃、5 min。反应结束后采用RT-qPCR法检测2组RAW264.7细胞中ACSL4、GPX4和TfR1 mRNA表达水平,扩增反应条件为95℃、5 min,95℃、10 s,60℃、30 s,循环数为40次。引物序列:ACSL4,上游引物5′-CCCTGAAGGATTTGAGATTCACA-3′,下 游引 物5′-CCTTAGGTCGGCCAGTAGAAC-3′;GPX4,上 游 引 物5′-AAGGACCTGCCCCACTATTTC-3′,下 游 引 物5′-ACGCTGGATTTTCGGGTCT-3′;TfR1,上 游 引 物5′-GGTTCGTACAGCAGCAGAGGTG-3′,下 游 引 物5′-TCCACGAGCAGAATACAGCCATTG-3′;β-actin,上游引 物5′-GGAGATTACTGCCCTGGCTCCTA-3′,下 游 引 物5′-GACTCATCGTACTCCTGCTTGCTG-3′。采用2-ΔΔCt法计算2组细胞中目的基因mRNA表达水平。
1.42′,7′-二氯荧光素二乙酸酯(2′,7′-dichlorodihydrofluorescein diacetate,DCFH-DA)荧光探针法检测2组RAW264.7细胞中ROS水平弃去孔板内各孔培养液并用PBS缓冲液冲洗,加入10 mg·L-1DAPI室温染色10 min后PBS缓冲液冲洗3次,再加入10 μmol·L-1DCFH-DA 37℃避光孵育40 min,PBS缓冲液洗去DCFH-DA后,荧光显微镜下观察,并采用Image J软件分析荧光强度,以DCFH-DA荧光强度与DAPI荧光强度比值代表ROS水平。
1.5 硫代巴比妥酸(thiobarbituric acid,TBA)法检测2组RAW264.7细胞中MDA水平弃去孔板内各孔培养液并用冷PBS缓冲液冲洗,每孔加入200 μL裂解液,充分裂解后10 000 g~12 000 g离心10 min,取上清,采用BCA蛋白浓度测定试剂盒测定样品的蛋白浓度,100 μL样品加入200 μL MDA检测工作液混匀,100℃水浴15 min,冷却至室温后1 000 g离心10 min。从上清中取200 μL加入至96孔细胞培养板中,于532 nm波长处测定吸光度(A)值,根据标准曲线计算MDA水平(mmol·g-1)。
1.6 FeRhonox-1法检测2组RAW264.7细胞中亚铁离子(Fe2+)水平弃去孔板内各孔培养液并用冷PBS缓冲液冲洗2次,加入5 μmol·L-1FeRhonox-1后,37℃避光孵育40 min,PBS缓冲液冲洗2次,室温避光放置30 min,荧光显微镜下观察,并采用Image J软件分析荧光强度,以荧光强度代表Fe2+水平,荧光强度单位为AU。
1.7 Western blotting法检测2组RAW264.7细胞中ACSL4、GPX4和TfR1蛋白表达水平弃去孔板内各孔培养液并用冷PBS缓冲液冲洗,加入RIPA裂解液充分裂解后收集于离心管中,并采用BCA蛋白浓度测定试剂盒测定蛋白浓度。蛋白变性后进行SDS-PAGE电泳,转膜,封闭,并与ACSL4、GPX4、TfR1和β-actin一抗(1∶1 000)4℃孵育过夜。次日,洗膜3次后,室温摇床孵育二抗1 h(1∶1 000)。化学发光显影后采用Image J软件分析蛋白条带灰度值,以β-actin为内参,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/β-actin蛋白条带灰度值。
1.8 统计学分析采用GraghPad Prism 8.0统计软件进行统计学分析。各组细胞中ACSL4、GPX4和TfR1 mRNA及蛋白表达水平,各组细胞中ROS、MDA及Fe2+水平均符合正态分布,以±s表示,多组间样本均数比较采用单因素方差分析,2组间比较采用两独立样本t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组RAW264.7细胞中ACSL4、GPX4和TfR1 mRNA表达水平与对照组比较,处理12和24 h后,实验组RAW264.7细胞中ACSL4 mRNA表达水平明显升高(P<0.05);处理6、12和24 h后,GPX4 mRNA表达水平均降低(P<0.05);处 理12和24 h后,ACSL4和TfR1 mRNA表 达水平升高(P<0.05);与6 h时比较,12和24 h时实验组RAW264.7细胞中ACSL4和TfR1 mRNA表达水平明显升高(P<0.05),GPX4 mRNA表达水平明显降低(P<0.05);与12 h时比较,24 h时实验组RAW264.7细 胞中ACSL4和TfR1 mRNA表达水平明显升高(P<0.05),GPX4 mRNA表达水平明显降低(P<0.05)。见表1。
表1 各 组RAW264.7细 胞 中ACSL4、GPX4和TfR1 mRNA表达水平Tab.1 Expression levels of ACSL4,GPX4 and TfR1 mRNA in RAW264.7 cells in various groups (n=3,±s)
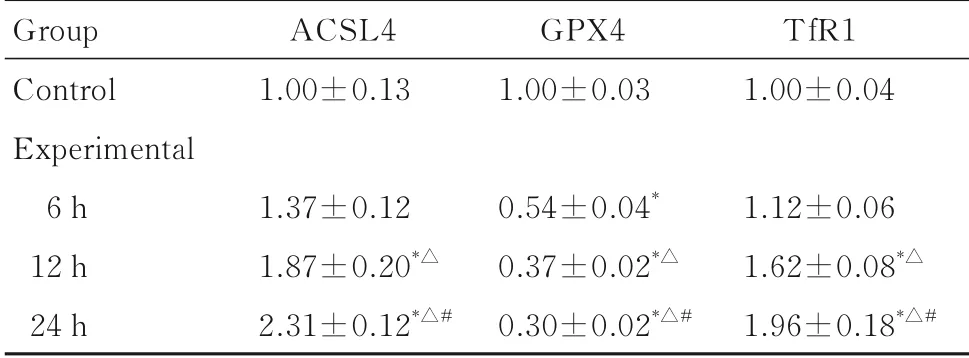
表1 各 组RAW264.7细 胞 中ACSL4、GPX4和TfR1 mRNA表达水平Tab.1 Expression levels of ACSL4,GPX4 and TfR1 mRNA in RAW264.7 cells in various groups (n=3,±s)
*P<0.05 compared with control group;△P<0.05 compared with 6 h group;#P<0.05 compared with 12 h group.
Group Control Experimental 6 h 12 h 24 h ACSL4 1.00±0.13 1.37±0.12 1.87±0.20*△2.31±0.12*△#GPX4 1.00±0.03 0.54±0.04*0.37±0.02*△0.30±0.02*△#TfR1 1.00±0.04 1.12±0.06 1.62±0.08*△1.96±0.18*△#
2.2 各组RAW264.7细胞中ROS水平与对照组比较,处理6、12和24 h后实验组RAW264.7细胞中ROS水平呈时间依赖性升高(P<0.05)。见图1和2。
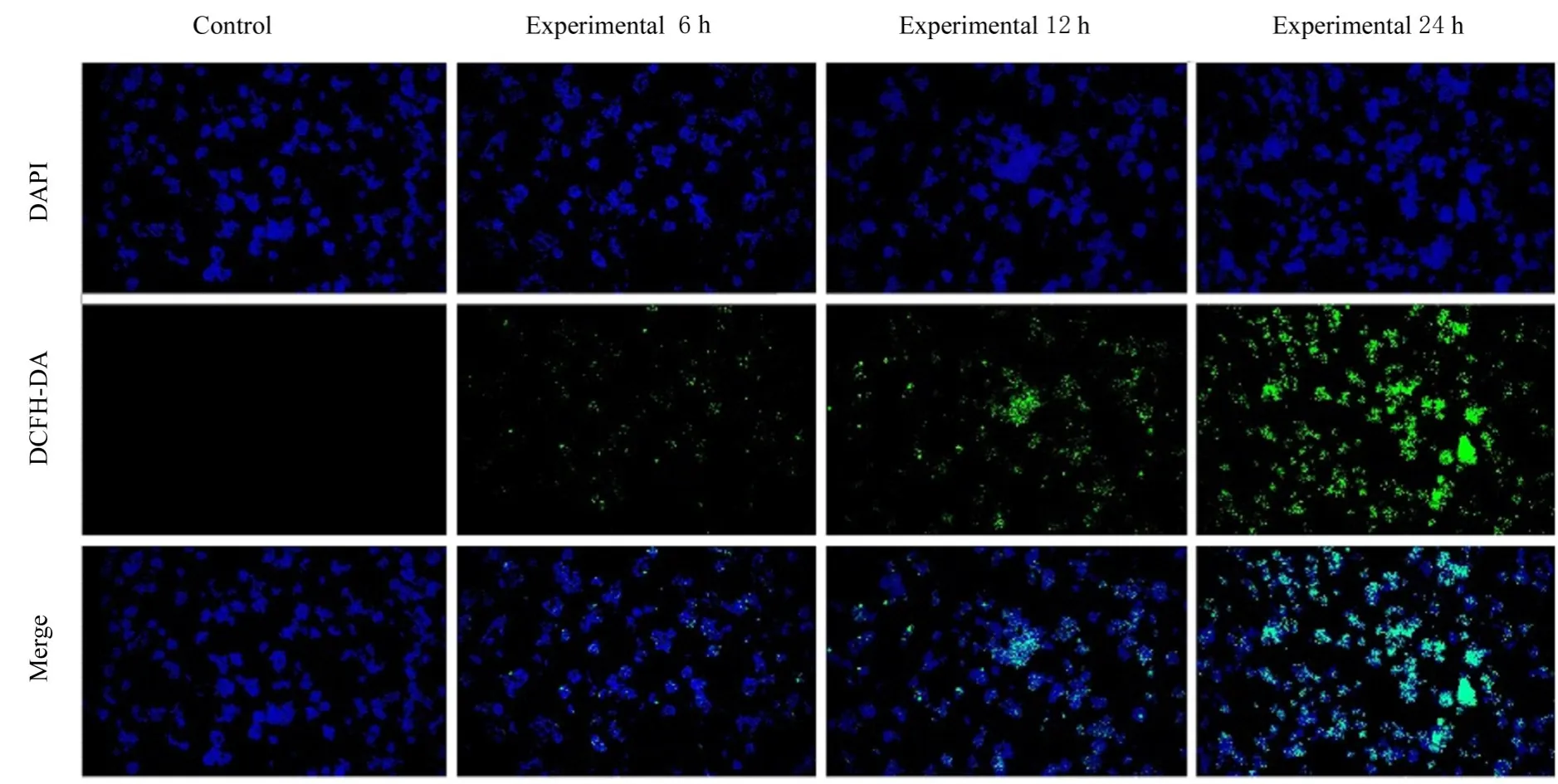
图1 DCFH-DA荧光探针法检测各组RAW264.7细胞中ROS水平(×40)Fig.1 Levels of ROS in RAW264.7 cells in various groups detected by DCFH-DA fluorescence probe method(×40)
2.3 各组RAW264.7细胞中MDA水平与对照组比较,实验组RAW264.7细胞中MDA水平呈时间依赖性升高(P<0.05),并在24 h达到高峰。见表2。
2.4 各组RAW264.7细胞内Fe2+水平与对照组比较,实验组RAW264.7细胞中Fe2+水平升高(P<0.05),且在24 h达到高峰。见表2和图3。

图3 各组RAW264.7细胞中Fe2+荧光染色情况(Bar=50 μm)Fig.3 Fluorescence staining of Fe2+in RAW264.7 cells in various groups(Bar=50 μm)
表2 各组RAW264.7细胞中MDA和Fe2+水平Tab.2 Levels of MDA and Fe2+in RAW264.7 cells in various groups (n=3,±s)
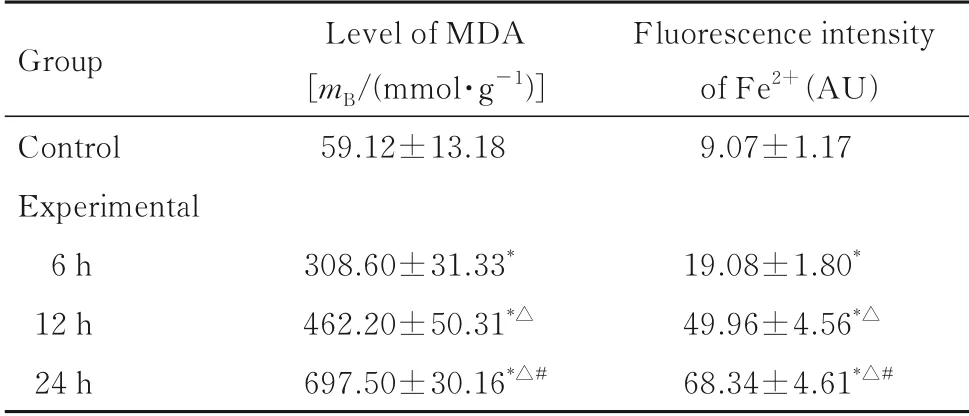
表2 各组RAW264.7细胞中MDA和Fe2+水平Tab.2 Levels of MDA and Fe2+in RAW264.7 cells in various groups (n=3,±s)
*P<0.05 compared with control group;△P<0.05 compared with 6 h group;#P<0.05 compared with 12 h group.
Group Control Experimental 6 h 12 h 24 h Level of MDA[mB/(mmol·g-1)]59.12±13.18 308.60±31.33*462.20±50.31*△697.50±30.16*△#Fluorescence intensity of Fe2+(AU)9.07±1.17 19.08±1.80*49.96±4.56*△68.34±4.61*△#
2.5 各组RAW264.7细胞中ACSL4、GPX4和TfR1蛋白表达水平与对照组比较,6 h时实验组RAW264.7细胞中ACSL4、GPX4和TfR1蛋白表达水平差异均无统计学意义(P>0.05),12和24 h时实验组RAW264.7细胞中ACSL4和TfR1蛋白表达水平升高,且24 h时升高更明显(P<0.05),GPX4蛋白表达水平降低,且24 h时降低更明显(P<0.05)。见图4。
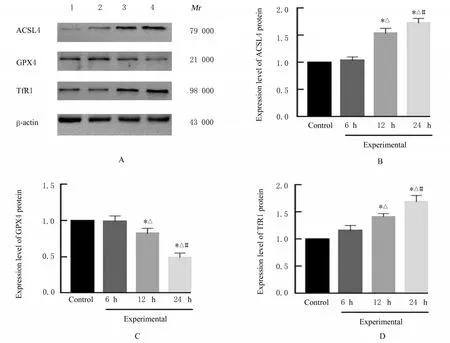
图4 各组RAW264.7细胞中ACSL4、GPX4和TfR1蛋白表达电泳图(A)和直条图(B-D)Fig.4 Electrophoregram(A)and histogram(B-D)of expressions of ACSL4,GPX4 and TfR1 proteins in RAW264.7 cells in various groups
3 讨 论
牙周炎是口腔常见疾病,其发病机制尚未完全阐明。有学者[13]认为宿主对病原菌的持续免疫炎症反应是引起牙周组织损害的重要原因。而巨噬细胞是对抗牙周组织中相关致病菌的第一道防线,其在发挥吞噬病原菌功能的同时,过度活化也会加速牙周组织的破坏[14]。因此探讨以巨噬细胞为中心的炎症调节机制,对明确牙周炎发病机制及其治疗策略具有重要意义。
铁死亡被认为是炎症性疾病调控的新靶点[15]。研究[16-17]表明:巨噬细胞铁死亡已作为动脉粥样硬化的药理学靶点,且抑制巨噬细胞铁死亡可以减轻急性肾损伤。目前,细胞焦亡、细胞凋亡和坏死性凋亡等程序性细胞死亡已被证实与牙周炎有关[18-19],而铁死亡在牙周炎的发病机制中研究较少。已有研究[9-10]表明:牙周炎水平的丁酸可激活核受体共激活因子4(nuclear receptor coactivator 4,NCOA4)介导的铁蛋白吞噬,从而上调ROS水平,最终导致牙周韧带组织中成纤维细胞发生铁死亡,且慢性牙周炎患者牙龈组织中铁死亡相关因子TfR1表达水平升高。

图2 各组RAW264.7细胞中ROS水平Fig.2 Levels of ROS in RAW264.7 cells in various groups
铁死亡是一种铁依赖性的ROS过量积累导致的细胞死亡过程,其主要发生途径包括脂质代谢途径、胱氨酸/谷氨酸反向转运体(System Xc-)/GPX4途径及铁代谢途径[20-22]。脂质代谢途径中ACSL4是铁死亡所必需的物质,通过促进细胞膜磷脂的过氧化反应来驱动铁死亡[23-24];System Xc-/GPX4途径中GPX4为关键调节剂,可将脂质过氧化物还原为脂质醇从而阻止ROS的合成,进而抑制铁死亡[25]。铁代谢途径中TfR1是铁死亡标志物之一,其在细胞表面上的累积导致对铁摄取需求的增加,最终铁运输系统失衡,细胞发生铁死亡[26]。
本研究根据参考文献[27]采用10 mg·L-1P.g-LPS处 理RAW264.7细 胞6、12和24 h后,与对照组比较,12和24 h实验组RAW264.7细胞中ACSL4及TfR1 mRNA和蛋白表达水平升高,GPX4 mRNA和蛋白表达水平降低,与铁死亡3条发生途径中相关物质的表达变化一致。研究[28-29]表明:在生理稳态平衡下,ROS有助于调节多种细胞功能,然而过量的ROS可导致DNA和蛋白质的损伤变性及脂质的过氧化,而脂质过氧化是牙周炎氧化损伤的关键机制。铁死亡发生过程中,通过3条发生途径使细胞内ROS累积,细胞中多不饱和脂肪酸被过量的ROS氧化,导致最终产物MDA的生成,而MDA通常作为氧化应激的指标已被广泛研究[30-32]。本研究分别检测了10 mg·L-1P.g-LPS处 理6、12和24 h后RAW264.7细 胞 中ROS和MDA水平,结果表明:细胞中ROS和MDA水平呈时间依赖性升高,与ACSL4、GPX4和TfR1调控铁死亡发生的特点相符合。WANG等[17]认为:细胞中高水平铁的存在是细胞执行铁死亡的必要条件。铁离子代谢途径中,Fe3+经TfR1转运进入细胞后转变为Fe2+,Fe2+易与H2O2发生芬顿反应,进而导致细胞发生铁死亡[33]。本研究检测了10 mg·L-1P.g-LPS处 理6、12和24 h后RAW264.7细胞中Fe2+水平,结果表明:与对照组比较,随着处理时间的延长,Fe2+水平升高,与TfR1的变化特点一致。
P.g-LPS是牙周炎发病机制中的主要毒力因子,具有有效激活宿主炎症和先天防御反应的能力[34]。Toll样 受 体4(Toll-like receptor,TLR4)是模式识别分子(pattern recognition molecule,PRR)家族的成员之一,在炎症信号通路通过识别病原体并调节炎症反应来发挥重要作用[35]。已有研究[36-38]表明:LPS是TLR4的唯一潜在配体,P.g-LPS仅通过TLR4发挥作用,同时可以上调巨噬细胞中TLR4表达。因此可以认为P.g-LPS通过TLR4来触发巨噬细胞发生炎症。
综上所述,P.g-LPS诱导下RAW264.7细胞中铁死亡相关因子ACSL4和TfR1表达升高,GPX4表达降低,证明P.g-LPS对巨噬细胞中铁死亡相关因子表达有影响。本研究结果为如何靶向控制细胞发生铁死亡提供了更明确的思路,为牙周炎发病机制及今后牙周炎治疗提供了参考依据。

