铜绿假单胞菌寡核苷酸酶的纯化、结晶和活性验证
张建羽,张琼林
(南开大学生命科学学院生物化学与分子生物学系,天津 300071)
铜绿假单胞菌(Pseudomonas aeruginosa,P.aeruginosa)属于条件致病菌,是导致院内感染的主要原因之一[1-2],囊性纤维化、艾滋病、器官移植、烧伤和尿毒症等免疫力低下的人群较易被该菌感染[3]。由于该菌的天然内在耐药性,后天获得性耐药性和适应性耐药性复杂交织,使临床治疗面临巨大的挑战,已被世界卫生组织列入多重耐药(multidrug-resistant,MDR)致病菌[4-5]。
3′,5′-环二鸟苷[Bis-(3′-5′)cyclic diguanylic acid,c-di-GMP]是细菌的第二信使,能够感应胞外信号,通过升高或降低其在胞内的水平,调控胞内相关酶活性,调节细菌行为和多种表型,如运动性、毒力、致病性、抗生素产生、生物膜形成、细胞形态、细胞周期控制和细胞通讯等[6-7]。在P.aeruginosa中,二鸟苷酸环化酶催化三磷酸鸟苷(guanosinetriphosphate,GTP)合成c-di-GMP,磷酸二酯酶A将c-di-GMP线性化为中间产物二鸟苷磷 酸 [5′-phosphoguanylyl-(3′,5′)-guanosine,pGpG],下一步由磷酸二酯酶B(phosplodiesterase-B,PDE-B) 降解为鸟苷单磷酸 (guanosinc monophosphate,GMP), 而 寡 核 苷 酸 酶(oligorbonuclese,Orn)是PDE-B的主要来源[8-9]。由此可见,Orn是胞内c-di-GMP代谢通路中的关键酶。研究[10-11]显示:低水平c-di-GMP能够启动细菌的三型分泌系统致使宿主表现出急性感染症状,而高水平启动六型分泌系统致使宿主表现出慢性感染症状。目前,铜绿假单胞菌寡核苷酸酶(P.aeruginoseOrn,PaOrn)的三维结构尚未见报道。本研究通过表达纯化PaOrn蛋白、蛋白晶体筛选和酶活性实验,探讨该蛋白与P.aeruginosa毒性的关系,为药物靶点开发提供理论依据。
1 材料与方法
1.1 菌株、主要试剂和仪器
pET 32M3C质粒基于pET32a载体改造,将thrombin酶切位点替换为PreScission Protease酶切位点。大肠杆菌(Escherichia coli,E.coli)DH5α菌株购自大连TaKaRa公司,E.coliBL21(DE3)菌株购自北京博迈德公司。质粒提取试剂盒购自北京康为世纪生物科技有限公司,PCR试剂盒购自北京全式金生物技术股份有限公司,LB培养基、琼脂、琼脂糖、氯化钠(NaCl)、咪唑和硫酸镍等购自生工生物工程(上海)股份有限公司,GelRed购自美国Biotium公司,结晶试剂购自美国Hampton Research公司。AKTA纯化系统购自美国通用公司,核酸电泳仪、凝胶成像仪和电泳仪购自美国伯乐公司。
1.2 PaOrn生物信息学预测和分析
通过http://web.expasy.org/protparam/平台对PaOrn蛋白质序列进行基本理化性质分析,包括相对分子质量、氨基酸总数、理论等电点和稳定性推测等,为电泳结果分析、分子筛选和纯化工艺提供指导。通过http://www.cbs.dtu.dk/services/SignalP/平台分析氨基酸序列是否含信号肽,若含信号肽需截去;通过http://www.cbs.dtu.dk/services/TMHMM/服务器分析跨膜区;通过http://blast.ncbi.nlm.nih.gov/Blast.cgi网址分析蛋白结构相似性,若蛋白结构相似度高于30%,可采用分子置换方法解析结构,若低于30%可采用同晶置换和多波长反常散射[12]等方法。
1.3 pET 32M3C-PaOrn重组质粒构建
Orn在P.aeruginosa基因组中编号为PA4951,以P.aeruginosa为扩增模板,通过PCR获得Orn基因片段,采用限制性内切酶BamHⅠ和EcoRⅠ处理Orn片段和质粒pET 32M3C,使基因片段和载体暴露黏性末端,通过T4连接酶将其连接,最后得到pET 32M3C-PaOrn重组质粒;以pET 32M3CPaOrn为模板,PCR定点突变Orn基因,从而获得pET 32M3C-PaOrnD11A、pET 32M3C-PaOrnE13A、pET 32M3C-PaOrnD111A、pET 32M3C-PaOrnH157A和pET 32M3C-PaOrnD162A点突变重组质粒。最终以测序结果为准,将测序正确的重组质粒通过热激法分别转入DH5α和BL21(DE3)中,用于质粒扩增和基因表达。
1.4 Orn的表达和纯化
将菌种以1%(V/V)接种于液体培养基(氨苄青霉素抗性),200 r·min-1、37℃过夜培养。活化后的菌种仍按1%(V/V)接种于液体LB培养基,200 r·min-1、37℃培养4 h。低温16℃诱导表达,诱导剂IPTG终浓度0.3 mol·L-1,诱导培养16 h。4 000 r·min-1离 心20 min收 集 菌 体,使用20 mol·L-1Tris和150 mol·L-1NaCl(pH 8.0)缓冲液重悬。重悬菌液采用高压匀浆破碎仪850 MPa、4℃破碎菌液,破碎液4℃、18 000 r·min-1离心45 min后取上清液冰浴。①Ni亲和层析:目标蛋白的组氨酸(histidine,His)标签可与Ni填料结合,蛋白液以2 mL·min-1流速与Ni色谱柱结合,使用平衡缓冲液洗去非特异性结合,向层析柱中加入0.2 mg PreScission Protease蛋白酶,取下Ni色谱柱4℃保持48 h;使用平衡缓冲液冲洗Ni色谱柱,PaOrn和PreScission Protease蛋白酶被冲洗去除,融合标签保留于Ni色谱柱上。②GST亲和层析:酶切引入PreScission Protease蛋白酶带有GST标签,可经GST亲和层析去除。采用20 mmol·L-1Tris(pH 8.0)缓冲液冲洗GST色谱柱,样品溶液缓慢滴加至重力层析柱,同时收集穿透液。③阴离子交换层析:采用20 mmol·L-1Tris(pH 8.0)缓冲液冲洗色谱柱,将GST层析的洗脱液以2 mL·min-1流速上样,平衡缓冲液洗去非特异性结合,缓冲 液20 mmol·L-1Tris和1 mol·L-1NaCl(pH 8.0),以0%~50%、90 min的线性梯度洗脱,收集1.2 mL洗脱液,根据收集管内聚丙烯酰胺凝胶结果收集样品。使用超滤浓缩管浓缩样品并将PaOrn蛋白置换至20 mmol·L-1Tris(pH 8.0)缓冲液中,-80℃条件下保存。
1.5 晶体条件筛选
采用商业化结晶试剂和坐滴法筛选晶体。初筛试剂各取100 μL,对应加入至48孔结晶板中。PaOrn样品配制为5和10 g·L-1工作浓度,分别取1 μL滴入结晶孔,池液1 μL悬滴于样品上,胶带密封结晶板。结晶板置于16℃恒温室静置,3 d后采用倒置显微镜观察结晶情况。PaOrn晶体与GMP以1∶3摩 尔 比 共 同 孵 育,PaOrnD11A晶 体 与pGpG以1∶3的摩尔比共同孵育,16℃孵育3 d。
1.6 尿素聚丙烯酰胺(Urea-PAGE)法验证PaOrn活性
PaOrn水解10 nt RNA产物经Urea-PAGE法鉴定[13]。分 别 配 制0.1 mmol·L-110 nt RNA和0.13 mmol·L-1PaOrn蛋白,稀释液均为20 mmol·L-1Tris、100 mmol·L-1NaCl和2 mmol·L-1二氯化锰(MnCl2),pH 8.0,冰浴。将0.1 mmol·L-110 nt RNA(36 μL)和0.13 mmol·L-1PaOrn溶液置于37℃水浴中预热5 min,向预热的底物中加入1.8 μL PaOrn,迅速斡旋混匀,分别在如下反应时间取样4 μL:0、2、4、6、8、10和20 min。迅速取样,并立即加入甲酰胺缓冲液,95℃加热5 min,冰浴5 min,13 000 g离心10 min,取同体积的上清液上样。采用300 V电压预电泳3 min,然后 电压调至220 V运行40 min。取出胶片,去离子水清洗3遍,GelRed[14]染 色15 s,立 即 取 出 并 采 用ChemiDocMP成像系统拍照。
1.7 高分辨质谱法验证蛋白活性
配 制0.01 mmol·L-1pGpG和0.13 mmol·L-1PaOrn蛋 白,稀 释 液 均 为20 mmol·L-1Tris,pH 8.0。取40 μL pGpG溶液,放入37℃水浴中预热5 min,向 其 中 加 入0.13 mmol·L-1PaOrn溶液1.12 μL,反 应8 s后 立 刻98℃加 热10 min,18 000 g离心10 min,取25 μL上清液进行高分辨质谱Q TOF[15]定性分析,采用MassLynx软件分析数据,验证PaOrn蛋白活性。
2 结 果
2.1 PaOrn生物信息学分析
PaOrn相对分子质量为20 826,由180个氨基酸组成,理论等电点为5.48,摩尔吸光系数ε为1.349 g·L-1,PaOrn亲水指数为-0.494,属于亲水性蛋白。PaOrn无信号肽,无需修改氨基酸残基序列,见图1 A。PaOrn不含跨膜区,非膜蛋白,可选择常规纯化和结晶,见图1 B。PaOrn是3′,5′核酸外切酶超家族核酸外切酶家族(Psp-Glu-Asp-His,DEDDh)的一员,成员拥有相似的结构域,见图1 C。PaOrn与霍乱弧菌寡核苷酸酶VcOrn(PDB ID∶6N6A)[16]有71.59%同源性。

图1 PaOrn的生物信息学分析Fig.1 Bioinformatic analysis of PaOrn
2.2 PaOrn的表达和纯化
2.2.1 Ni亲和层析PaOrn携带硫氧还蛋白(thioredoxin,Trx)标签(相对分子质量12 000)、His标签和连接肽(相对分子质量为2 590),PaOrn相对分子质量为20 826,故重组蛋白相对分子质量为35 416。目的蛋白有明显的胞内可溶表达,并且表达量可观,见图2。按照咪唑浓度梯度洗脱,流速4 mL·min-1,设置洗脱线性梯度0%~60%缓冲液B(20 mmol·L-1Tris,150 mmol·L-1NaCl,500 mmol·L-1咪 唑),洗 脱90 min。泳 道1~7为洗脱峰。收集洗脱峰,收集液中加入PreScission™Protease蛋白酶切标签,混合均匀置于4℃环境中,酶切16 h。见图3。

图2 SDS-PAGE分析PaOrn蛋白表达电泳图Fig.2 Electrophoregram of expression of PaOrn analyzed with SDS-PAGE

图3 PaOrn的Ni亲和层析Fig.3 Ni affinity purification of PaOrn
2.2.2 GST亲和层析 低温酶切后,大多数标签被切下,以满足下一步纯化需求。经GST纯化后,去除残留的PreScission™Protease蛋白酶。收集GST层析后的洗脱液,使用透析袋去除蛋白样品中的盐类,最终透析至20 mmol·L-1Tris pH 8.0缓冲液中。在透析10 h内无蛋白降解,蛋白稳定性好。见图4。

图4 PaOrn的GST亲和层析Fig.4 GST affinity purification of PaOrn
2.2.3 阴离子交换层析 阴离子交换层析图中,主峰(3E12~4A2)和杂质峰(4A2~4D3)能够实现良好分离。在主峰前半段,即3E12~3F10,有相对分子质量较大的杂质;在主峰后半段,即3F10~4A2,纯度较高,在电泳图上无杂质条带,可用于结晶。杂质峰中降解物比例偏高。见图5。
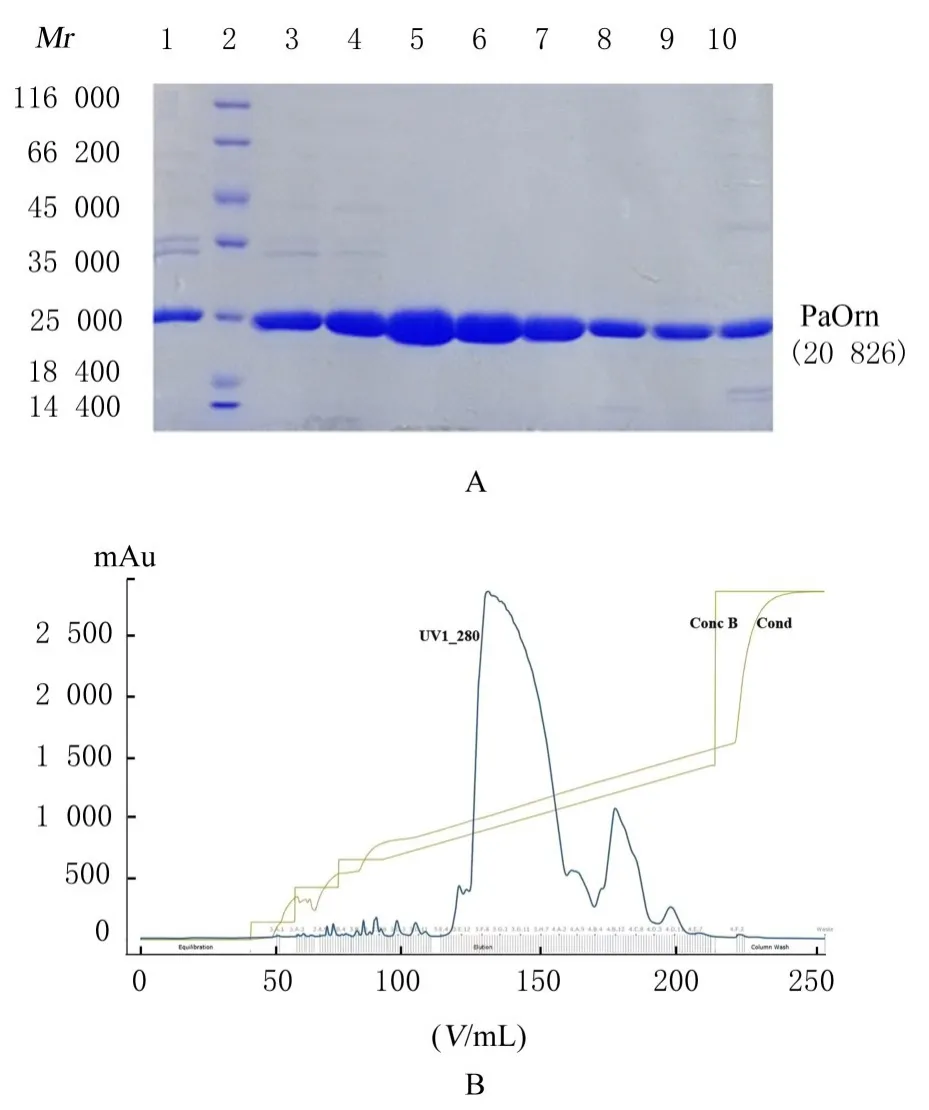
图5 PaOrn的Q阴离子交换层析Fig.5 Q anion exchange purification of PaOrn
阴离子交换洗脱液因含高浓度盐溶液,故需通过超滤浓缩的方式浓缩并置换缓冲液,最终浓缩至20 mmol·L-1Tris(pH 8.0)中,浓度为20 g·L-1。浓缩后蛋白纯度高,可用于结晶,见图6。浓缩物分装冷冻保存,避免反复冻融。

图6 PaOrn浓缩物的SDS-PAGE分析Fig.6 SDS-PAGE analysis of PaOrn concentration
2.3 PaOrn结晶条件筛选及优化
初筛时,PaOrn可于多种条件下出现晶体,如WizardⅠ#18、WizardⅢ#4、WizardⅣ#20、WizardⅡ#48、Index #62、PEG/IonⅡ#29和PEG/IonⅡ#33等。经X射线衍射验证,均无法用于解析蛋白结构。于WizardⅠ#12:1.0 mol·L-1(NH4)2HPO4、0.1 mol·L-1Imidazole、pH 8.0条件下出现形状规则的晶体。经衍射,该晶体的分辨率 为1.85,PaOrn-GMP和PaOrnD11A-pGpG复 合物的分辨率分别为1.90和1.70。见图7。

图7 PaOrn及其复合物晶体图Fig.7 Photoes of crystals of PaOrn and its complexes
2.4 PaOrn核酸降解实验
因PaOrn能够降解2~5 nt RNA[17],故本研究设计了10 nt长度的降解实验验证其是否可降解更长的底物核酸片段。在Mg2+催化下,反应20 min后,10 nt nanoRNA已被彻底水解。在Mn2+催化下,反应6 min后,10 nt nanoRNA即可被彻底水解。因此,PaOrn能够降解更长片段的寡核苷酸,且Mn2+催化效率更高。PaOrn的DEDD位点Asp11、Glu13、Asp111、His157和Asp162突变后,无法降解底物10 nt nanoRNA,表明酶活性已经丧失。见图8。
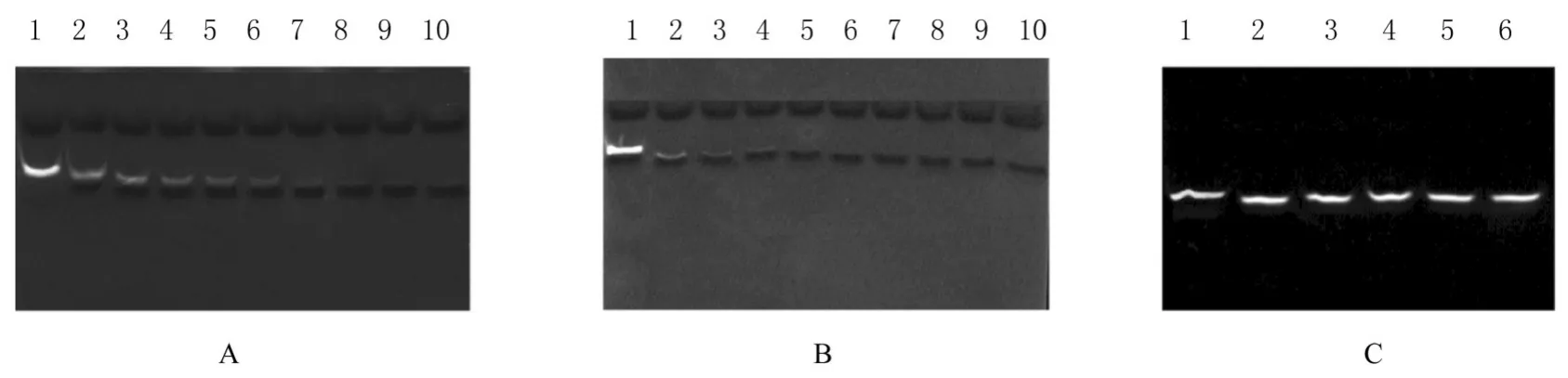
图8 Urea-PAGE法分析核酸降解Fig.8 Nucleic acid degradation analyzed by Urea-PAGE method
2.5 PaOrn降解底物的定性分析
高分辨率质谱Q TOF可精确定性,相对分子质量精确至小数点后4位。目标检测物为核酸,使用离子对试剂三乙胺和六氟异丙醇增强的分析能力[18]。由于底物pGpG昂贵,因此上样量较少,质谱基线抬高。本研究严格控制反应时间,使底物pGpG未反应完全。pGpG(Mr 707.09)可被纯化的PaOrn降解为GMP(Mr 362.05)。见图9。该结果与其他来源的Orn活性研究[19]相吻合,Orn降解pGpG为GMP。
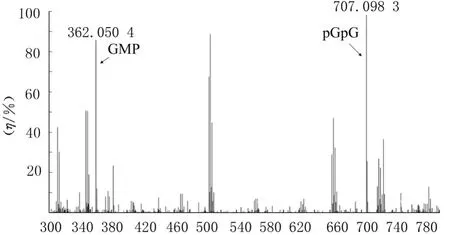
图9 高分辨率质谱Q TOF定性分析Fig.9 Qualitative analysis by high-resolution mass spectrometry Q TOF
3 讨 论
P.aeruginosa因其条件致病性和多重耐药性使常规临床治疗效率变低或无效,目前尚无有效且长期的治疗方案,严重威胁到人类生命健康。PaOrn作为第二信使c-di-GMP代谢途径中的重要参与者,对细菌的耐药性和毒性起到关键的调节作用。
本研究经PaOrn蛋白表达、Ni亲和层析、GST亲和层析和IEX-Q阴离子交换层析多步纯化,获得高纯度PaOrn蛋白,并筛选出晶体PaOrn(1.85)、PaOrnD11A-pGpG(1.70)和PaOrn-GMP(1.90)。高分辨质谱结果显示:PaOrn能够将pGpG降 解 为GMP,在P.aeruginosa中,Orn又是降解pGpG的主要来源,因此Orn可通过调节c-di-GMP水平发挥菌体的多种生物学作用,如毒力、生物被膜形成及运动能力。与其他来源Orn序列比对,找到DEDDh位点,通过点突变实验 获 得 突 变 蛋 白 (OrnD11A、OrnE13A、OrnD111A、OrnH157A和OrnD162A),经活性验证,点突变致使酶活性完全丧失。这些保守的活性位点可组成一个偏碱性的活性口袋,推测金属阳离子可能优先进入催化区域,寡核酸底物通过金属离子的定位及路易斯酸碱作用进入活性口袋。二价金属阳离子Mn2+的催化效果要优于Mg2+,推测可能Mn2+更容易与核酸形成络合物,募集底物进入催化空间。本研究中核酸降解实验结果显示:PaOrn除能够水解天然底物pGpG和2~5 nt RNA外,还可降解长达10 nt RNA。与霍乱弧菌VcOrn(PDB ID 7V5H)、大肠杆菌EcoOrn(PDB ID 1YTA)和贝纳特氏立克次体CbuOrn(PDB ID 3TR8)等其他来源的Orn结构比较显示:活性口袋均有“三明治”夹层结构,能够较好地固定底物,可能通过His残基激活水分子传递电子,促使磷酸二酯键断裂。底物越短,越有利于其与活性口袋的结合;底物越长,越不利于口袋的捕获[20]。PaOrn可降解更长片段的底物,但由于抓取力不够,催化效率和结合力均可能会变弱。当DEDD活性位点突变时,PaOrn完全丧失催化活性,而PaOrn又是降解中间代谢产物pGpG的主要来源,若P.aeruginosa中Orn失活,则第二信使c-di-GMP水平升高。研究[21]显示:c-di-GMP水平升高会激活T6SS慢性感染系统,降低T3SS急性感染系统,推测P.aeruginosa急性毒力减弱。PaOrn与P.aeruginosa毒力之间存在密切关联,针对PaOrn晶体结构和活性的研究具有重要的意义,可为研究潜在的药物靶点提供理论依据。

