运动对SAMP8小鼠海马tau蛋白磷酸化的影响
张庆茹 乔会敏 田惠杰 董梅 吴冰洁
阿尔茨海默病(Alzheimer’s disease, AD)是发生在老年及老年前期,以进行性认知障碍和行为损害为特征的中枢神经系统退行性病变,严重影响老年人的生活质量。Tau蛋白异常过度磷酸化形成神经纤维缠结是AD常见的病理表现[1]。全世界约有1/3的AD患者可能因为某些可干预的危险因素而加剧病情,如糖尿病、高血压、中年肥胖、低水平的身体活动、抑郁、吸烟和低文化水平等。适度的体育活动(如慢跑和步行)可以降低AD的发生率[1, 2]。快速老化P8小鼠(senescence-accelerated mouse/prone 8, SAMP8)是一种自然发病的AD模型。本研究组以往的研究发现,运动能够改善SAMP8小鼠的学习和记忆能力[3],延缓海马神经元变性,降低海马β淀粉样蛋白及淀粉样蛋白前体蛋白的表达[4],提高突触素表达[5]。本实验将通过研究跑笼运动对SAMP8小鼠海马tau蛋白磷酸化的影响,以进一步完善运动改善SAMP8小鼠认知功能的病理学机制。
1 材料与方法
1.1 动物与分组 SAMP8小鼠由香港中文大学解剖系姚大卫教授赠送。所有小鼠接受标准啮齿类食物并自由进水。入选小鼠经过预选,有明显缺陷(外部肿瘤、运动能力受限)的被剔除。雄性3月龄SAMP8小鼠20只。小鼠按随机化原则进行分组,分为跑笼运动组和模型对照组,每组10只小鼠。另外,选取体重相匹配的雄性3月龄SAMR1小鼠10只作为正常对照组。
1.2 运动训练方法 SAMP8跑笼运动组进行跑笼运动训练。使用直径15 cm、栅距1 cm圆形跑笼,小鼠放入跑笼内,自主运动开始后计时。第1个月:5 d/周,10 min/d;第2个月:5 d/周,20 min/d。SAMP8模型对照组及SAMR1正常对照组不接受跑笼运动。
1.3 免疫组织化学检测 每组10只小鼠,采用4%水合氯醛麻醉(0.03 mg/g),快速开胸暴露心脏,经左心室插管,剪开右心耳,灌注0.9氯化钠溶液,待冲净血液后,灌注4%多聚甲醛,断颈取鼠脑,标本固定于4%多聚甲醛。24 h后将固定好的组织块经脱水,透明、石蜡包埋备用。行6 μm厚连续冠状切片,采用免疫组织化学SP法染色(具体操作步骤参照试剂盒说明书)。兔抗IgG多克隆抗体购于武汉三鹰生物公司,SP9001试剂盒及DAB显色剂购于北京中衫生物技术有限公司。3,3’-二氨基联苯(DAB)显色,常规脱水、透明、封片。阴性对照用磷酸盐缓冲液(PBS)替代一抗,余步骤相同。于光学显微镜下观察tau蛋白(T-tau)免疫组织化学阳性产物的分布,在相同的放大倍数下,每个标本计数3张切片,每个切片计数10个视野,采用厦门麦克奥迪仪器仪表有限公司生产Motic Med6.0数码医学图像分析系统测定海马CA1区免疫反应产物的光密度值,以阳性细胞染色的平均光密度值(OD)值来表示抗原表达量。
1.4 Western blot检测 每组小鼠各称取约20 mg海马组织研磨,充分匀浆后按海马:裂解混合液=1 mg ∶10 μl 加入裂解混合液,冰上裂解约1.5 h,每20 分钟取出涡旋1次;低温高速离心10 min(4℃、8 000 r/min),取上清液分装待测。在组织蛋白样本管中按体积比=4∶1加入上样缓冲液,混匀后在100℃沸水中水浴5 min。样本蛋白经凝胶电泳分离后,将目的蛋白转至PVDF膜。转完膜后于 5%脱脂牛奶中封闭 2 h,洗膜后加入一抗[p-Tau(Ser396)抗体和β-actin 抗体稀释比例均为1∶1 000],4℃冰箱孵育过夜。次日洗膜后加二抗(抗体稀释比例1∶10 000),于37℃ 恒温箱中孵育 60 min。洗膜后于蛋白印迹仪器中显色拍照。分析蛋白条带上各处理组 p-Tau(Ser396)和β-actin 蛋白的灰度值,p-Tau(Ser396)与β-actin 蛋白灰度值之比即为 p-Tau(Ser396)蛋白相对表达量。一抗购自拜奥德生物有限公司,二抗购自美国KPL公司。
2 结果
2.1 小鼠海马CA1区形态改变 与SAMR1正常对照组比较,HE染色可见SAMP8模型对照组的小鼠海马CA1区部分神经元细胞变性、死亡,细胞核浓缩,空泡变性;SAMP8跑笼运动组偶有神经元细胞变性、死亡,大部分细胞形态正常。见图1。
图1 小鼠海马CA1区形态改变(HE染色×400)
2.2 海马CA1区T-tau表达 免疫组化结果显示3组间海马CA1区T-tau免疫阳性反应产物的光密度值差异有统计学上意义(P<0.01)。组间两两比较,SAMP8跑笼运动组较SAMP8模型对照组光密度减低(P<0.01);SAMR1正常对照组较跑笼运动组光密度减低(P<0.01)。见图2,表1。
表1 海马CA1区T-tau免疫反应产物的光密度值
图2 小鼠海马CA1区T-tau蛋白表达(×400)
2.3 海马P-tau(Ser396)水平 Western blot 实验结果显示,3组间海马p-Tau (Ser396)表达差异有统计学意义(F=97.976,P<0.01)。组间两两比较,SAMP8跑笼运动组较SAMP8模型对照组表达减低(P<0.01);SAMR1正常对照组较跑笼运动组表达减低(P<0.01)。见表2,图3。

图3 海马P-tau水平
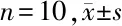
表2 海马P-tau水平
3 讨论
快速老化小鼠是20世纪90年代京都大学武田公司从AKR/J小鼠中培育出来的一种快速衰老的小鼠株系。 其中SAMP8小鼠表现出衰老相关性神经特征,而月龄相匹配的SAMR1常被作为SAMP8的正常对照[6]。
本研究发现,跑笼运动可以延缓SAMP8小鼠海马CA1区神经元的变性坏死并减少T-tau和P-tau的沉积。SAMP8跑笼运动组和SAMR1正常对照组相比较,结果显示,跑笼运动未能使SAMP8小鼠海马CA1区神经元细胞形态和tau沉积的改善达到正常同龄SAMR1小鼠水平。Jiang等[7]研究表明4个月的运动对年幼APP/PS1小鼠的空间学习能力和记忆能力有显著的改善作用,同时延缓了海马萎缩和神经元凋零。这与之前的本课题组有关SAMP8小鼠的系列研究的结论[3,4]一致。Chao等[8]也得出相似的结论,同时还表明运动可以减少AD样小鼠的淀粉样沉积,诱导神经发生,延缓神经元丢失,促进新生神经元的生存。
运动是预防或者延缓认知功能下降的一种非药物性治疗手段。运动可影响颅内血管生理功能、海马体积和神经发生过程3个方面[9],对认知功能产生正面改善作用。海马组织与人类的情景记忆功能密切相关,这种功能在AD早期就出现明显的损害。轻度至中度的超过1年的体育锻炼可以防止海马体积的萎缩[10]。SAMP8小鼠模型的特点是学习及记忆能力的显著下降,同时也可以伴随皮肤老化、心脏功能衰退、情绪焦虑和听力障碍等症状,SAMP8小鼠在AD研究应用中发挥着重要作用[11]。3月龄SAMP8小鼠的脑组织病理的大脑皮质、纹状体和海马中就开始出现tau蛋白过度磷酸化[12],4月龄的时候就有认知障碍的表现[13]。
Tau蛋白是一种微管相关蛋白,对维持神经元的功能和结构完整性起着重要的作用;同时它也参与轴突运输和微管聚合等神经生理过程。但是细胞内过度磷酸化或者异常磷酸化的tau聚集会形成病理性tau。在AD的病理结构中,过度磷酸化的tau蛋白会首先沉积于嗅内皮层和海马,然后才发展至脑内新皮质区域[14]。目前在国内外的动物实验中,关于跑笼运动对AD模型小鼠tau影响的相关文献还是比较少的。Liu等[15]对APP/PS1转基因AD小鼠给予5个月的跑笼运动干预,结果显示长期的跑步运动可以延缓tau的过度磷酸化,阻止AD的神经病理学进展。关于运动对AD tau过度磷酸化的影响机制,目前的文献研究中尚不明确,而且不同的研究结果之间还存在争议。Liu等[15]的动物实验提供一些研究证据,表明tau蛋白激酶GSK3是运动和tau过度磷酸化之间的中介物质。但是Gratuze等[16]认为跑笼运动对动物的tau蛋白激酶没有影响,如GSK3、CDK5、JNK和CamKII等激酶。有关此方面的机制,尚还需要未来大量的实验观点来完善。
总而言之,给予SAMP8小鼠2个月的跑笼运动干预,能改善tau蛋白在海马CA1区的积聚,还可以延缓海马神经元变性,能抑制tau的过度磷酸化。虽然这种改善不足以使SAMP8的tau蛋白沉积和神经元变性达到正常小鼠的病理水平,但是运动干预在SAMP的病理上还是有显著积极影响的。

