多形性黄色星形细胞瘤临床病理分析
刘宏雷 易力 杨建凯 郭闪 褚晓磊
目前的研究中发现,多形性黄色星形细胞瘤(pleomorphic xanthoastrocytoma,PXA)相对罕见,占所有星形细胞肿瘤的比例<1%[1],最早是由Kepes等[2]在1979年首次报道,之后随着人们对PXA的认识,报道逐渐增多,但大宗病例很少。PXA好发于儿童和青年,大多数肿瘤位于大脑表面,累及皮质和脑膜,最常见的部位是颞叶,癫痫发作是最常见的症状。关于其组织学分级,在2007年第四版WHO中枢神经系统肿瘤分类中,认为PXA是WHOⅡ级的肿瘤,如果伴有明显核分裂(≥5个/10HPF)和(/或)坏死的病例则诊断为“伴有间变特征的PXA”[3]。而在2016年的WHO中枢神经系统肿瘤分类的第四版修订版中,则将那些核分裂象≥5 个/10HPF,伴或不伴坏死的PXA作为一个单独实体,命名为间变型多形性黄色星形细胞瘤(anaplastic pleomorphic xanthoastrocytoma, A-PXA),相当于WHOⅢ级[4]。本文收集31例PXA,分析总结其临床病理特征、免疫表型及分子检测结果,旨在进一步认识此肿瘤。
1 资料与方法
1.1 一般资料 收集2017年8月至2020年8月之间河北医科大学第二医院病理科诊断的31例PXA的病理及临床资料。收集存档切片由2名高年资病理医师分别进行阅片和复审。
1.2 方法
1.2.1 免疫组织化学方法:标本经4%中性环保甲醛液固定后取材,LEICA ASP300S全自动脱水机:固定-脱水-透明-浸蜡,石蜡包埋,4 μm厚度连续切片,HE染色。VENTATN全自动免疫组织化仪:组织前处理,脱蜡水化,抗原修复,封闭(过氧化物酶抑制剂),一抗加样,二抗加样,DAB显色,苏木精复染及蓝染,封片。Vimentin、CD34购自上海罗氏制药有限公司,IDH1、Oligo-2购自基因科技(上海)股份有限公司,其余抗体GFAP、ATRX、EMA、Nestin、NeuN、NF、P53、S-100、Syn均购自福州迈新生物技术开发有限公司。
1.2.2 荧光PCR方法:DNA提取试剂盒(厦门艾德生物医药科技有限公司)对石蜡标本提取DNA,紫外分光光度计检测DNA浓度及OD值。分别使用人类BRAF基因V600E突变检测试剂盒(厦门艾德生物医药科技有限公司)、人IDH1基因突变试剂盒(北京泛生子基因科技有限公司)和人TERT基因启动子突变检测试剂盒(北京泛生子基因科技有限公司),严格按照说明要求操作,检测上述基因是否存在突变。
1.2.3 FISH检测:采用LSI 1p36/LSI 1q2探针和LSI 19q13/19p13 探针(美国雅培公司),1p和19q 用红色荧光标记,1q和19p用绿色荧光标记,实验步骤参照探针说明书进行,由病理医生完成结果判断。
2 结果
2.1 临床特点 31例中,男15例,女16例;发病年龄3~69岁,中位年龄37岁;发病部位大脑表面28例颞叶15例,额叶11例,顶叶2例,侧脑室2例,桥脑1例。影像学检查结果:在典型病例中肿瘤位于大脑表面,和周围脑组织分界清楚,肿瘤呈囊性,伴实性的附壁结节,瘤周水肿不明显,增强扫描后,肿瘤实性区和囊壁区呈不同程度强化。临床表现以癫痫为首发症状16例,表现为头痛12例(其中4例伴有恶心呕吐),表现为头晕2例,表现为视物模糊1例。见图1、2,表1。

图1 颅脑MRI检查示右顶叶边界清楚,囊实性占位,瘤周水肿不明显图2 肿瘤实性区域和囊壁明显强化

表1 多形性黄色星形细胞瘤患者的临床特征
2.2 病理特点
2.2.1 大体检查:所有病理为手术切除后的送检组织,破碎,部分呈囊壁样,实性区切面灰白灰红,质地较软。
2.2.2 镜下观察:肿瘤细胞呈多形性,以梭形细胞为主,混合多核或单核星形巨细胞,巨细胞核深染,还可见到核内包涵体;可见到胞浆内富含脂质的黄色瘤星形细胞及嗜伊红颗粒小体;肿瘤间质或小血管周围灶性淋巴细胞聚集,可以形成血管周围“袖套”现象;网状纤维染色显示每一个肿瘤细胞都被网状纤维包绕。在Ⅲ级的PXA中,局灶性或弥漫性核分裂像活跃,达到≥5个/10HPF,坏死经常可以看到。见图3~8。

图3 肿瘤细胞多形性,梭形细胞中混合单核和多核星形巨细胞(箭头所示)(HE×10) 图4 肿瘤细胞多形性,梭形细胞中混合单核和多核星形巨细胞(箭头所示)(HE×20)
2.2.3 免疫组织化学结果:GFAP、Nestin、Vimentin、Oligo-2和S-100蛋白在31例PXA中全部呈阳性表达。22例Ⅱ级PXA中有14例CD34呈阳性表达,阳性率63.6%,9例Ⅲ级PXA中CD34有4例阳性表达,阳性率为44.4%。P53、NF和Syn在不同级别的PXA中均有不同程度的表达。其余指标包括IDH1、ATRX、EMA和NeuN均为阴性表达。Ki-67增殖指数在22例Ⅱ级PXA中为1%~5%,在9例Ⅲ级PXA中为10%~30%。见图9~12,表2。

图5 肿瘤内可见黄色瘤星形细胞和嗜伊红颗粒小体(箭头所示)(HE×20) 图6 肿瘤血管周围淋巴细胞浸润,形成淋巴细胞“袖套”(箭头所示)(HE×4)

图7 在Ⅲ级PXA中核分裂易见(箭头所示)(HE×40) 图8 在Ⅲ级PXA中局灶可见坏死(HE×4)

图9 A肿瘤细胞GFAP呈阳性表达(EnVision法×10) 图10 肿瘤细胞CD34阳性(EnVision法×10)

图11 肿瘤细胞IDH1阴性表达(EnVision法×4) 图12 肿瘤细胞Ki-67增殖指数热区约10%(EnVision法×4)

表2 不同级别多形性黄色星形细胞瘤免疫组化表达情况 例(%)
2.3.4 荧光PCR结果:在22例PXAⅡ级病例中BRAF V600E检测到突变的有9例,突变率为40.9%,9例Ⅲ级中BRAF V600E突变型为3例,突变率为33.3%。TERT突变率在Ⅱ级和Ⅲ级病例中分别为4.5%(1/22)和44.4%(4/9),其中TERT C228T在22例PXAⅡ级病例中未见突变,在9例Ⅲ级病例中突变率为22.2%(2/9),TERT C250T在PXAⅡ级中的突变率为4.5%(1/22),而在Ⅲ级病例中TERT C250T中突变率为22.2%(2/9)。所有的31例PXA中IDH1 R132H均为野生型。FISH检测结果:在31例PXA中,仅有1例Ⅲ级病例中存在19q缺失,其余病例均未见1p和19q缺失。见图13、14,表3。
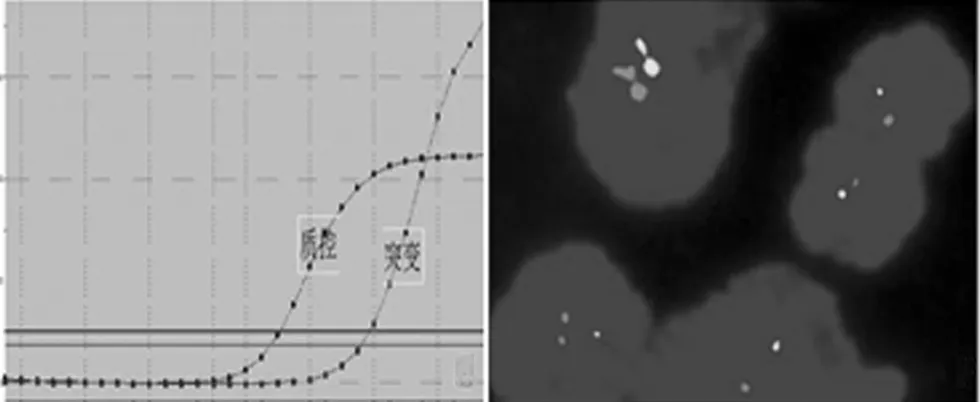
图13 荧光PCR检测BRAF V600E突变阳性扩增 图14 FISH结果示肿瘤细胞中红色信号等于绿色信号,1p和19q不存在缺失

表3 不同级别多形性黄色星形细胞瘤分子检测结果 例(%)
2.2.5 随访:所有患者进行了肿物手术切除,依据术后病理诊断结果,进行了不同程度的放化疗。31例患者均获得随访资料,随访时间10~47个月,最后随访日期至2021年6月30日,死亡2例,存活29例。PXAⅡ级22例中,有6例肿瘤复发进行了再次手术,其中2例进展为A-PXA。PXAⅢ级9例中,进展死亡2例,复发3例。
3 讨论
3.1 临床特征 PXA好发于儿童和年轻人,男女患者的比例相当,绝大多数肿瘤发生在幕上大脑表面,最常见的是颞叶[5]。临床表现以癫痫发作为最常见症状,其次是头痛和呕吐,还可表现为肢体无力,视力障碍等[6,7]。影像学检查多为囊实性占位,增强型[8]。总之,本研究病例临床特征与文献报道[5-8]基本相同。
3.2 病理特征 文献报道及本组病例中,形态学表现大致相同,都显示了PXA的典型诊断特征在A-PXA病例中,部分区域有丝分裂活性≥5个/10HPF(或)伴有坏死,但是单独只有坏死不足以诊断A-PXA[4]。在间变性转化方面,PXA已被充分证明可显示其他多种组织学模式,包括上皮样、纤维状或小细胞形态[9,10]。在本组2例进展为A-PXA病例中,1例保留了PXA的组织学特征,局灶表现为典型A-PXA形态,而另1例则进展后和胶质母细胞瘤无法区分。
3.3 免疫表型及分子检测 PXA的免疫表型特征是具有恒定的神经胶质蛋白表达[11],如GFAP、Nestin、Oligo-2和S-100等,并且部分病例具有神经元分化倾向[12],所以神经元标记如Syn、NF和MAP2等会有不同程度的表达。出现CD34阳性表达是PXA的特点之一[13]。本组病例中PXAⅡ级和Ⅲ级表现为随着级别的升高CD34的阳性率下降,和文献报道[13]相符。
BRAF V600E是PXA最常见的分子改变,在Vaubel等[5]对于PXA的研究中报道,BRAF V600E的突变率为76.1%,包括PXA(79.2%)和A-PXA(64.3%),在本组系列研究中,BRAF V600E的突变率为38.7%,其中PXA中40.9%(9/22)而A-PXA中33.3%(3/9),均低于文献报道[5],可能和标本组织量较少导致阳性率降低有关。还有一些研究在少数病例中发现了TERT突变,并认为TERT突变可能与PXA的恶性转化及患者不良预后有关[5,14]。本研究中TERT突变率在Ⅱ级和Ⅲ级PXA中分别为4.5%(1/22)和44.4%(4/9),但是在2例进展病例中未检测到TERT的表达,是否和患者的不良预后有关,还有待进一步随访。
3.4 随访及预后 手术切除是目前对PXA的首选治疗方法[15]。本组31例中,随访存活29例(93.5%),高于文献报道[6,16],可能是由于随访时间较短。存活29例中,复发9例,其中2例恶性转化,复发及恶性转化率为31%(9/29),和文献报道[15,16]基本相同。
3.5 诊断和鉴别诊断 PXA应和多种形态学相似的脑肿瘤进行鉴别。(1)上皮样胶质母细胞瘤(epithelioid glioblastoma, eGBM):eGBM组织学表现为有丰富嗜酸性胞质的上皮样细胞,呈成片密集排列,胞浆均匀,缺乏嗜酸性小体,核分裂象、坏死及血管内皮细胞增生较PXA更常见。免疫表型GFAP在eGBM中常散在表达或不表达,而在PXA中常呈强阳性,CD34表达在PXA更弥漫并呈强阳性,eGBM增殖指数也常较PXA更高。二者都可有BRAF V600E突变,有研究推测是共同的基因改变促进eGBM和PXA的发生进展[17],但二者之间的确切关系仍需进一步研究。(2)横纹肌样型脑膜瘤:少见,一般见于中年以上,发生于硬脑膜,镜下由横纹肌样细胞构成,圆胖形瘤细胞伴有核偏位,染色质淡染,核仁明显,胞浆可见嗜伊红包涵体。免疫组化显示EMA、PR阳性,GFAP、CD34、S-100部分阳性,Oligo-2阴性可以和PXA鉴别。(3)间变型星形细胞瘤:其中尤其是肥胖细胞型需要和PXA鉴别。一般发生在30~40岁人群,额叶和颞叶常见。镜下在网状背景中见肥胖星形细胞,胞浆丰富,嗜酸性,核偏位。免疫组化GFAP、IDH阳性,CD34阴性。必要时分子检测IDH突变而BRAF V600E无突变可以和PXA鉴别。(4)节细胞胶质瘤:好发于儿童和年轻人,70%以上位于颞叶,并且部分节细胞胶质瘤也存在BRAF V600E突变因此需要和PXA鉴别。节细胞胶质瘤镜下可见双核神经元及钙化,很多病例可出现Rosenthal纤维和嗜酸性颗粒小体,但是其细胞成分缺乏PXA多形性改变,以及特征性富含脂质的黄色瘤星形细胞。免疫组化结果肿瘤性神经元成分表达相应标记物,如MAP2、Syn等,但一般不表达CD34。
3.6 病因与发病机制 Kepes等[2]在1979年就提出,PXA起源于软脑膜下星形细胞,这一假设可以解释大多数病例的浅表位置。BRAF点突变发生在50%~78%的病例中,并且大多数都是V600E的突变,但其对PXA并不是特异性的,也可发生在其他的中枢神经系统肿瘤中[18]。还有研究证实CDKN2A/B缺失是PXA发生的关键特征,虽然与肿瘤分级或BRAF突变没有相关性,但对PXA的潜在遗传学至关重要[10]。
PXA虽然组织学表现为多形性,但恶性程度较低,预后相对较好。免疫表型CD34阳性和分子检测BRAF V600E突变是其特征但非特异性,需要与其他多种中枢神经系统肿瘤鉴别。大宗病例的积累总结有助于人们对PXA的更深入认识,避免对本病的误诊。

