毛柳苷在脑缺血再灌注后抑制神经元自噬及神经保护作用研究
温少红,刘宽,赵顺英,董雯,陈青芳,陈文涛,叶维贞,姜鸣钰,刘向荣
卒中是世界范围内导致人类死亡和残疾的主要疾病之一,其中缺血性卒中占卒中总数的87%,严重威胁着人类的健康,同时也大大增加了医疗保健的社会经济负担[1-2]。时间窗内溶栓是目前最有效的缺血性卒中再灌注治疗方法,但是溶栓治疗的时间窗窄且有出血转化的风险,限制了其应用[3],寻找新的缺血性卒中治疗靶点和药物是目前的研究热点。
红景天作为传统植物药,已被广泛用于预防和治疗疲劳、疼痛、阿尔茨海默病、抑郁和焦虑等常见疾病[4]。毛柳苷(salidroside,SAL)是从红景天中提取的一种苯丙素苷,是红景天的主要生物活性成分,具有抗炎、抗凋亡、抗缺氧、抗抑郁、抗氧化应激等多种药理作用[5-6]。自噬是一种自我吞噬的细胞分解代谢途径,通过降解和回收长寿命的蛋白质、受损的细胞器和错误折叠的蛋白质,维持细胞内稳态和正常的细胞功能[7-8]。近年来研究发现自噬在缺血性卒中中发挥着重要作用[9-12]。本研究旨在探索SAL是否通过调节神经元自噬在脑缺血再灌注损伤中发挥神经保护作用。
1 材料与方法
1.1 实验药物及配制 本研究药物SAL(Sigma-43866,美国),规格25 mg,其分子式为C14H20O7,分子量为300.30。将一支SAL溶于1.25 mL磷酸盐缓冲液(phosphate buffered saline,PBS),在无菌环境中采用0.22 μm一次性针头式滤器(Millipore,美国)过滤溶解的药液以除菌,该贮存液浓度为20 mg/mL(摩尔浓度66.6 mmol/L)。体内研究中,小鼠的给药剂量为10 mg/kg,小鼠体重22±0.5 g,每只小鼠实际给药量为0.22 mg,每只小鼠给药体积为150 μL(139 μL PBS+11 μL贮存液,临用前现配)。体外研究中,大鼠原代神经元的给药剂量为50 μmol/L,给药时每毫升细胞培养液中加SAL贮存液0.75 μL。大鼠原代神经元接种于10 cm细胞培养皿(Corning,美国),接种量为6×105个/皿,每皿细胞实际给药量为0.12 mg。
1.2 体内研究
1.2.1 实验动物 选取8~10周C57BL/6J雄性小鼠36只(购于北京华阜康生物科技股份有限公司)。本实验遵照北京市神经外科研究所实验动物福利伦理委员会要求进行(动物伦理批号:201902039),实验小鼠采用标准饲料和纯净水分笼饲养,饲养温度22~24 ℃,相对湿度50%~60%,12 h循环照明。
1.2.2 脑缺血再灌注模型制作与给药 小鼠称体重后,随机分为假手术组(12只)、溶剂组(12只)和SAL组(12只)。异氟烷(瑞沃德,中国)麻醉小鼠,分离右侧颈总及颈内外动脉,线栓法制作右侧大脑中动脉闭塞模型(middle cerebral artery occlusion,MCAO),线栓(Doccol-602156PK5Re,外径0.21 mm、硅胶包被长度5~6 mm,美国)自颈外动脉插入,插栓缺血1 h后,拔栓实现再灌注,即刻尾静脉注射150 μL SAL(SAL组)或同体积PBS(溶剂组)进行再灌注。假手术组只分离血管不插栓且不给药。术中通过激光多普勒血流仪(瑞沃德,中国)监测脑血流判断模型是否成功,体温维持仪维持小鼠术中肛温37±0.5 ℃。
1.2.3 神经功能缺损评分 缺血再灌注后24 h盲法对小鼠进行神经功能缺损评分[13]。运动功能缺损评分:①提起小鼠尾巴,正常为0分,前肢或后肢弯曲为1分,头部在30 s内向垂直轴方向移动>10°为1分,最高3分;②将小鼠放在地板上,正常行走为0分,不能直线行走为1分,身体向患侧倾斜为2分,身体倒向患侧为3分。感觉功能缺损评分:①采用尖锐的针尖触摸小鼠前爪掌区测评其触觉反应,正常为0分,反应迟缓为1分,无反应为2分;②用棉签压住小鼠一侧颈部来评估本体感受反应,正常为0分,反应迟缓为1分,无反应为2分。神经功能缺损评分总分为10分,分值越高,小鼠的神经功能缺损越严重。
1.2.4 脑梗死率测定 缺血再灌注后24 h且神经功能缺损评分结束后,处死小鼠并取每组12只小鼠全脑进行冰冻切片。从前至后每隔1 mm选取20 μm厚的一片切片,使用神经元特异核蛋白(neuronal nuclei,NeuN)抗体(Millipore-ABN78,美国,1∶600)染色,共标记7个层面的神经元。通过Vectra Polaris全自动成像系统(Perkin-Elmer,美国)拍摄荧光图片,并采用ImageJ软件对荧光图片进行数据分析。患侧每层神经元损伤体积=患侧神经元损伤面积×层厚,患侧神经元总损伤体积为每层神经元损伤体积之和;健侧每层神经元体积=健侧神经元面积×层厚,健侧神经元总体积为健侧每层神经元体积之和;小鼠脑梗死率=(患侧神经元总损伤体积/健侧神经元总体积)×100%(左侧大脑为健侧,右侧大脑为患侧)。
1.2.5 免疫组织荧光染色 选取制备的小鼠全脑冰冻切片进行免疫组织荧光染色,切片依次进行破膜、封闭、一抗孵育、二抗孵育、4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)封片。①选取溶剂组小鼠全脑冰冻切片,将自噬标记物微管相关蛋白1轻链3B(microtubule associated protein 1 light chain 3 beta,LC3B)(CST-83506,美国,1∶500)分别与NeuN(Millipore-ABN78,美国,1∶600)、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)(abcamab68428,美国,1∶500)免疫荧光共染并标记梗死周边区神经元、星形胶质细胞。使用激光共聚焦显微镜(Carl Zeiss AG,德国)观察LC3B与神经元、星形胶质细胞共定位情况,以明确缺血再灌注后24 h产生自噬活动的主要部位。②每组选取3只小鼠全脑冰冻切片,将其他自噬标记物Beclin-1(CST-3495,美国,1∶200)、自噬相关蛋白3(autophagy related protein 3,Atg3)(CST-3415,美国,1∶200)分别与NeuN(Millipore-MAB377,美国,1∶600)免疫荧光共染,使用激光共聚焦显微镜(Carl Zeiss AG,德国)观察,使用ImageJ软件分别对Beclin-1+/NeuN+细胞、Atg3+/NeuN+细胞计数。
1.3 体外研究
1.3.1 大鼠原代神经元提取及培养 大鼠原代神经元取自胎龄18 d SD胎鼠大脑皮层。将脑组织表面的脑膜和血管剔除后,碾碎脑组织并用胰酶消化。随后将神经元以6×105个/皿的密度接种在装有神经元基础培养基(Gibco,美国)的直径10 cm细胞培养皿中,并添加2%无血清添加剂(B-27 supplement,B27)、2 mmol/L L-谷氨酰胺、100 U/mL青霉素/链霉素双抗(Gibco,美国),培养基及以上添加物终体积为8毫升/皿。每3天进行一次半量换液,连续培养至第10天,用于后续研究。
1.3.2 大鼠原代神经元氧糖剥夺 神经元培养至第10天,进行氧糖剥夺(oxygen glucose deprivation,OGD)。细胞分为6组:①对照(control,CON)组,②氧糖剥夺1 h后复氧1 h(OGD 1 h)组,③氧糖剥夺1 h后复氧4 h(OGD 4 h)组,④SAL组,⑤氧糖剥夺1 h后复氧1 h/全程SAL治疗(OGD+SAL 1 h)组,⑥氧糖剥夺1 h后复氧4 h/全程SAL治疗(OGD+SAL 4 h)组。
OGD具体流程如下:超净工作台(ESCO,新加坡)内,无菌PBS清洗神经元2次以去除培养基中的葡萄糖,随后更换为无添加葡萄糖的达尔伯克氏改良伊格尔氏培养基(Dulbecco’s modified Eagle medium,DMEM)(Gibco,美国);将神经元放置于缺氧小室(Stemcell,美国),95%N2/5%CO2通入小室内以排尽氧气,平衡5 min后密封缺氧小室,将小室置于细胞培养箱内,1 h后取出神经元复氧,更换为原神经元基础培养基1 h或4 h后收集细胞。CON组和SAL组不进行OGD,其中SAL组在培养皿中加入50 μmmol/L SAL(即6微升/皿SAL贮存液)处理,加药4 h后收集细胞,CON组也在4 h后收集细胞;其余组进行OGD,OGD+SAL 1 h组和OGD+SAL 4 h组分别在OGD时、复氧后加入与SAL组同等剂量SAL处理,OGD 1 h组和OGD+SAL 1 h组复氧1 h后收集细胞,OGD 4 h组和OGD+SAL 4 h组复氧4 h后收集细胞。体外实验流程见图1。

图1 大鼠原代神经元氧糖剥夺流程图
1.3.3 免疫印迹试验 裂解“1.3.2 大鼠原代神经元氧糖剥夺”中收集的细胞,12 000转/分离心20 min,取上清液经BCA蛋白检测试剂盒(Pierce,美国)定量后依次进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳、蛋白转膜、膜的封闭、一抗孵育(LC3B、Beclin-1、Atg3、Atg5、Atg7)、二抗孵育、发光液显影,通过G:BOX化学发光成像系统(Syngene,英国)检测蛋白条带,使用ImageJ软件分析图像并计算目标蛋白相对表达量。免疫印迹所用一抗分别为LC3B(CST-3868,美国,1∶1000)、Beclin-1(CST-3495,美国,1∶1000)、Atg3(CST-3415,美国,1∶1000)、Atg5(CST-12994,美国,1∶1000)、Atg7(CST-8558,美国,1∶1000),酶标二抗抗兔IgG(CST-7074,美国,1∶2000)。同时在同一膜上测定肌动蛋白(Santa Cruz-1616,美国,1∶500)的表达,将其作为内参。细胞实验均重复3次。
1.3.4 大鼠原代神经元免疫荧光染色 CON组、OGD 4 h组细胞固定后LC3B(CST-83506,美国,1∶500)与NeuN(Millipore-ABN78,美国,1∶600)免疫荧光共染,采用EVOSTM FL Auto 2成像系统(Life technology,美国)观察神经元自噬水平,使用ImageJ软件对LC3B+/NeuN+细胞计数。
1.4 统计方法 采用GraphPad Prism 8.0.2软件进行统计分析,计量资料符合正态分布,以表示;多组比较采用单因素方差分析,在整体差异有统计学意义的情况下进行Tukey检验进行两两比较;两组比较采用独立样本t检验;P<0.05为差异具有统计学意义。
2 结果
2.1 体内研究结果
2.1.1 SAL对缺血再灌注小鼠的神经保护作用 缺血再灌注后24 h,假手术组、溶剂组、SAL组小鼠间神经功能缺损评分的整体差异有统计学意义。两两比较显示,溶剂组和SAL组神经功能缺损评分均高于假手术组(均P<0.0001);SAL组神经功能缺损评分低于溶剂组(P=0.0332)。缺血再灌注后24 h,3组间脑梗死率比较差异有统计学意义。两两比较显示,溶剂组和SAL组脑梗死率均高于假手术组(均P<0.0001);SAL组脑梗死率低于溶剂组(P=0.0038)(表1,图2)。
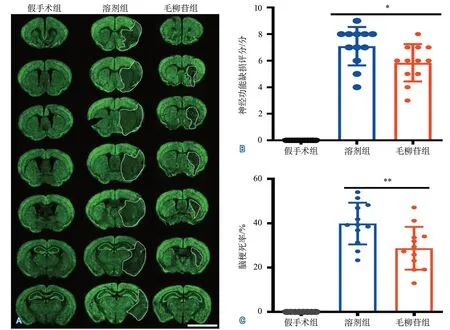
图2 毛柳苷对缺血再灌注小鼠的神经保护作用
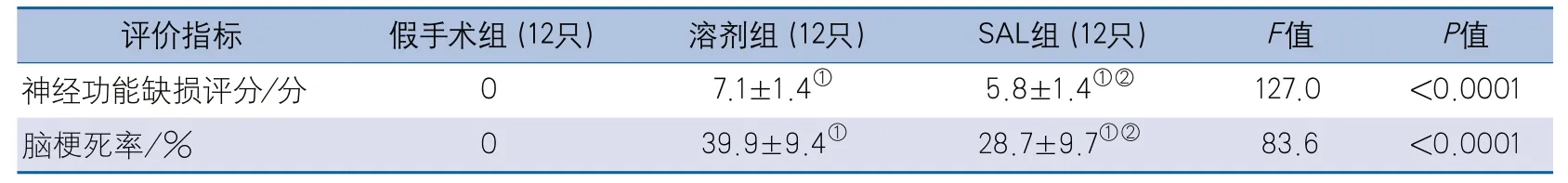
表1 缺血再灌注后24 h小鼠神经功能缺损评分及脑梗死率结果
2.1.2 LC3B与缺血再灌注小鼠梗死周边区神经元、星形胶质细胞共定位情况 缺血再灌注后24 h,溶剂组小鼠LC3B与神经元有共定位(图3A~B),与星形胶质细胞无共定位(图3C~D)。即缺血再灌注后24 h,小鼠梗死周边区神经元表达自噬标记物LC3B,然而梗死周边区星形胶质细胞此时并未表达LC3B。
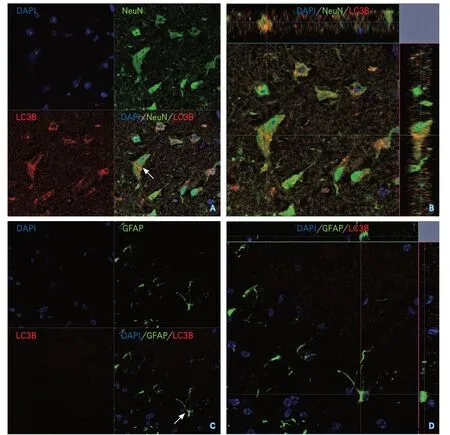
图3 LC3B与缺血再灌注小鼠梗死周边区神经元、星形胶质细胞共定位情况
2.1.3 Beclin-1、Atg3与缺血再灌注小鼠梗死周边区神经元共染结果 缺血再灌注后24 h,假手术组、溶剂组和SAL组3组间单位面积(1 mm2)内Beclin-1+/NeuN+、Atg3+/NeuN+细胞个数比较差异均有统计学意义。两两比较显示,与假手术组相比,溶剂组Beclin-1+/NeuN+、溶剂组Atg3+/NeuN+、SAL组Atg3+/NeuN+单位面积内细胞个数均增多(P=0.0010,P<0.0001,P=0.0005);与溶剂组相比,SAL组Beclin-1+/NeuN+、Atg3+/NeuN+单位面积内细胞个数减少(P=0.0121,P=0.0013)(表2)。图4为Beclin-1、Atg3与NeuN共染免疫荧光代表图。

图4 自噬相关蛋白Beclin-1、Atg3与脑缺血再灌注小鼠梗死周边区神经元共染结果

表2 缺血再灌注后24 h小鼠梗死周边区Beclin-1+/NeuN+、Atg3+/NeuN+细胞计数结果[单位:个/平方毫米]
2.2 体外研究结果
2.2.1 SAL对氧糖剥夺大鼠原代神经元自噬相关蛋白相对表达量的影响 6组间比较,LC3B、Beclin-1、Atg3的相对表达量整体差异有统计学意义,Atg5和Atg7的相对表达量整体差异无统计学意义。两两比较显示,与CON组相比,OGD 1 h组、OGD 4 h组LC3B相对表达量升高(P=0.0174、P<0.0001);与OGD 1 h组相比,OGD 4 h组LC3B相对表达量升高(P=0.0038),SAL组LC3B相对表达量降低(P=0.0476);与OGD 4 h组相比,SAL、OGD+SAL 1 h组LC3B相对表达量降低(P<0.0001,P=0.0002);OGD+SAL 4 h组与CON组、OGD 1 h组、OGD 4 h组、SAL组、OGD+SAL 1 h组相比,LC3B相对表达量降低(P=0.0002,P<0.0001,P<0.0001,P<0.0001,P<0.0001)。OGD+SAL 1 h组Be cl i n-1相对表达量低于OGD 4 h组(P=0.0458);OGD+SAL 4 h组Beclin-1相对表达量低于CON组、OGD 1 h组、OGD 4 h组、SAL组、OGD+SAL 1 h组(P=0.0005,P<0.0001,P<0.0001,P=0.0002,P=0.0030)。OGD+SAL 4 h组Atg3相对表达量低于OGD 1 h组和OGD 4 h组(P=0.0119,P=0.0211)(表3,图5)。
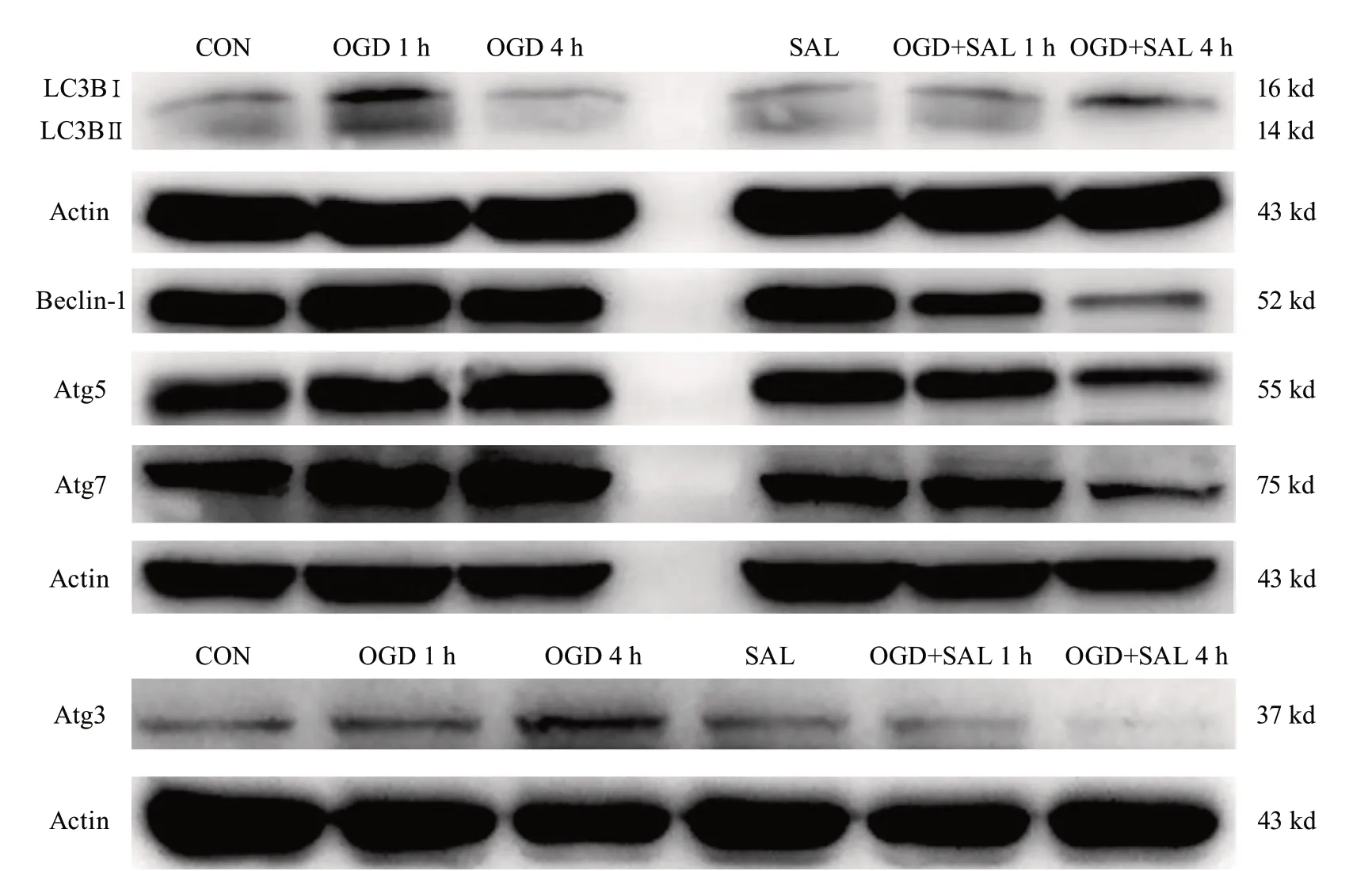
图5 自噬相关蛋白LC3B、Beclin-1、Atg3、Atg5、Atg7免疫印迹代表性条带
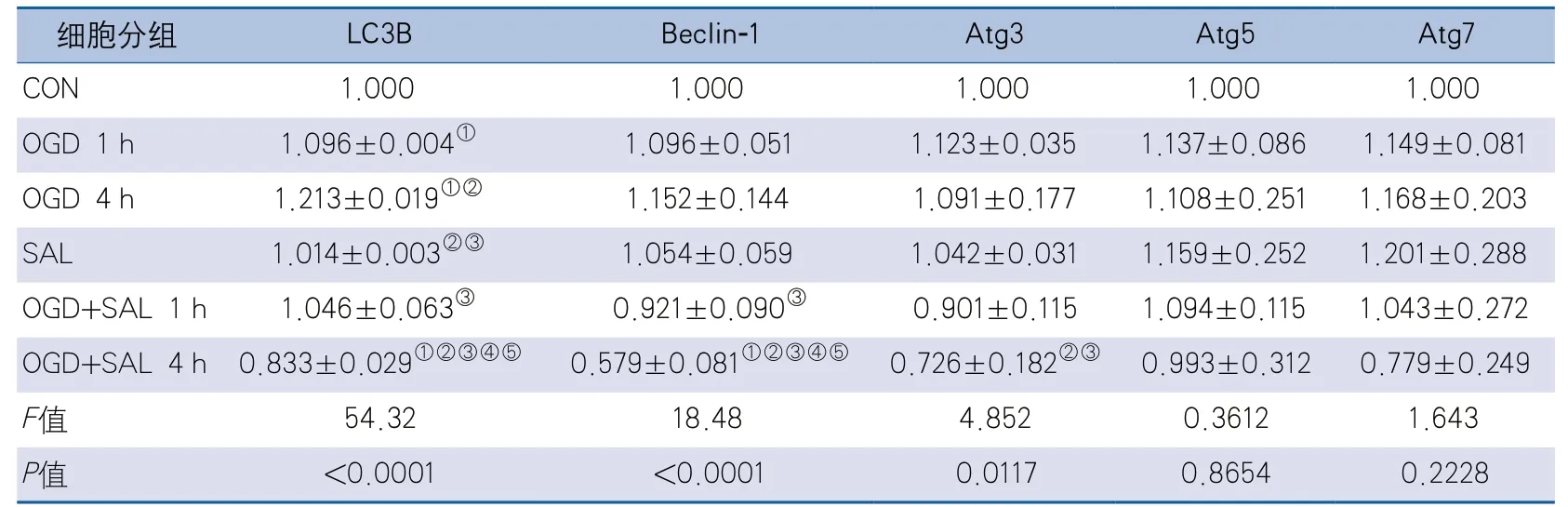
表3 SAL对氧糖剥夺大鼠原代神经元自噬相关蛋白相对表达量的影响
2.2.2 大鼠原代神经元自噬标记物LC3B免疫荧光染色结果 CON组神经元在单位面积(1 mm2)的LC3B+/NeuN+细胞个数为51.9±18.7个,OGD 4 h组为584.2±34.5个,2组之间差异有统计学意义(P=0.0002)(图6)。

图6 大鼠原代神经元自噬标记物LC3B免疫荧光染色结果
3 讨论
自噬作为维持真核生物中与受损细胞器形成和降解相关的细胞蛋白平衡的重要机制,越来越多的证据表明,缺血性卒中激活了各种类型的大脑细胞的自噬,如神经元、胶质细胞和大脑微血管细胞等[14],这可能为缺血性卒中的临床治疗提供了潜在的靶点。然而,自噬在缺血性脑损伤中发挥保护还是损伤作用仍存在争议。一般认为在神经元系统中,适度的自噬具有神经保护作用,因为自噬有助于清除与神经变性相关的聚集蛋白;不充分或有缺陷的自噬则可能导致神经元死亡;而过度的自噬通常由强烈的压力触发,也可促进神经元死亡[15-16]。自噬的程度和其被诱导的时间点可能才是真正决定自噬对缺血再灌注后神经元归转作用的关键因素[17]。
目前已证实哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)、Beclin-1/B淋巴细胞瘤-2(Beclin-1/B-cell lymphoma-2,Beclin-1/Bcl-2)等多种信号通路在自噬活动中发挥了调节作用[18-20]。其中自噬相关蛋白Atg3、Atg5、Atg7在自噬中发挥核心调控作用:Atg3可以作为E2泛素样偶联酶,促进吞噬体伸长[21];Atg5是自噬小泡形成不可或缺的蛋白,敲除ATG5基因可导致自噬下调或完全抑制[22];Atg7是一种重要的自噬效应酶,与其他Atg蛋白协同调节免疫、细胞死亡和蛋白分泌,可以独立调控细胞周期和凋亡[23]。LC3即微管相关蛋白1A/1B-轻链3(microtubule-associated proteins 1A/1B light chain 3,MAP1LC3,简写LC3),它包括LC3A、LC3B、LC3C等3种亚型,其中LC3B与自噬小体的发育成熟有关,常用于监测自噬活性[24]。自噬发生时,胞浆型LC3BⅡ会酶解掉一小段多肽,转变为自噬体膜型LC3BⅡ,LC3BⅡ含量增加代表自噬被激活,LC3BⅡ含量降低则代表自噬被抑制,通常采用LC3BⅡ/LC3BⅠ比值评估自噬水平的高低。此外,Beclin-1可以干预自噬通路从自噬小体形成到自噬小体/核内体成熟的每一个主要步骤,亦常作为自噬形成的标志物之一[25]。
在本次体内外研究中SAL的剂量(小鼠10 mg/kg,大鼠原代神经元50 μmol/L)参考了本课题前期研究结果[26]。体内实验结果显示,SAL具有明确的脑缺血再灌注损伤保护作用,可以显著改善脑缺血再灌注小鼠感觉运动神经功能,降低脑梗死率。对脑缺血小鼠进行LC3B、NeuN的免疫荧光染色结果亦证实了脑缺血急性期梗死周边区神经元发生了自噬,而SAL治疗可以降低神经元自噬水平(SAL组单位面积内Beclin-1+/NeuN+、Atg3+/NeuN+细胞数量下降)。在大鼠原代神经元的OGD研究中,观察到OGD后神经元发生了明显的自噬(OGD 1 h、OGD 4 h后LC3B表达量显著高于CON组),给予OGD神经元SAL处理后,自噬相关蛋白Beclin-1、Atg3、LC3B的表达水平均显著下降,而Atg5、Atg7在此时的表达水平虽然未出现统计学差异,但存在下调趋势。以上结果提示SAL治疗可能通过抑制神经元自噬水平发挥神经保护作用,SAL可以作为缺血性卒中临床治疗的潜在药物,具有十分广阔的应用前景。然而SAL干预神经元自噬水平的具体分子机制仍有待进一步研究,这也是本研究的局限性之一。
【点睛】毛柳苷通过下调自噬相关蛋白表达,抑制神经元自噬,在脑缺血再灌注损伤中发挥神经保护作用。

