茶多酚处理方式对干贝脂质氧化稳定性和货架期的影响
樊凤娇,谢宏凯,罗谢琪,方 勇
(南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏 南京 210023)
我国扇贝资源十分丰富,年总产量超过170万 t,是世界第一生产大国。扇贝水分含量高、内源酶活性强、易受微生物作用,极易腐败变质,而干制可以有效延长扇贝的货架期,同时赋予其独特的色泽、质地、口感和风味。因此,干制品是扇贝重要的商品形式。干贝是扇贝闭壳肌的干制加工品,不仅色泽诱人、口感鲜香,而且富含以二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)为代表的n-3多不饱和脂肪酸(n-3 polyunsaturated fatty acids,n-3 PUFAs),是我国传统“海八珍”之一,深受消费者青睐。然而,n-3 PUFAs在干贝贮藏中极易氧化,导致干贝营养价值和保健功能降低,感官品质劣化,安全风险增加。
为控制水产品在加工及贮藏中的脂质氧化,添加抗氧化剂是目前最直接有效的方法。抗氧化剂能够准确抵达脂质氧化发生的位点,是其发挥高效抗氧化作用的前提。因此,抗氧化剂在食品基质中的物理空间分布对脂质氧化的影响已成为当前的研究热点。茶多酚是一类源于茶叶的天然活性物质,具有优异的抗氧化能力,是我国水产品及其制品中准许添加使用的抗氧化剂。在本课题组前期研究中,对比了将茶多酚仅添加至闭壳肌表面与茶多酚同时添加至闭壳肌表面及组织内部对其干制过程中脂质氧化的影响,结果发现茶多酚同时添加至闭壳肌表面及组织内部可以更有效地抑制脂质氧化。然而,上述不同的茶多酚处理方式对干贝贮藏过程中的脂质氧化稳定性和货架期的影响尚不清楚。
食品的货架期是指其品质处于消费者可接受程度的贮藏时间段。随着人们生活水平的提高和食品安全意识的提升,消费者越来越关注食品品质,而货架期是消费者了解食品品质的重要依据。食品品质的变化通常与微生物作用和化学反应有关,因此在货架期建模过程中,通常选择与化学或微生物相关的代表性指标,如色泽、气味、滋味等消费者可以判断的感官指标,或是与感官指标同步变化的其他指标,如微生物、VC等,也可以是国家标准中明确规定的理化指标,如挥发性盐基氮、酸值和过氧化值等。常见的货架期预测方法有基于化学动力学、微生物生长动力学和温度的方法,以及BP神经网络方法和威布尔危险值分析法。对于干贝等低水分食品,微生物作用有限,化学反应是导致其品质劣变的根本原因,其中最主要的化学反应就是脂质氧化。因此,本实验选用基于化学动力学的方法,分三步完成建模:1)确定加速贮藏温度梯度,采集贮藏中监测指标变化数据,进行零级或一级动力学模型拟合处理,描述监测指标变化规律;2)建立Arrhenius方程,依据其中参数建立变温条件下货架期预测模型;3)依据初始和货架期终点监测指标的值,预测食品货架期。
因此,本研究将基于前期研究基础,将经过不同茶多酚处理方式制备的干贝进行加速贮藏,通过测定干贝的耗氧量、初级氧化产物生成、次级氧化产物生成、自由基的强度和氧化底物损失规律探究不同茶多酚处理方式对干贝脂质氧化稳定性的影响,同时基于货架期预测模型比较不同茶多酚处理方式对干贝货架期的影响,以期为动物性海洋干制品的抗氧化提供理论支撑和方法指导。
1 材料与方法
1.1 材料与试剂
鲜活栉孔扇贝购买于当地海鲜市场。
十一碳酸甘油三酯、1,1,3,3-四甲氧基丙烷、14%三氟化硼-甲醇溶液、37 种脂肪酸甲酯(fatty acid methyl esters,FAMEs)混标 上海阿拉丁生化科技股份有限公司;硫代巴比妥酸、硫代硫酸钠、三氯乙酸、氯仿、甲醇 天津科密欧化学试剂有限公司;氯仿、正己烷(均为色谱级) 美国Spectrum公司;茶多酚 江西省富之源生物科技有限公司。
1.2 仪器与设备
A200电子顺磁共振波谱仪 德国Bruker公司;7890B气相色谱仪 美国Agilent公司;CF16RXII高速冷冻离心机 日本Hitachi公司;DGH-9030A电热恒温干燥箱 上海一恒科学仪器有限公司;LC-1.0真空冷冻干燥机 沈阳航天新阳速冻厂;OXITEST油脂氧化稳定性分析仪 意大利VELP公司。
1.3 方法
1.3.1 干贝的制备
鲜活栉孔扇贝剥壳,去除内脏和裙边,取出完整的闭壳肌。将6 kg闭壳肌在12 L的3%盐水中煮制3 min,取出沥干,随机分为3 组。空白组干贝:闭壳肌不添加茶多酚,直接在-50 ℃冷冻干燥制备干贝;传统添加组干贝:闭壳肌添加0.3%的茶多酚,搅拌均匀,立即在-50 ℃冷冻干燥制备干贝,此时茶多酚仅分布在干贝表面;改进添加组干贝:闭壳肌添加0.3%的茶多酚,搅拌均匀,4 ℃静置3 h,茶多酚将扩散至闭壳肌组织内部,随后在-50 ℃冷冻干燥制备干贝,此时茶多酚同时分布于干贝表面和组织内部。
1.3.2 干贝的加速贮藏
取空白组、传统添加组和改进添加组干贝各200 g,分别置于65 ℃烘箱中,避光贮藏16 d,间隔4 d取样1 次,取样后立即保藏在-80 ℃冰箱中,待所有样品采集结束后分别粉碎,继续保藏在-80 ℃冰箱中用于测定干贝的脂质氧化稳定性;取空白组、传统添加组和改进添加组干贝各100 g,分别置于45 ℃和55 ℃烘箱中,避光贮藏16 d,间隔4 d取样1 次,取样后立即保藏在-80 ℃冰箱中,待所有样品采集结束后分别粉碎,继续保藏在-0 ℃冰箱中用于预测干贝的货架期。
1.3.3 干贝脂质的提取
依据Folch等的方法提取干贝脂质,将30 g干贝粉与30 mL去离子水混合,再加入100 mL氯仿-甲醇(2∶1,V/V)混合溶剂,充分混合后加入37.5 mL氯仿,搅拌提取1 h,7 800×g离心10 min,收集有机相层,减压浓缩得总脂质,将其贮存于-80 ℃冰箱中备用。
1.3.4 干贝耗氧量的测定
依据Caruso等的方法通过OXITEST测定干贝耗氧量,仪器参数如下:样品量3 g;初始氧气压力6 bar;温度90 ℃。通过仪器内置的OXIsoft软件自动计算氧化诱导时间。
1.3.5 干贝过氧化值的测定
依据GB 5009.227—2016《食品中过氧化值的测定》的滴定法测定干贝的过氧化值(peroxide value,PV)。取0.2 g脂质样品于锥形瓶中,用30 mL三氯甲烷-冰乙酸混合液溶解,加入1 mL饱和碘化钾,轻摇0.5 min后暗处放置3 min。随后加入100 mL水,摇匀后加入1 mL淀粉指示剂,用0.02 mol/L的硫代硫酸钠溶液滴定直至蓝色消失为终点。同时进行空白实验。PV结果以g/100 g表示。

式中:V为试样消耗硫代硫酸钠溶液体积/mL;V为空白实验消耗硫代硫酸钠溶液体积/mL;C为硫代硫酸钠标准溶液浓度/(mol/L);m为脂质样品的质量/g;100为换算系数;0.126 9为与1.00 mL硫代硫酸钠标准滴定溶液(1 mol/L)相当碘的质量。
1.3.6 干贝硫代巴比妥酸(thiobarbituric acid reactive substances,TBARS)值的测定
依据Khan等的方法测定干贝的TBARS,将500 mg干贝粉、2 mL去离子水和2 mL三氯乙酸溶液(10 g/100 mL)混合,涡旋振荡2 min,8 000×g离心5 min。取1 mL上清液与1 mL硫代巴比妥酸溶液(0.01 mol/L)混合,沸水浴加热25 min,取混合液在波长532 nm处测定吸光度。TBARS值依据以1,1,3,3-四乙氧基丙烷制作的标准曲线计算得出。标准曲线的制作方法如下:称取0.315 g的1,1,3,3-四乙氧基丙烷于1 000 mL容量瓶中,用去离子水定容,配制质量浓度为100 μg/mL的丙二醛储备液。吸取1 mL的丙二醛储备液于100 mL容量瓶中,用去离子水定容,配制质量浓度为1 μg/mL的丙二醛标准使用液。分别吸取0.10、0.20、0.50、1.0、2.5、5.0 mL的丙二醛标准使用液于10 mL容量瓶中,用去离子水定容,配制0.01、0.02、0.05、0.1、0.25、0.5 μg/mL的系列标准溶液,按照以上步骤与样液同时进行衍生化处理并测定吸光度。
1.3.7 干贝自由基强度的测定
依据Nissen等的方法测定干贝的自由基强度,仪器参数如下:样品量100 mg;微波功率5.32 mW;中心磁场强度3 453.00 G;扫描宽度100.00 G;调制频率100.00 kHz;调制幅度1.00 G;转换时间480 ms;时间常数5 242.88 ms。谱图中第1个峰的高度计为干贝的自由基强度。
1.3.8 干贝脂肪酸的测定
依据Metcalfe等的方法制备FAMEs,取500 μL脂质的氯仿溶液(10 mg/mL)和200 μL十一碳酸甘油三酯的氯仿溶液(1 mg/mL)于10 mL圆底烧瓶中,氮气浓缩除去氯仿溶剂,继续加入2 mL氢氧化钠-甲醇溶液(0.5 mol/L),80 ℃回流5 min,再加入2 mL三氟化硼-甲醇溶液(14%),继续回流2 min。冷却后加入1.5 mL色谱级正己烷萃取FAMEs,收集正己烷层,无水硫酸钠除水,0.22 μm有机滤膜过滤,滤液用于气相色谱检测。
依据GB 5009.168—2016《食品中脂肪酸的测定》测定FAMEs。色谱条件:SP 2560毛细色谱柱(100 m×0.25 mm,0.2 μm);进样体积1 μL;分流比5∶1;进样口温度270 ℃;载气N;载气流速1 mL/min。升温程序如下:初始温度100 ℃,保持13 min;以10 ℃/min速率升温至180 ℃,保持6 min;以1 ℃/min速率升温至215 ℃;以5 ℃/min速率升温至230 ℃,保持12 min。依据37 种FAMEs保留时间定性分析样品中的脂肪酸(fatty acids,FAs),依据式(2)计算EPA和DHA含量(以干基计):

式中:RF为响应因子;IS为内标/mg;M为脂质质量/mg;1.006 7为十一碳酸甘油三酯转化成十一碳酸甲酯的转换系数;c为脂质含量/(mg/g);F为EPA或DHA甲酯转换为EPA或DHA的转换系数,分别为0.955 7和0.959 0。
1.3.9 干贝货架期的预测
将干贝加速贮藏过程中PV的变化数据进行一级动力学方程(3)拟合,获得其动力学参数,建立Arrhenius方程(4),基于获得的参数,进一步建立货架期预测模型(5),用于预测干贝的货架期。

式中:PV为贮藏时间t时干贝的PV;k为应速率常数;PV为依据拟合后一级动力学方程计算的贮藏前干贝的初始PV;E为活化能/(J/mol);R为摩尔气体常数,为8.314 4 J/(mol·K);T为绝对温度/K;k为指前因子;PV为干贝贮藏前的初始PV值;PV为GB 10136—2015《动物性水产制品》规定干贝的限量PV,为0.6 g/100 g脂质;SL为货架期/d。
1.4 数据处理与统计
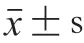
2 结果与分析
2.1 干贝加速贮藏过程中氧吸收的变化
顶空耗氧法是测定氧吸收的方法之一,该方法将待测样品置于高压氧气和高温条件下,通过实时监测氧气压力的变化计算氧气的消耗速率,进而推导获得氧化诱导时间。氧化诱导时间越长表明脂质氧化稳定性越高。如图1所示,加速贮藏前,空白组、传统添加组和改进添加组干贝的氧化诱导时间分别为(90.03±13.09)、(200.55±12.12)h和(241.03±8.03)h,传统添加组和改进添加组干贝的氧化诱导时间分别是空白组干贝的2.23 倍和2.68 倍。可见,添加茶多酚可以显著延长干贝的氧化诱导时间,增强干贝的氧化稳定性。随着加速贮藏时间的延长,3 组干贝的氧化诱导时间逐渐缩短,说明干贝的氧化稳定性逐渐降低。在加速贮藏第8天,已无法测出空白组干贝的氧化诱导时间。在加速贮藏第16天,改进添加组干贝的氧化诱导时间为(50.05±6.10)h,是传统添加组干贝氧化诱导时间((30.09±3.98)h)的1.66 倍。上述结果显示,通过改进方式添加茶多酚比传统方式更显著地延长了干贝的氧化诱导时间,表明茶多酚同时处于干贝表面和组织内部比茶多酚仅处于干贝表面能更有效地提升干贝的氧化稳定性。
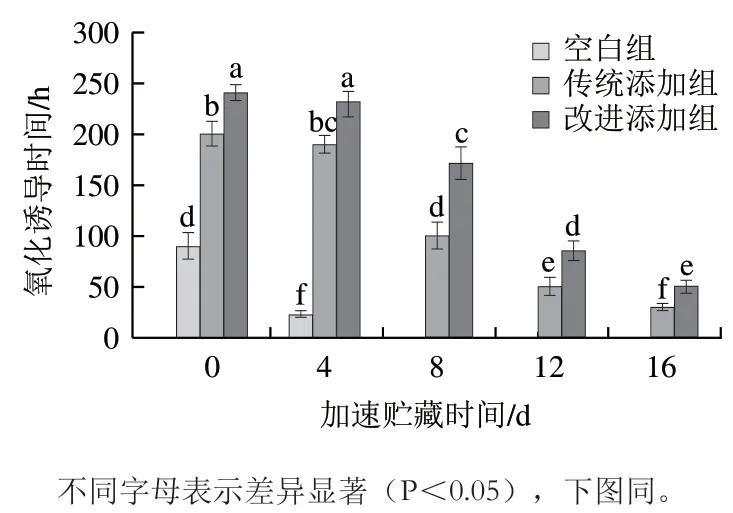
图1 干贝加速贮藏过程中氧化诱导时间的变化Fig. 1 Changes in induction period of oxidation of dried scallop adductor muscle during accelerated storage
2.2 干贝加速贮藏过程中初级氧化产物变化

图2 干贝加速贮藏过程中PV的变化Fig. 2 Changes in PV of dried scallop adductor muscle during accelerated storage
PV是测定脂质初级氧化产物的常用指标,可以反映脂质中总氢过氧化物的量。如图2所示,加速贮藏前,空白组、传统添加组和改进添加组干贝的PV无显著差异,表明闭壳肌的前处理及干贝的制备过程未发生显著氧化。随着加速贮藏时间的延长,3 组干贝的PV显著升高,表明干贝加速贮藏过程中不饱和脂质发生氧化,持续生成大量氢过氧化物,且其生成速率高于其降解速率。在整个65 ℃加速贮藏过程中,传统添加组和改进添加组干贝的PV显著低于空白组,说明茶多酚显著抑制了氢过氧化物的形成,而改进添加组干贝具有最低的PV,表明改进添加方式具有最好的抗氧化效果。这是由于在抗氧化剂的改进添加过程中,茶多酚的扩散过程使其不仅分布于干贝的表面还分布于干贝组织内部,进而同时抑制干贝表面和组织内部脂质氧化,促使其发挥更全面的抗氧化作用,更有效地抑制了氢过氧化物的生成。
2.3 干贝加速贮藏过程中次级氧化产物的变化
脂质氧化过程中生成的初级氧化产物氢过氧化物不稳定,容易降解为醛、酮、醇、烃、挥发性有机酸和环氧化合物等各种次级氧化物产物。TBARS是检测脂质次级氧化产物的常用指标,可以反映食品中丙二醛的量。如图3所示,加速贮藏前,空白组、传统添加组和改进添加组干贝具有相似的TBARS值,表明闭壳肌的前处理及干贝的制备过程未发生显著性氧化。随着加速贮藏时间的延长,3 组干贝TBARS值逐渐升高,加速贮藏16 d后,3 组干贝TBARS值分别比初始值增长了16.50、6.59 倍和3.51 倍,表明干贝加速贮藏过程中氢过氧化物不断降解生成丙二醛。在整个65 ℃加速贮藏过程中,传统添加组和改进添加组干贝的TBARS值显著低于空白组的TBARS值,说明茶多酚显著抑制了丙二醛的生成,而改进添加组干贝具有最低的TBARS值,说明茶多酚同时处于干贝组织表面和内部比其仅分布在干贝表面能更显著地抑制丙二醛的产生。
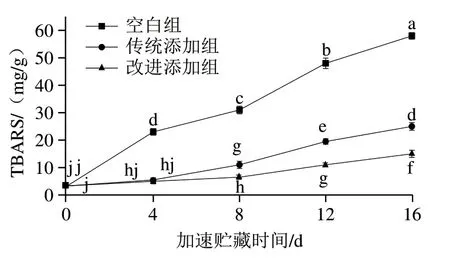
图3 干贝加速贮藏过程中TBARS值的变化Fig. 3 Changes in TBARS value of dried scallop adductor muscle during accelerated storage
2.4 干贝加速贮藏过程中自由基强度的变化
脂质氧化分为自动氧化、酶促氧化和光敏氧化3 种类型。在预处理过程中,闭壳肌已进行煮制处理,脂氧合酶已被钝化。经过干制后,干贝的水分含量较低,仅约为5%,且加速贮藏温度较高,进一步抑制了残存脂氧合酶的活性,因此酶促氧化很难发生。此外,整个加速贮藏过程在避光条件下进行,难以发生光敏氧化。因此,自动氧化是本实验中干贝的主要氧化类型。自动氧化是不饱和脂质和氧气通过自由基的链式反应自发进行的化学过程,包含链引发、链传递和链终止3 个阶段。因此,自由基水平是脂质氧化程度的重要评价指标。如图4所示,加速贮藏前,空白组、传统添加组和改进添加组干贝的自由基强度值无显著差异,分别为0.81±0.11、0.79±0.15和0.82±0.09,说明闭壳肌的前处理及干贝的制备过程未发生显著性自由基增殖过程。随着加速贮藏时间的延长,3 组干贝的自由基强度值逐渐升高。在加速贮藏16 d后,3 组干贝的自由基强度值分别增加为9.03±0.25、5.50±0.31和4.32±0.18,分别比初始值增长了10.15、5.96 倍和4.27 倍,表明干贝发生自动氧化,生成了大量的脂质自由基。在加速贮藏16 d后,空白组干贝的自由基强度值分别是传统添加组和改进添加组干贝的1.64 倍和2.09 倍,说明茶多酚阻断了自由基的链式反应,抑制了自由基的生成。在此过程中,茶多酚含有的酚羟基提供氢原子,猝灭自由基,酚羟基自身转变为醌。值得注意的是,改进添加组干贝的自由基强度值比传统添加组干贝的自由基强度值更低。传统添加方式使得茶多酚分布在干贝表面,只能抑制干贝表面组织氧化产生自由基,而改进添加方式中闭壳肌添加茶多酚并静置后,部分茶多酚能够扩散至组织内部,相比于茶多酚仅分布在干贝表面,此方式还能有效清除干贝组织内部的脂质自由基,由此导致2 种处理方式自由基含量的差异。
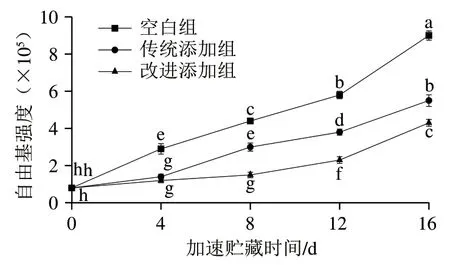
图4 干贝加速贮藏过程中自由基强度的变化Fig. 4 Changes in free radical intensity of dried scallop adductor muscle during accelerated storage
2.5 干贝加速贮藏过程中氧化底物含量的变化
在脂质氧化过程中,氧气并入不饱和脂质分子的双键形成氢过氧化物,氢过氧化物不稳定,最终降解成为各种次级氧化产物,导致不饱和脂质含量的损失。因此,测定氧化底物的损失规律是评估脂质氧化最直接的方法。如图5所示,加速贮藏前,空白组、传统添加组和改进添加组干贝具有相似的EPA+DHA含量,分别为(9.05±0.22)、(9.02±0.11)、(9.03±0.15) mg/g,表明闭壳肌的前处理及干贝的制备过程未发生显著性氧化底物损失。随着加速贮藏时间的延长,3 组干贝的EPA+DHA含量逐渐减少。在加速贮藏16 d后,3 组干贝的EPA+DHA含量分别为(6.40±0.29)、(7.35±0.21)mg/g和(8.31±0.20)mg/g,分别损失了29.28%、18.51%和7.97%,说明EPA和DHA发生氧化和降解,转变为氢过氧化物和醛、酮、醌等次级氧化产物,造成干贝中n-3 PUFAs类营养组分的损失,干贝营养价值降低。传统添加组和改进添加组的干贝在整个加速贮藏过程中EPA+DHA含量损失比空白组干贝更少,说明茶多酚抑制了氧化底物的氧化损失。此外,改进添加组干贝的EPA+DHA含量损失比传统添加组干贝更少,说明茶多酚扩散到干贝组织内部后可以更全面保护干贝含有的EPA+DHA等不饱和脂质成分,更大程度上保持了干贝的营养价值。

图5 干贝加速贮藏过程中EPA+DHA含量的变化Fig. 5 Changes in EPA + DHA content of dried scallop adductor muscle during accelerated storage
2.6 干贝货架期的预测
干贝属于低水分食品,微生物活动受到抑制,是微生物稳定类食品,其品质劣变的主要原因是脂质氧化。GB 10136—2015《动物性水产制品》中明确规定了干贝等预制水产干制品的理化指标为PV,限量值为0.6 g/100 g脂质。因此,本实验以PV为干贝品质的监测指标,测定了干贝在45、55 ℃和65 ℃加速贮藏环境中PV的变化数据。如图6所示,在不同贮藏温度环境中,空白组、传统添加组和改进添加组干贝的PV随着贮藏时间的延长而逐渐升高,说明3 组干贝中氢过氧化物的持续生成和积累。
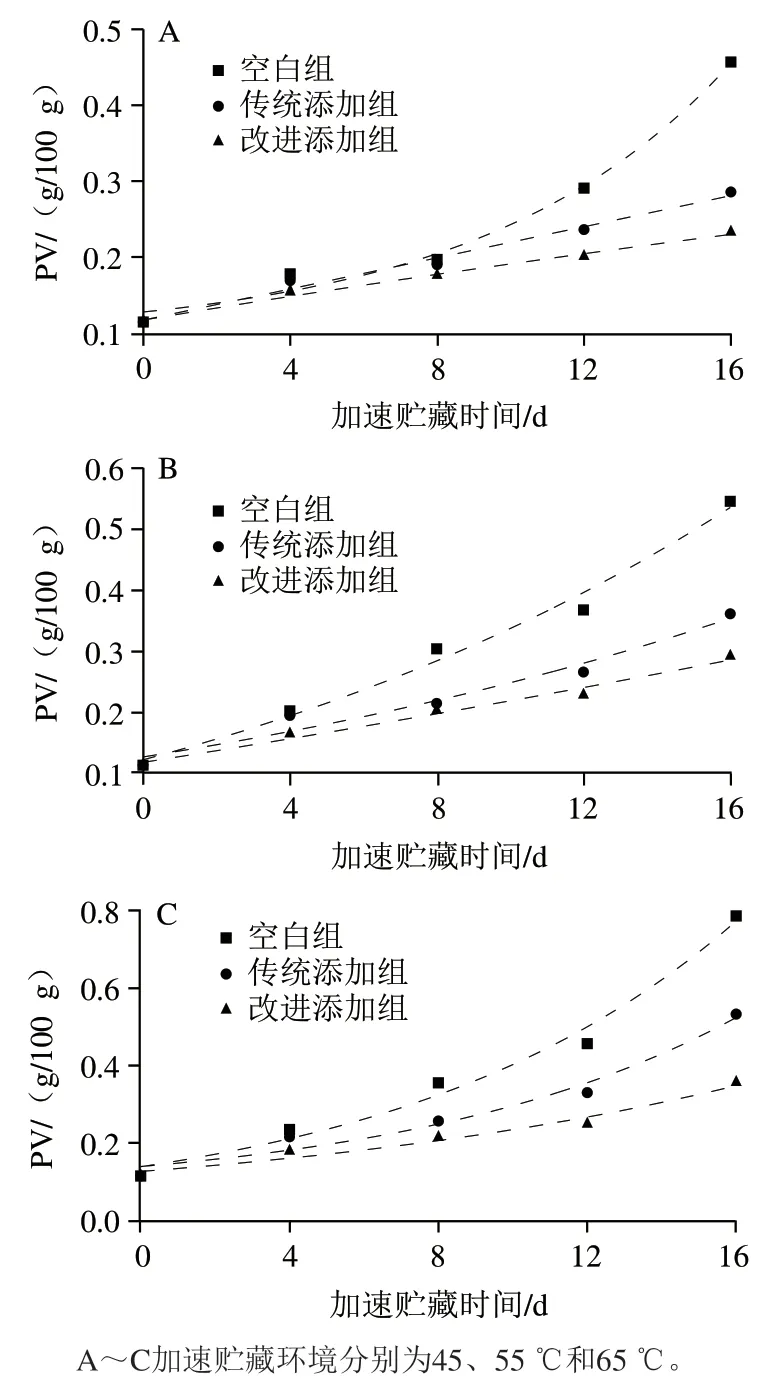
图6 干贝不同温度加速贮藏过程中PV的变化Fig. 6 Changes in PV of dried scallop adductor muscle during accelerated storage at different temperatures
在食品加工与贮藏过程中,大多数与品质相关的指标参数均符合反应动力学规律。本课题组前期研究结果也证实,相比于零级动力学方程,干贝在加速贮藏过程中PV的变化数据更符合一级动力学方程。因此,本研究采用一级动力学模型对采集到的干贝PV变化数据进行拟合处理,分别获得45、55 ℃和65 ℃条件下加速贮藏中干贝PV的一级动力学方程(表1)。根据一级动力学方程模型可知,空白组、传统添加组和改进添加组干贝45、55 ℃和65 ℃条件下PV的变化速率。将上述贮藏温度及对应的变化速率进行Arrhenius方程拟合,获得空白组、传统添加组和改进添加组干贝的Arrhenius方程,分别为lnk=-1 752/T+2.989 2、lnk=-2 576/T+5.162 5和lnk=-2 354/T+4.243 5,3 组干贝的E分别为14.57、21.42 kJ/mol和19.57 kJ/mol。

表1 干贝加速贮藏中PV动力学模型拟合Table 1 Kinetic models of PV in dried scallop adductor muscle during accelerated storage
进一步,基于从Arrhenius方程中获得的E和k等参数分别建立空白组、传统添加组和改进添加组干贝的货架期预测模型。将干贝的初始值和GB 10136—2015《动物性水产制品》中规定的干贝PV限量值(0.6 g/100 g脂质)分别代入货架期预测模型,计算获得空白组、传统添加组和改进添加组干贝在25 ℃下的预测货架期分别为29.76、53.71 d和63.94 d(表2)。传统添加方式,即茶多酚分布在干贝表面,能延长干贝货架期23.95 d,而改进添加方式比传统添加方式可以多延长干贝货架期10.23 d。

表2 干贝货架期预测模型及预测货架期Table 2 Shelf life prediction models of dried scallop adductor muscle and its predicted shelf life
3 结 论
通过测定耗氧量、初级氧化产物生成、次级氧化产物生成、自由基强度和氧化底物损失评价了不同茶多酚处理方式对干贝加速贮藏过程中脂质氧化稳定性的影响,同时建立干贝货架期预测模型,探究不同茶多酚处理方式对干贝预测货架期的影响。结果表明,将茶多酚添加至干贝表面和组织内部的方式比仅将茶多酚添加至干贝表面更能有效地延长干贝的氧化诱导时间,降低其PV、TBARS值、自由基强度和EPA+DHA的含量损失,提升干贝的氧化稳定性。空白组、传统添加组和改进添加组干贝的货架期分别为29.76、53.71 d和63.94 d,将茶多酚同时添加至干贝表面和组织内部的改进添加方式比仅将茶多酚添加至干贝表面的传统方式更能有效延长干贝的货架期。本研究为动物性海洋干制品的高效抗氧化和营养品质保持提供了理论依据和方法指导。

