外源脱落酸对发芽玉米籽粒中类胡萝卜素合成的影响
徐 昊,何伟伟,李大婧,包怡红,*,罗 浩,王凡予,张钟元
(1.东北林业大学林学院,黑龙江 哈尔滨 150040;2.江苏省农业科学院农产品加工研究所,江苏 南京 210014)
类胡萝卜素是一类广泛存在于高等植物中的烯萜类化合物,包括胡萝卜素和叶黄素类。在植物的光合作用中,类胡萝卜素能够吸收过量的光能,保护光合作用的细胞器。在人体内,类胡萝卜素具有很强的抗氧化活性,能保护细胞膜和脂蛋白免受氧破坏,延缓细胞衰老和预防癌症。但人和动物不能在体内合成类胡萝卜素,只能从饮食中摄取。
玉米籽粒中营养全面,含有碳水化合物、蛋白质、类胡萝卜素外,还含有膳食纤维、维生素和微量元素等营养成分。玉米中类胡萝卜素含量、总酚含量和总花青素含量在种子中较低,但在幼苗中很高。而玉米籽粒在萌发的过程中,类胡萝卜素、氨基酸、维生素和钙含量得到了显著提高,并降低了制品黏度,改善口感形成特殊的风味。因此,玉米籽粒通过萌发处理后可成为功能性食品。已有研究表明,脱落酸(abscisic acid,ABA)处理后可以提高番茄中β-胡萝卜素等类胡萝卜素含量,增强玉米中抗氧化酶活性,然而鲜有关于ABA调控发芽玉米富集类胡萝卜素的研究。
ABA是一种以异戊二烯为基本结构倍半萜类的植物生长激素,也是类胡萝卜素代谢途径中的下游产物。ABA具有抑制生长和促进休眠等作用,除此之外ABA可以有效启动植物体内抗逆基因表达,有效激活植物体内抗逆免疫系统,增强植物综合抗性。有研究表明ABA可以通过维持细胞膜稳定性等多个方面增加植物的抗氧化能力。钨酸钠(NaWoO)可以抑制内源ABA合成并阻断其信号传递,并抑制幼苗抗氧化能力。
因此,本实验以不同质量浓度ABA浸泡处理玉米籽粒,研究ABA浸泡处理对发芽玉米籽粒生长、抗氧化及类胡萝卜素含量的影响,旨在为开发一种快速有效富含类胡萝卜素的发芽玉米功能食品提供新途径。
1 材料与方法
1.1 材料与试剂
供试玉米‘苏玉29’,2020年产,购于江苏瑞华农业科技有限公司。
ABA、NaWoO上海阿拉丁有限公司;类胡萝卜素标准品、2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)、Trolox 美国Sigma公司;甲基叔丁基醚(methyl tert-butyl ether,MTBE)、甲醇(色谱纯)美国Tedia公司;酶联免疫检测试剂盒 南京建成生物研究所;多糖多酚植物总RNA提取试剂盒 北京天根生化科技有限公司;PrimeScriptMaster Mix试剂盒 北京宝日医生物技术有限公司;Powerup SYBR Green Master Mix试剂盒 美国Thermo Fisher公司;其他试剂均为国产分析纯。
1.2 仪器与设备
BS224S电子分析天平 北京赛多利斯科学仪器公司;LBI-150生化培养箱 上海龙跃仪器设备有限公司;FD-1A-50真空冷冻干燥机 北京博医康实验仪器有限公司;1260 Infinity II高效液相色谱(high performance liquid chromatography,HPLC)仪 美国Agilent公司;Q3荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Thermo Fisher公司;A11分析研磨机德国IKA公司;5424R台式高速离心机 德国Eppendorf公司。
1.3 方法
1.3.1 发芽玉米籽粒的培养
玉米籽粒用蒸馏水清洗去除杂质,置于0.5%次氯酸钠溶液中浸泡25 min消毒处理,用蒸馏水清洗数次至pH值为中性。室温25 ℃用ABA溶液(2.5、5、7.5 mg/L和10 mg/L)和8 g/L NaWoO溶液对玉米进行24 h浸泡处理。将浸泡好的玉米用蒸馏水清洗后转入垫有双层滤纸的培养皿中,以蒸馏水作为培养液,在25 ℃避光条件下恒温培养。发芽过程中每6 h喷洒一次蒸馏水,以保持玉米表面湿润,发芽72 h后,收获发芽玉米,立即用液氮速冻后置于-80 ℃冰箱中保存待用。
1.3.2 理化指标测定
发芽率根据国际种子试验协会的公式确定;芽长用游标卡尺测定。

可溶性蛋白质含量采用考马斯亮蓝G-250染色法测定;游离氨基酸含量采用茚三酮显色法测定;脯氨酸含量采用酸性茚三酮显色法测定。内源激素ABA含量采用酶联免疫检测试剂盒测定。
1.3.3 VC和总酚含量的测定
VC测定:称取2.5 g玉米粉末,加入少量4 ℃预冷的0.25%偏磷酸溶液浸提,冰浴条件下研磨后,用0.25%偏磷酸溶液定容至25 mL,4 ℃、10 000 r/min离心10 min,上清液经0.45 μm水系膜过滤后待HPLC测定。
HPLC条件:色谱柱为ZORBAX 300SB-C(4.6 mm×250 mm,5 μm),柱温25 ℃;流速0.8 mL/min;进样量20 μL;检测波长240 nm;流动相0.03 mol/L正磷酸溶液。
总酚测定:称取4.0 g玉米粉末,用70%乙醇溶液定容至50 mL。取上述溶液1.0 mL,加入5 mL蒸馏水、1.0 mL福林试剂和3.0 mL 7.5% NaCO溶液。在765 nm波长处测定吸光度。总酚含量以没食子酸毫克当量(mg/g)表示。
1.3.4 类胡萝卜素的提取与测定
将收集冷藏保存的新鲜玉米籽粒真空冷冻干燥后,粉碎过40 目筛得到玉米粉。称取3.0 g玉米粉置于磨口锥形瓶中,加入30 mL正己烷-乙醇-丙酮-甲苯(10∶6∶7∶7,V/V)混合萃取液,静置3~4 h,加入2 mL 40% KOH-甲醇溶液,摇匀后置于暗处25 ℃皂化16 h,将皂化液转入分液漏斗,加入30 mL正己烷,振荡摇匀,再加入38 mL 10%硫酸钠溶液,收集上层溶液,旋转蒸发,氮气吹干,用2 mL甲醇溶解,过0.45 μm有机滤膜后,待HPLC分析。
HPLC条件:色谱柱为YMC-C色谱柱(4.6 mm×250 mm,5 μm),柱温25 ℃;流速0.6 mL/min;进样量20 μL;检测器:二极管阵列检测器,检测波长450 nm;流动相:A为水-MTBE-甲醇(5∶25∶75,V/V);B为水-MTBE-甲醇(5∶85∶10,V/V)。梯度洗脱:0~4.5 min,95%~80% A、5%~20% B;4.5~12.5 min,80%~50% A、20%~50% B;12.5~18 min,50%~25% A、50%~75% B;18~24 min,25%~5% A、75%~95% B;24~30 min,5% A、95% B。
1.3.5 基因表达量分析
按照多糖多酚植物总RNA提取试剂盒说明书操作步骤提取发芽玉米总RNA,按照PrimeScriptMaster Mix试剂盒合成cDNA。根据NCBI上公布的各个基因序列设计引物(表1),引物由生工生物工程(上海)股份有限公司合成。按Powerup SYBR Green Master Mix试剂盒配制real-time PCR体系。以玉米中的肌动蛋白基因(ACTIN)作为内参基因,用2法计算各个基因的相对表达量。

表1 real-time PCR所用引物序列Table 1 Primer sequences used for quantitative real-time PCR analysis
1.3.6 抗氧化酶活性的测定
超氧化物歧化酶(superoxide dismutase,SOD)的活性通过其抑制50%硝基蓝四唑的光还原能力确定。在25 ℃下反应30 min后,在560 nm波长处测定吸光度。对照组同时进行,不提取酶。比活力以每毫克蛋白质的活性单位表示。蛋白含量参照Lowry法蛋白浓度测定试剂盒测定。
过氧化物酶(peroxidase,POD)活性采用愈创木酚氧化法测定。在470 nm波长下每隔1 min记录一次吸光度的变化。以每分钟吸光度变化0.01表示1 个过氧化物酶活性单位(U),最终酶活性以U/mg表示。
1.3.7 抗氧化能力的测定
采用Müller等的方法评价其清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、ABTS阳离子自由基的活性,分别在517 nm和405 nm波长处测定反应溶液的吸光度。结果以Trolox当量(mg/g和mmol/g)表示。铁离子抗氧化能力(Ferric ion reducing antioxidant power,FRAP)在593 nm波长处测定吸光度,用硫酸亚铁当量表示。
1.4 数据处理与统计分析
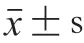
2 结果与分析
2.1 ABA处理对发芽玉米芽长和发芽率的影响
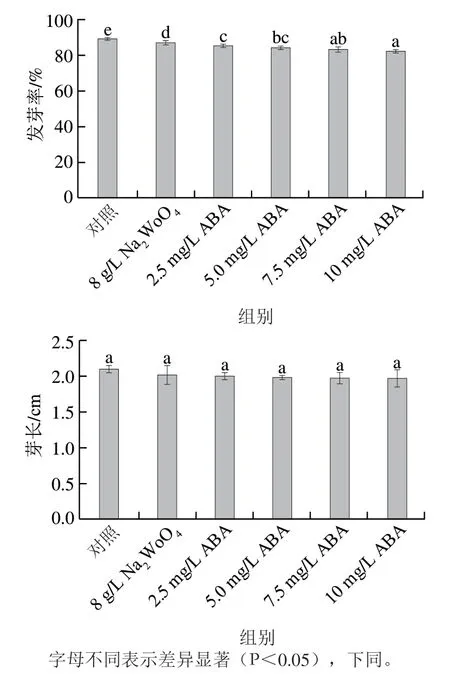
图1 ABA处理对发芽玉米发芽率和芽长的影响Fig. 1 Effect of ABA treatment on the germination rate and sprout length of germinated maize
如图1所示,玉米籽粒的发芽率和芽长随着ABA质量浓度的增加呈现降低趋势,当ABA质量浓度为2.5 mg/L时,发芽率和芽长分别较对照组降低3.9%和4.8%。ABA质量浓度增加则会抑制玉米籽粒的生长。而NaWoO处理后发芽率和芽长分别较对照组降低2.3%和3.8%。ABA有“休眠素”之称,会促进种子休眠和抑制幼苗生长。Wang Zhiying等在研究中发现ABA会抑制甘蓝芽的长度。这可能是因为添加外源ABA后玉米籽粒中ABA激素含量增高,而种子内ABA含量增加可能会导致种子生长趋势缓慢。
2.2 ABA处理对发芽玉米可溶性蛋白、游离氨基酸、脯氨酸和内源ABA含量的影响

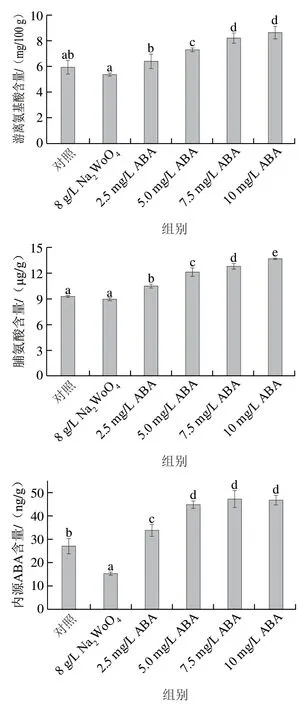
图2 ABA处理对发芽玉米可溶性蛋白、游离氨基酸、脯氨酸和内源ABA含量的影响Fig. 2 Effect of ABA treatment on the contents of soluble protein, free amino acids, proline and endogenous ABA in germinated maize
如图2所示,随ABA质量浓度增加,发芽玉米籽粒中可溶性蛋白、游离氨基酸和脯氨酸的含量呈逐渐增加的趋势,而NaWoO处理均低于对照组。在10 mg/L ABA处理组中,玉米籽粒中可溶性蛋白、游离氨基酸和脯氨酸含量分别较对照组提高9.9%、45.3%和47.0%。内源ABA含量随外源ABA添加呈大幅度升高的趋势。在7.5 mg/L ABA处理下内源ABA含量达到最高为47.16 ng/g,较对照组提高74.5%,当ABA质量浓度为10 mg/L时,内源ABA含量较7.5 mg/L ABA处理组略有下降(P>0.05),但NaWoO较对照组下降43.6%。这说明外源ABA可以正调节内源ABA含量。脯氨酸是重要的渗透调节物质,可以起到膜稳定剂的作用。可溶性蛋白可提高细胞的保水能力,从而保证细胞膜的稳定性。王相敏等研究发现外源ABA可以提高玉米幼苗中可溶性蛋白和脯氨酸的含量。可溶性蛋白、游离氨基酸和脯氨酸含量的增加可以改善玉米籽粒的生理状态,维持幼苗的正常生长。
2.3 ABA处理对发芽玉米VC和总酚含量的影响
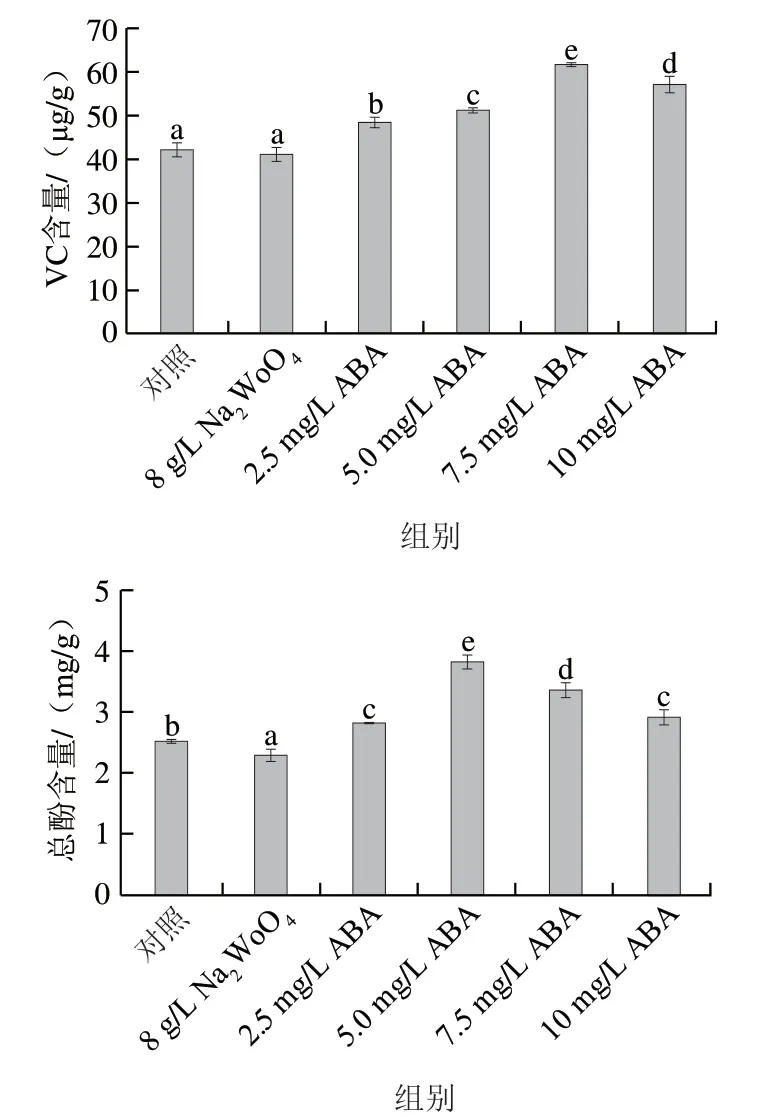
图3 ABA处理对发芽玉米中VC和总酚含量的影响Fig. 3 Effect of ABA treatment on the contents of vitamin C and total phenols in germinated maize
如图3所示,随着ABA质量浓度的增加发芽玉米籽粒中VC和总酚的含量呈先增加后降低趋势。总酚含量在5 mg/L ABA处理下达到3.83 mg/g,较对照组提高51.4%,张一冉等发现ABA可以促进李果实中总酚含量的富集,其原因可能是ABA延缓果实多酚氧化酶的上升,并避免了多酚氧化酶和总酚的接触。VC含量在7.5 mg/L ABA处理下达到最高,较对照组提高46.2%,可能是因为外源ABA处理通过影响AsA合成相关基因的表达从而促进VC含量的增加。而NaWoO处理后发芽玉米籽粒中总酚和VC含量较对照组有所降低,其原因可能是NaWoO间接抑制了ABA的合成,从而导致发芽玉米籽粒中VC和总酚含量有所降低。
2.4 ABA处理对发芽玉米富集类胡萝卜素含量的影响

表2 不同质量浓度ABA处理下发芽玉米中类胡萝卜素含量Table 2 Carotenoid contents in germinated maize treated with different concentrations of ABA μg/g
本研究在发芽玉米籽粒中检测到6 种类胡萝卜素,包括叶黄素、玉米黄质、α-隐黄质、β-隐黄质、α-胡萝卜素和β-胡萝卜素。如表2所示,玉米籽粒中主要的类胡萝卜素为叶黄素和玉米黄质,其他物质含量相对较低。经过ABA处理后,发芽玉米籽粒6 种类胡萝卜素含量随ABA质量浓度增加呈现先升高而后降低的趋势。经过5 mg/L ABA处理后,6 种类胡萝卜素含量均达到最大值,叶黄素、玉米黄质、α-胡萝卜素、β-胡萝卜素和β-隐黄质含量较对照组分别提高27.6%、20.1%、52.4%、71.7%和12.5%。而NaWoO处理后,叶黄素、玉米黄质、α-隐黄质和α-胡萝卜素分别较对照组下降了10.6%、7.2%、6.6%和19%,β-隐黄质和β-胡萝卜素较对照组差异不明显。Barickman等发现外源ABA可以提高番茄中类胡萝卜素含量,有效地保护叶黄素循环,并推测ABA可能通过增加PSY等关键酶的活性间接调控类胡萝卜素途径。
2.5 ABA处理对类胡萝卜素合成酶基因表达量的影响
利用real-time PCR检测ABA处理后类胡萝卜素代谢相关基因表达的变化。如图4所示,随ABA质量浓度的增加,基因表达呈先上升后下降的趋势。在5 mg/L ABA处理下,PSY、PDS、ZDS、LCYB、LCYE、BCH1和CYP97C的转录表达量最高,分别是对照组的1.95、2.02、1.70、1.65、1.96、1.71 倍和2.37 倍;NCED的转录表达在7.5 mg/L ABA处理下达到最高为1.65 倍。而NaWoO处理后关键酶基因表达量下调,其中NCED基因表达量下降最多。
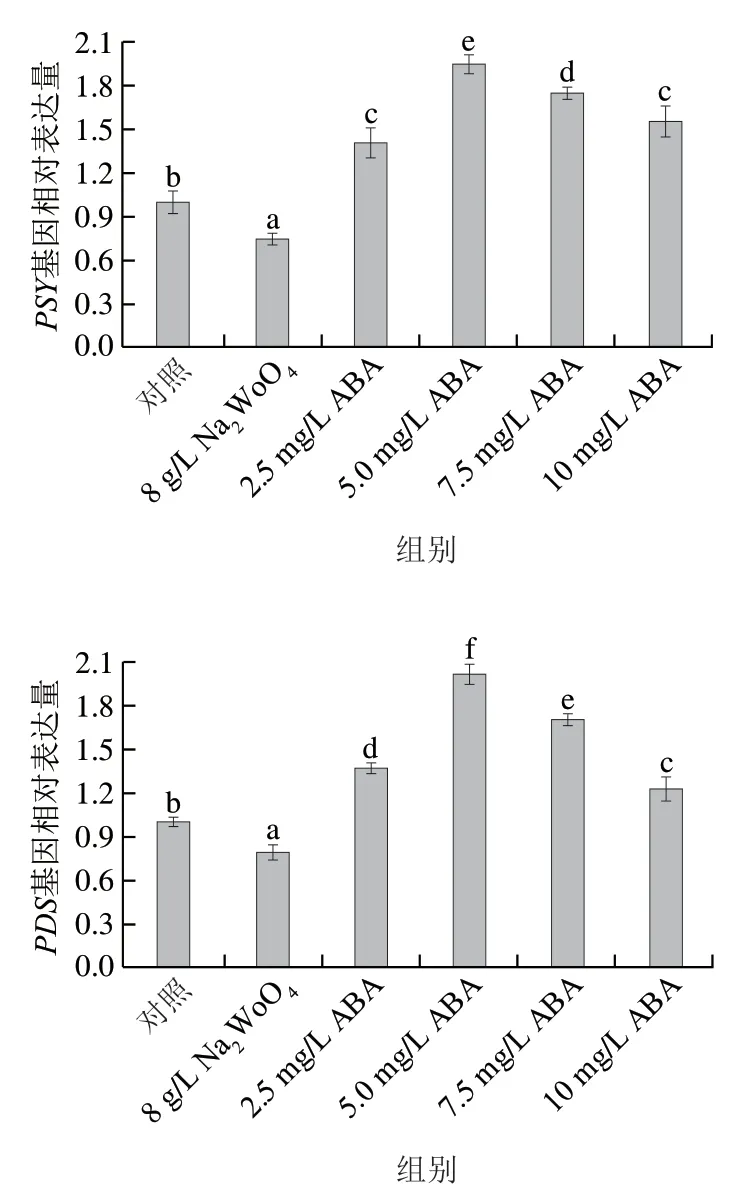


图4 ABA处理对类胡萝卜素关键合成酶基因表达量的影响Fig. 4 Effect of ABA treatment on the expression of key genes associated with carotenoid synthase
在类胡萝卜素途径中,PSY主要决定反应速率和控制代谢通量。在拟南芥幼苗中,ABA可以正调控PSY基因表达从而导致类胡萝卜素含量增加。Wu Qiong等发现ABA可以诱导番茄果实中PDS和ZDS基因表达上调,使类胡萝卜素含量增加。而内源ABA可以通过调节基因表达刺激类胡萝卜素的合成。本实验发现ABA可以诱导PSY、PDS和ZDS基因表达量上调,这可能是促进类胡萝卜素合成的原因。LCYB和LCYE可以催化番茄红素产生α-胡萝卜素或β-胡萝卜素,BCH1可将β-胡萝卜素转化为β-隐黄质,BCH1和CYP97C可将α-胡萝卜素转化为叶黄素。因此,α-胡萝卜素、β-胡萝卜素和叶黄素含量的增加,可能与LCYB和LCYE基因表达上调有关;而β-隐黄质和叶黄素含量增加,可能是BCH1和CYP97C基因的上调原因。高等植物中ABA生物合成的关键酶是NCED。NCED基因过量表达可以促进ABA的合成。而NaWoO处理抑制类胡萝卜素含量的富集,可能是NaWoO抑制了内源ABA的合成。
2.6 ABA处理对抗氧化酶活性的影响
ABA处理后显著提高了发芽玉米籽粒中抗氧化酶活性(图5)。5 mg/L ABA处理后SOD(48.36 U/mg)和POD(24.55 U/mg)较对照组分别提高40.0%和38.6%。抗氧化酶系统中的SOD、POD等抗氧化酶协同清除植物体内过量的活性氧,维持生理生化平衡。王相敏等发现添加外源ABA可以提高玉米在干旱环境中SOD和POD活性。这可能是因为ABA可以帮助清除植物体内的氧自由基,保护细胞尽量不受伤害,增强植物幼苗的抗氧化酶活性。而NaWoO抑制内源ABA的合成,可能是NaWoO处理后抗氧化酶活性降低的原因。
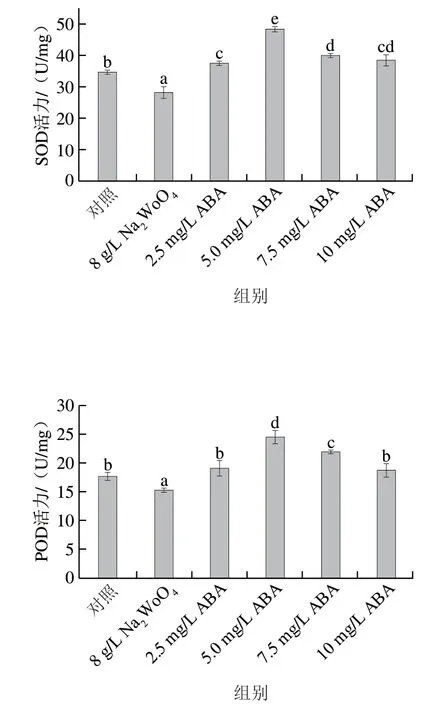
图5 不同质量浓度ABA处理对发芽玉米中抗氧化酶活性的影响Fig. 5 Effect of different concentrations of ABA treatment on the antioxidant enzyme activity in germinated maize
2.7 ABA处理对抗氧化能力的影响

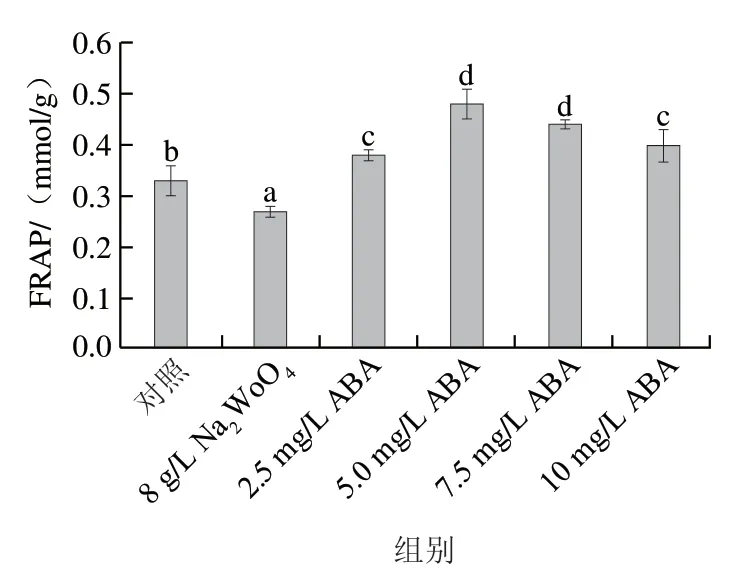
图6 不同质量浓度ABA处理对发芽玉米中抗氧化能力的影响Fig. 6 Effect of different concentrations of ABA treatment on the antioxidant capacity of germinated maize
如图6所示,随着ABA质量浓度的升高,发芽玉米籽粒中总抗氧化能力呈先升高而后降低的趋势。5 mg/L ABA处理后DPPH自由基清除能力(27.42 mg/g)、ABTS阳离子自由基清除能力(1.66 mmol/g)和FRAP(0.48 mmol/g)较对照组分别提高21.2%、12.2%和45.5%。DPPH和ABTS是基于单电子转移反应机制的抗氧化评价方法,能够反映体外清除自由基的能力。FRAP是通过氧化还原能力反映物质总抗氧化的活性。徐颖等在研究苹果时发现,总酚与抗氧化之间存在显著正相关性。本实验结果与之相符合。
2.8 ABA处理下类胡萝卜素含量与总酚、VC、抗氧化酶活性和抗氧化能力的相关性分析

图7 ABA处理下类胡萝卜素含量与总酚、VC、抗氧化酶活性和抗氧化能力的相关性分析Table 7 Correlation analysis between carotenoid content and total phenols, VC, antioxidant enzyme activity and antioxidant capacity in germinated maize with ABA treatment
如图7所示,发芽玉米中抗氧化酶活性和抗氧化能力与总酚含量呈极显著正相关(P<0.01),与VC含量相关性较弱。Maisuthisakul等认为植物体内的抗氧化活性主要由酚类物质提供,酚类物质与抗氧化活性直接相关。同时叶黄素、α-胡萝卜素和β-胡萝卜素与抗氧化酶活性、抗氧化能力和总酚呈极显著正相关(P<0.01),玉米黄质和β-隐黄质与抗氧化酶活性、抗氧化能力和总酚呈显著正相关(P<0.05)。综上,玉米籽粒中抗氧化能力和抗氧化酶活性的增强可能与总酚、叶黄素、α-胡萝卜素和β-胡萝卜素含量增加有关。
3 结 论
探究ABA对发芽玉米籽粒生长和类胡萝卜素含量的影响。结果表明,ABA会抑制发芽玉米籽粒的发芽率和芽长。随着ABA质量浓度升高,发芽玉米籽粒中可溶性蛋白、游离氨基酸、脯氨酸和内源激素ABA含量逐渐增加。ABA可以有效提高VC和总酚含量,但当ABA质量浓度过高时,则会出现降低的现象。5 mg/L ABA是发芽玉米籽粒富集类胡萝卜素的最佳条件,这可能与ABA可以正调节合成类胡萝卜素相关基因有关。而NaWoO抑制类胡萝卜素含量的累积,这可能与NaWoO间接抑制内源激素ABA合成有关。5 mg/L ABA处理后,SOD、POD抗氧化酶活性和DPPH、ABTS、FRAP抗氧化能力达到最大值,并发现总酚、叶黄素、α-胡萝卜素和β-胡萝卜素含量与抗氧化能力和抗氧化酶活性呈显著相关性。因此,5 mg/L ABA处理发芽玉米籽粒可作为提高发芽玉米类胡萝卜素含量的一种方法,并为开发功能性发芽玉米提供理论参考。

