脯氨酰羟化酶对宰后牦牛肉糖酵解及肉品质的影响
胡 博,辛可启,余群力,*,宋仁德,张新军,石红梅
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.青海省玉树州畜牧兽医工作站,青海 玉树 815000;3.宁夏夏华肉食品有限公司,宁夏 中卫 751700;4.甘肃省甘南州畜牧兽医工作站,甘肃 甘南 747000)
牦牛生活在海拔高度为3 000~5 000 m的高原地区,是一种能够适应高原低氧严寒环境的珍惜畜种资源。牦牛肉具有高蛋白、低脂肪、氨基酸和矿物质含量丰富等优点,得到越来越多消费者的青睐。但受到高海拔地区恶劣环境的影响,牦牛生长缓慢,存在肌肉发育迟缓、脂肪沉积效率差、嫩度差等问题,使牦牛肉行业的发展受到限制,故牦牛肉品质的调控就显得尤为重要。
宰后成熟能显著提高肉的嫩度、风味和整体接受度,是肉类品质提升的重要手段。动物屠宰放血后,肌肉供氧中断,内环境处于缺氧状态,肌肉细胞无法通过有氧呼吸满足机体代谢的能量需求,只能通过糖酵解产生腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)为细胞供能。宰后糖酵解在肌肉细胞的细胞质中进行,糖原在缺氧条件下转化为丙酮酸并生成少量ATP。糖酵解是影响肉品质的重要生化途径,劣质肉的产生充分证明了这一点。劣质肉一般被分为两类:一类肉色苍白、质地松软、表面渗水的被称为PSE肉;另一类肉色较深、质地坚硬、外表干燥的被称为DFD肉。劣质肉产生的主要原因是宰前应激导致的糖酵解速率异常,而劣质肉的产生每年给肉品工业带来巨大的经济损失,因此调控糖酵解对保证良好的肉品质具有重要意义。
糖酵解在宰后肌肉转化成肉的过程中发挥着重要作用,其受到遗传、环境、营养等因素的影响。肌肉宰后最明显的环境变化是缺氧,低氧诱导因子-1是适应氧变化机制中的核心分子,脯氨酰羟化酶(prolylhydroxylase,PHD)是低氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)降解的限速酶。在常氧环境下,HIF-1α的402和564位脯氨酸残基会被PHD羟基化,E3连接酶林希氏蛋白(protein von hippel-lindau,pVHL)识别并结合羟基化的HIF-1α,进而募集泛素蛋白,最终进入26S蛋白酶体被降解。在缺氧细胞中,PHD通过调控HIF-1α的表达量进而影响糖酵解酶活性,介导糖酵解进程。而在宰后牦牛肉中PHD对HIF-1α及糖酵解酶是否具有相同的调控作用尚不明确,故探究PHD对宰后牦牛肉HIF-1α,糖酵解及肉品质的影响具有一定的理论意义。
1 材料与方法
1.1 材料与试剂
牦牛样本采自青海西宁,选择发育正常,健康无病,平均年龄3~4 岁的牦牛5 头。牦牛进厂后停食,休息24 h,宰前3 h禁水,屠宰过程严格按照DB63/T 1785—2020《牦牛屠宰技术规程》。牛屠宰放血后取其背最长肌,剔除肉样表面的脂肪和结缔组织,分割为100 g左右的肉块。注射生理盐水和二甲基乙二酰氨基乙酸(dimethyloxaloylglycine,DMOG),DMOG浓度为100 μmol/L,DMOG是可渗透细胞,竞争型的PHD抑制剂,它可以有效抑制细胞中羟脯氨酸的合成,进而抑制PHD的活性,以此与生理盐水对照组做比,探究PHD的作用。注射质量体积比为1∶1。样品注射后在4 ℃、风速3 m/s、相对湿度85%条件下成熟0、3、6、12、24、48、72、120、168 h后取样,并测定相应指标。对于不便立即测定的指标,将肉样贮存于-80 ℃待用。
DMOG 北京索莱宝科技有限公司;氯化钾、氯化镁、磷酸钾、乙二胺四乙酸 天津市致远化学试剂有限公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)试剂盒 武汉赛维尔生物科技有限公司;肝/肌糖原试剂盒、乳酸试剂盒、己糖激酶(hexokinase,HK)试剂盒、磷酸果糖激酶(phosphofructokinase,PFK)试剂盒、丙酮酸激酶(pyruvate kinase,PK)试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
FA2004B电子天平 上海佑科有限公司;TGL-16M高速台式冷冻离心机 长沙湘仪仪器有限公司;FJ200-SH分散均质机 上海沪析实业有限公司;DW-86L416G超低温冰箱 青岛海尔生物医疗有限公司;SP-756P紫外-可见分光光度计 上海光谱有限公司;Testo 205便携式pH计 杭州德图仪表有限公司;CR-410色彩色差计日本Konica Minolta公司;BV-2电泳仪 武汉赛维尔生物科技有限公司。
1.3 方法
1.3.1 剪切力的测定
参照NY/T 1180—2006《肉嫩度的测定 剪切力测定法》测定。
1.3.2 肉色的测定
先将色度仪预热30 min后用白板校准,然后在肉样表面随机选取3 个不同的点测定L*值和a*值。
1.3.3 苏木精-伊红(hemotoxylin and eosin staining,HE)染色
参考Zhang Jiaying等的方法,将肉样浸没在含有10%福尔马林的磷酸缓冲液中进行固定,组织切片经HE染色处理后在光学显微镜下拍照。用Image-Pro Plus 6.0对图像进行分析,每幅图随机选取30 个肌细胞,测算肌纤维面积,直径及间距。
1.3.4 pH值的测定
pH计使用前用标准溶液校准,每块肉样随机选取3 个部位,将便携式pH计探头插入肉样中,待显示屏上“AUTO HOLD”字样停止闪烁后记录读数。
1.3.5 糖原、乳酸含量及HK、PFK、PK活性的测定
糖原、乳酸含量及HK、PFK、PK活性的测定均使用南京建成生物工程研究所的试剂盒,实验方法按各试剂盒说明书进行。
1.3.6 免疫印迹
参考王婷的方法,稍作修改。取1 g肉样剪碎,加入10 倍体积的裂解液,冰浴匀浆(10 000 r/min,30 s)多次,置于冰上裂解30 min。将裂解后的匀浆液离心(12 000 r/min,4 ℃,10 min),取上清,BCA法测定蛋白浓度。按照体积比4∶1在蛋白溶液中加入5×还原型上样缓冲液,煮沸15 min。用12%分离胶和5%浓缩胶进行SDS-PAGE分析。使用300 mA恒定电流将凝胶中解析的蛋白质转移到PVDF膜上。5%脱脂奶封闭1 h后加入一抗(GAPDH∶GAPDH小鼠单克隆,1∶2 000;HIF-1α∶多克隆兔抗小鼠,1∶1 000),4 ℃孵育过夜。洗涤后加入二抗(山羊抗兔,1∶3 000)室温孵育1 h。洗涤后使用E-Gel成像系统对印迹进行成像,并使用Alpha软件进行条带密度分析。
1.4 数据处理
上述各项指标至少重复3 次。采用SPSS 21.0软件进行数据分析,Duncan多重检验对数据进行差异显著性分析(P<0.05),Origin 9.0绘图。
2 结果与分析
2.1 牦牛肉成熟过程中HIF-1α表达量及糖酵解酶活性的变化
2.1.1 牦牛肉成熟过程中HIF-1α表达量的变化

图1 HIF-1α免疫印迹及蛋白表达量Fig. 1 Western blot analysis of HIF-1α expression and protein expression analysis
前人研究发现HIF-1α改善了动物机体对低氧环境的适应性,在低氧应答反应中起重要作用。由图1可知,随着成熟时间的延长,两组的HIF-1α表达量均呈先上升后下降的趋势,DMOG组在12 h达到最高,而对照组在72 h达到最高,DMOG组的HIF-1α表达量除24、48、72 h外均显著高于对照组(P<0.05)。朱宏的研究结果指出食管癌细胞株HIF-1α表达量随缺氧时间的延长呈现先升高后降低的趋势,本研究结果与之存在相似规律。由于癌细胞和宰后肌肉细胞都处于缺氧环境中,宰后肌肉细胞随成熟时间的延长缺氧程度加深,结合高永芳的研究推测HIF-1α表达水平随成熟时间的变化可能由宰后肌肉缺氧程度的不同引起。PHD是HIF-1α降解的限速酶,当PHD活性被抑制时,其引起的HIF-1α脯氨酸残基羟基化受到影响,导致HIF-1α无法进一步与pVHL结合发生降解,因此HIF-1α在细胞内积累,表达量升高。总之,HIF-1α表达量随成熟的变化与宰后肌肉缺氧程度有密切关系,同时PHD可引起HIF-1α脯氨酸残基羟基化,促进HIF-1α降解,使其表达水平下降。
2.1.2 牦牛肉成熟过程中糖酵解酶活性的变化
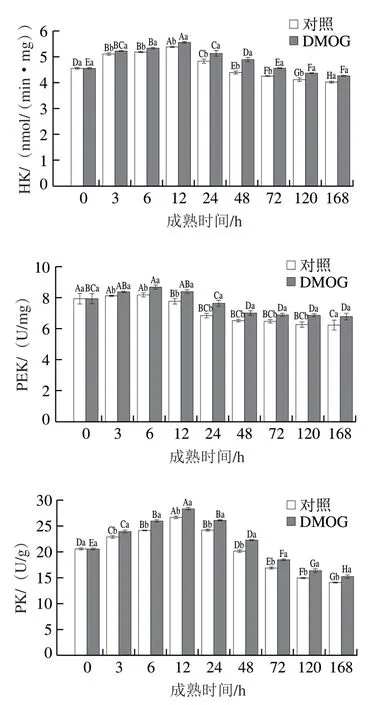
图2 宰后成熟过程中糖酵解酶活的变化Fig. 2 Changes in glycolytic enzyme activities during postmortem aging
HK、PFK、PK是糖酵解过程中的限速酶。HK催化葡萄糖进入糖酵解过程的第一步生化反应,使葡萄糖转化为葡萄糖-6-磷酸;PFK催化6-磷酸果糖转化为1,6-二磷酸果糖;PK参与糖酵解过程的最后一步反应,催化磷酸烯醇式丙酮酸生成丙酮酸和ATP,它们的活性可以影响宰后糖酵解的进程和速率。由图2可知,随着成熟时间的延长,HK、PFK、PK的活性均呈现先上升后下降的趋势。DMOG组与对照组相比,HK、PFK、PK的活性在3~120 h都显著高于对照组(P<0.05)。党永明等的研究指出:在缺氧细胞中,HK和PFK的活性呈先上升后下降的趋势,且缺氧组的HK和PFK活性均较对照组高,这与本研究结果存在相似规律。有多项研究证实HIF-1α的表达水平与HK、PFK、PK的活性存在显著相关性,推测在宰后成熟过程中,HK、PFK、PK的活性变化可能与PHD引起的HIF-1α表达水平的差异相关。同时,Semenza等的研究指出HIF-1可与编码HK、PFK、PK基因启动子区域的缺氧反应元件共识序列(5’-(A/G)CGTG-3’)结合,促进它们的表达。鉴于PHD在HIF-1α表达中的作用,PHD可能通过HIF-1α调节HK、PFK、PK的活性。
2.2 牦牛肉成熟过程中糖酵解指标的变化
2.2.1 牦牛肉成熟过程中糖原、乳酸含量的变化

图3 宰后成熟过程中糖原(a)和乳酸(b)含量变化Fig. 3 Changes in contents of glycogen (a) and lactate (b) during postmortem aging
乳酸是糖酵解途径的终产物,乳酸的积累会引起肌肉内环境的变化。由图3可知,随着成熟时间的延长,糖原含量逐渐降低,而乳酸含量在72 h前呈上升趋势,72 h后下降。DMOG组的糖原含量显著低于对照组(P<0.05),而乳酸含量显著高于对照组(P<0.05),同时DMOG组和对照组0~168 h糖原含量分别降低了52.99%和50.57%,0~72 h乳酸含量分别上升了84.03%和68.14%。糖原和乳酸含量随成熟时间的变化趋势与杨雅媛等的研究结果存在相似规律。宰后肌肉处于缺氧环境,缺氧会使细胞内HIF-1α的表达量升高,糖酵解增强,糖原更快速地被消耗而乳酸得到积累,含量上升。结合糖酵解酶的研究结果推测:PHD通过HIF-1α调节糖酵解酶活性介导糖酵解途径,影响糖酵解速率,糖原的消耗量和乳酸的生成量随之发生变化。

表1 宰后成熟过程中肌纤维直径、间隙及面积Table 1 Changes in gap between muscle fibers and muscle fiber diameter and area during postmortem aging
2.2.2 牦牛肉成熟过程中pH值的变化
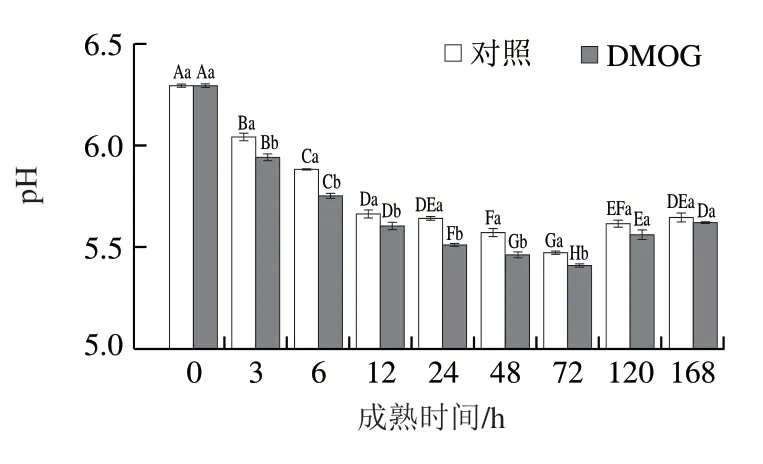
图4 宰后成熟过程中pH值的变化Fig. 4 Changes in pH during postmortem aging
pH值影响宰后肌肉多项食用品质的形成,如嫩度、肉色、风味等。由图4可知,DMOG组和对照组的pH值随着成熟时间的延长均呈先减小后增大的趋势,在3~72 h时,DMOG组的pH值始终显著低于对照组(P<0.05)。前期pH值的下降可能是由糖酵解产物乳酸的积累引起的。后期由于糖酵解供能效果较差,细胞内的ATP含量逐渐下降,Ca从肌质网释放到肌浆中,从而导致钙激活酶活化,分解肌间蛋白,产生的碱性物质使得pH值上升。由于PHD/HIF-1α通路对宰后肌肉糖酵解进程有加速作用,乳酸的生成量增加,致使pH值降低,从而产生了DMOG组和对照组pH值变化的差异。结果表明,抑制PHD会使HIF-1α表达水平上升,加速糖酵解进程,进而使乳酸的生成量更高,pH值更低。
2.3 牦牛肉成熟过程中肉品质的变化
2.3.1 牦牛肉成熟过程中肌纤维直径、间隙和面积的变化

图5 不同成熟时间的HE染色(×200)Fig. 5 Results of HE staining at different time points during postmortem aging (× 200)
肌纤维直径,间隙和面积可以反映肌原纤维结构的完整性,是评估肉嫩度的重要指标。由图5和表1可知,肌纤维直径和面积随着成熟时间的延长不断减小,DMOG组的肌纤维直径和面积始终大于对照组,但在0~120 h差异不显著;肌纤维间隙随着成熟时间的延长不断增加,DMOG组的肌纤维间隙小于对照组,在72、120 h差异显著(P<0.05)。这与王莉等对宰后牦牛肉肌纤维直径、间隙、面积的测定结果具有相似规律。在宰后成熟过程中,肌动蛋白和肌球蛋白之间的连接蛋白逐渐降解,肌纤维完整的结构被破坏,使原本完整的肌原纤维断裂成不同肌节数目的碎片。碎片化的肌纤维直径和面积不断减小,间隙变大,使得肌肉的嫩度得到改善。Xiong Guoyuan等也指出肌原纤维小片化指数越大,肌纤维结构完整性越差,肌肉嫩度越好。DMOG组的肌纤维直径,面积都大于对照组,肌纤维间隙小于对照组,但其差异不显著,说明PHD/HIF-1α通路对牦牛肉宰后成熟过程中肌纤维特性变化的影响有限。
2.3.2 牦牛肉成熟过程中剪切力的变化

图6 宰后成熟过程中剪切力的变化Fig. 6 Changes in shear force during postmortem aging
剪切力是直接反映嫩度变化的指标。由图6可知,随着成熟时间的延长,2 个组的剪切力呈先上升后下降的趋势,而DMOG组的剪切力在3~72 h显著高于对照组(P<0.05)。在宰后成熟早期,肌肉处于高pH值环境下,肌浆网内的Ca不断积累,激活肌动球蛋白ATP酶,从而使肌肉发生痉挛,肌纤维迅速收缩,最终致使嫩度变差。在成熟后期,由于一系列内源蛋白酶的作用,导致肌纤维的结构被破坏,剪切力下降。而在成熟过程中处理组的剪切力始终高于对照组可能是由于pH值的差异引起的。刘佳东的研究指出:牦牛肉的剪切力与pH值呈显著相关(P<0.05),同时极限pH值越低,越接近肌球蛋白和肌动蛋白的等电点,肉的嫩度越差。综上,PHD/HIF-1α通路通过对pH值的调控进而对牦牛肉宰后嫩度的形成产生影响。
2.3.3 牦牛肉成熟过程中肉色的变化
肉的颜色对消费者判断肉的新鲜程度具有重要意义,通常肉表面的褐变被认为是肉品质的劣变。由图7可知,随着成熟时间的延长,L*、a*值都呈先升高后降低的趋势,但L*值于72 h达到最高值,a*值于48 h达到最高值,DMOG组的L*值在6~168 h显著高于对照组(P<0.05),a*值始终显著高于对照组(P<0.05)。Farouk等发现宰后肌肉pH值的变化能够引起肌原纤维蛋白的变性以及蛋白网络空间结构的改变。pH值下降,自由水渗出增加,增强了光的反射能力,使L*值增大。在本研究中,由于PHD/HIF-1α通路引起pH值的变化,使之在0~72 h不断下降,从而引起L*值上升。肌肉的a*值取决于肌红蛋白的含量及氧化状态。宰后初期a*值的升高可能是由于线粒体的呼吸作用产生NADH,NADH增加了肌肉中还原酶的活力,导致a*值上升;随着宰后成熟的进行,肌肉内部的氧分压不断下降,肌红蛋白更倾向于转化为褐色的高铁肌红蛋白,a*值随之下降。高永芳的研究指出高海拔牦牛肌肉内的肌红蛋白含量要高于低海拔牦牛和肉牛,这同时也是牦牛高海拔低氧适应性的体现。总之,PHD/HIF-1α通路介导糖酵解途径引起pH值的变化,进而使L*值增大,而其对a*值的影响可能与肌红蛋白含量有关,其作用机理需要进一步探究。

图7 宰后成熟过程中肉色的变化Fig. 7 Changes in color parameters during postmortem aging
3 结 论
在牦牛肉宰后成熟期间,随着成熟时间的延长,HIF-1α表达量、HK、PFK、PK活性、乳酸含量、L*值、a*值、剪切力均呈先上升后下降的趋势;糖原含量、肌纤维直径和面积均呈不断下降的趋势;pH值呈先降后升的趋势;肌纤维间隙呈不断上升的趋势。抑制PHD使HIF-1α表达量显著升高(P<0.05),PHD通过HIF-1α显著上调了糖酵解关键酶活性,加快了糖原的消耗速率,乳酸的积累速率和pH值下降速率(P<0.05)。同时,DMOG组的L*值、a*值、剪切力显著高于对照组(P<0.05)。通过对PHD的调控,得到其调节肉品质的机理可能是:PHD通过HIF-1α上调糖酵解酶活性,加速糖酵解进程,引起肌肉内环境的变化,使肌肉嫩度变差,但肉色得到一定的改善。综上,PHD/HIF-1α及其级联调控对改善牦牛肉品质具有重要作用,本研究进一步完善了宰后成熟的机理,为宰后肉品质的改善提供了新思路。

