支气管肺泡灌洗液宏基因组学二代测序对侵袭性肺真菌病的诊断价值
韩李周,靳妍玉
(焦作市人民医院呼吸与危重症医学科,河南 焦作 454002)
近年来,随着造血干细胞移植、放化疗、器官移植、免疫抑制剂和糖皮质激素的应用,慢性结构性肺病患者和免疫缺陷人群的增多,以及人口老龄化,使侵袭性肺真菌病(invasive pulmonary fungal diseases,IPFD)发病率呈上升趋势[1]。由于IPFD临床表现缺乏特异性,导致早期诊断较困难。此类疾病进展迅速、预后差,以侵袭性肺曲霉病(invasive pulmonary aspergillosis,IPA)为代表的IPFD病死率可达50%~100%[2]。为尽早救治、改善预后,临床采取分层诊治的策略,分为拟诊、临床诊断和确诊,对应经验性治疗、先发治疗和靶向治疗。拟诊需满足真菌感染的危险因素和临床特征,临床诊断除前2项外还需要微生物学证据,确诊必需有组织病理学证据[3]。而IPFD患者常因病情危重无法取得组织病理学证据,有时甚至无微生物学证据,给临床诊治带来挑战。宏基因组学二代测序(metagenomics next-generation sequencing,mNGS)技术的应用为IPFD的诊断打开了突破口。该技术不依赖样本镜检和微生物培养,允许无差别检测样本中所有微生物的核酸信息,具有高通量和迅速报告结果的优势,有望改变IPFD的传统诊断模式。本研究回顾性分析焦作市人民医院呼吸与危重症医学科采用支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)mNGS检测诊治的IPFD患者的临床资料,探讨MNGS检测的诊断价值,现将结果报道如下。
1 资料与方法
1.1 一般资料选择2020年5月至2022年5月焦作市人民医院呼吸与危重症医学科收治的23例IPFD患者为研究对象。病例纳入标准:(1)符合IPFD诊断标准[3],达到临床诊断或确诊标准;(2)接受支气管镜检查及BALF的传统微生物学和mNGS检测。排除标准:(1)年龄<18岁;(2)孕产妇;(3)伴有严重心肺功能不全、不稳定心绞痛、高血压危象、急性脑血管病等不能耐受气管镜检查者;(4)血小板计数<20×109L-1者。23例患者中男15例,女8例;年龄24~87岁,中位年龄67岁;有2种以上基础疾病者15例,1种基础疾病者7例,无基础疾病者1例(有潮湿发霉环境工作史)。
1.2 病原菌检测方法
1.2.1 BALF留取方法BALF的留取参照《肺部感染性疾病支气管肺泡灌洗病原体检测中国专家共识(2017年版)》[4]进行操作。由临床医生在常规电子支气管镜检查气道后,防污染采样刷检查前,取60~120 mL无菌生理盐水灌洗目标肺段或亚段,取第2瓶灌洗液送检mNGS,其余灌洗液进行传统检测。
1.2.2 BALF传统检测包括BALF真菌涂片显微镜检查与培养。BALF离心,将沉淀物涂片进行显微镜检查。低倍镜下鳞状上皮细胞占全部细胞(不包括红细胞)的比例<1%,柱状上皮细胞占全部细胞的比例<5%判定为合格标本。革兰染色、抗酸染色、六胺银染色等处理后行显微镜检查。取100 μL沉淀物混匀后接种于沙堡弱琼脂培养基培养。涂片镜检与培养结果一致判定为阳性结果。
1.2.3 BALF mNGS检测将BALF送微远基因公司检测,分为样本处理、高通量基因测序、生物信息分析、报告解读等流程。取600 μL肺泡灌洗液(黏稠的样本加入酶液化液进行液化),使用预设的破壁仪程序进行破壁处理,然后吸取300 μL,使用微量样品基因组DNA提取试剂盒[天根生化科技(北京)有限公司]提取DNA,严格按照试剂盒说明书进行操作。提取的DNA经转座酶建文库给待测核酸加上标签序列,制备好的文库经过纯化、扩增、再纯化后,使用Qsep1和Qubit分别对文库片段大小和文库浓度进行定量。然后依据预设的上机数据量将文库进行定量混合后,使用美国illumina公司的Nextseq 550Dx基因测序仪进行测序。去除低质量以及长度小于 40 bp的序列后获得高质量的数据。通过Burrows-Wheeler-Alignment(BWA:http://bio-bwa.sourceforge.net/)软件将获得的高质量数据与人参考基因序列(hg38)进行比对,去除高质量数据中的人源序列。剩余的非人源序列在去除低复杂度序列后与专用的微生物大数据库比对,并将比对后的数据按照病毒、细菌、真菌和寄生虫等进行分类和排列。序列数3条以上者为阳性结果。
1.3 统计学处理应用SPSS 17.0软件进行统计学分析,2种检测方法阳性率比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
BALF传统检测检出烟曲霉1例,白色念珠菌5例,热带念珠菌1例,检测阳性率为30.43%(7/23)。BALF mNGS检出耶氏肺孢子菌4例,耶氏肺孢子菌+白色念珠菌3例,耶氏肺孢子菌+烟曲霉1例,耶氏肺孢子菌+热带念珠菌+白色念珠菌1例,烟曲霉+黄曲霉2例,黑曲霉1例,烟曲霉+热带念珠菌+白色念珠菌1例,白色念珠菌6例,光滑念珠菌1例,新生隐球菌2例,检测阳性率为95.65%(22/23)。另外,9例患者合并细菌感染,1例患者合并结核分枝杆菌感染。mNGS检测的阳性率显著高于传统检测,差异有统计学意义(χ2=20.538,P<0.05);见表1。
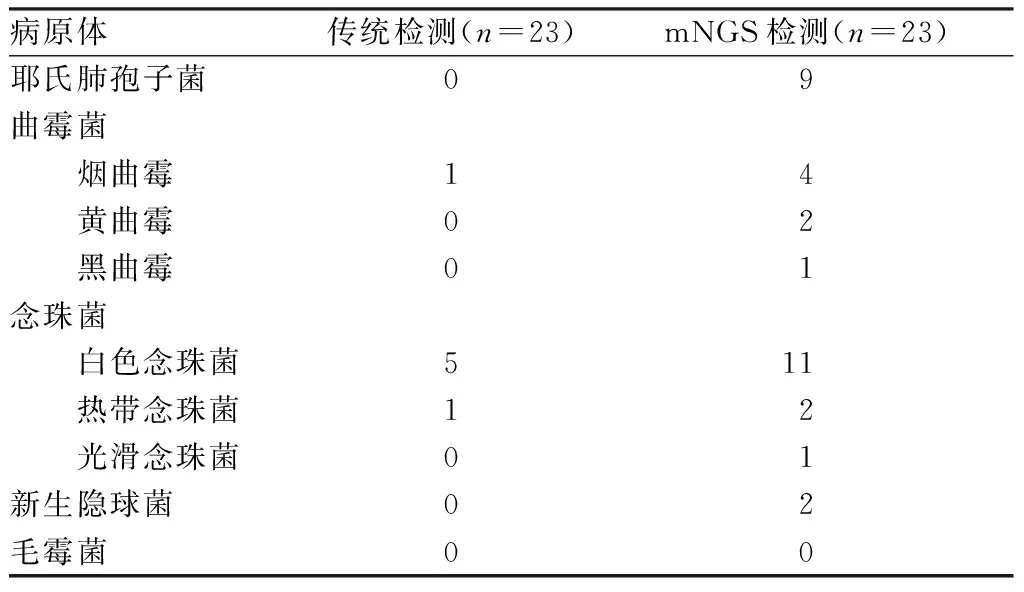
表1 23例侵袭性肺真菌病患者BALF病原学检测结果
3 讨论
IPFD的诊断是临床难点,痰或BALF涂片与培养、G试验和半乳甘露聚(galactomannan,GM)试验是临床常用的手段。痰或BALF培养的阳性率较低且耗时较长,特殊病理染色(六胺银染色、过碘酸-雪夫液染色、革兰染色等)能够提高诊断率[5],但受限于检测人员的诊断水平。G试验诊断IPA、侵袭性念珠菌病、肺孢子菌肺炎的敏感度、特异度、阳性预测值、阴性预测值各不相同,且引起假阳性的影响因素众多[6]。血清GM试验主要用于IPA的诊断,在非粒细胞缺乏患者并发IPA中的诊断敏感度较低,阴性预测值较高,联合BALF GM试验可提高诊断效能[7-8],在马尔尼菲青霉菌病的诊断中也具有较大价值[9]。隐球菌无细胞壁,无法通过G试验检测细胞壁上的1-3-β-D-葡聚糖抗原,常依赖组织病理学或隐球菌夹膜抗原检测[10]。毛霉菌是一种接合菌,细胞壁不含1-3-β-D-葡聚糖,毛霉菌病的诊断主要依赖组织病理学,镜检常见透明宽大菌丝,少隔或无隔,呈直角或不规则分支[11],与曲霉有不同的镜下特征。在现行的诊治策略中G试验与GM试验均不能代替微生物学或组织病理学依据。IPFD常见于免疫力受损患者,就诊时多已存在呼吸功能不全,采用经皮肺穿刺、气管镜活检或开胸肺活检等侵入性方法取组织病理标本的风险往往较大,因此确诊困难。北京协和医院4.5 a诊断的152例IPFD者中仅38例(25%)取得组织病理学证据[12]。因此,临床亟待新的诊断方法。
气管镜肺泡灌洗术与活检相比,操作快、风险低。病原宏基因组学是一种新的不依赖于培养的广泛分析临床样本中微生物组的高通量测序方法[13]。本研究留取BALF进行传统检测与mNGS检测,结果发现,传统检测对念珠菌最敏感,曲霉菌次之,而mNGS对二者均较敏感。耶氏肺孢子菌难以通过培养诊断,常依赖BALF六胺银染色等检验技术[14],虽常规送检BALF六胺银染色,但本组9例耶氏肺孢子菌肺炎均通过mNGS诊断。XIE等[15]报道的7例肾移植术后耶氏肺孢子菌肺炎全部通过BALF或血液 mNGS检测发现其序列确诊,提示该方法在耶氏肺孢子菌肺炎的诊断中较敏感。以往认为耶氏肺孢子菌肺炎常见于艾滋病患者,本组9例中仅1例证实为艾滋病患者,8例为风湿性多肌痛、系统性红斑狼疮、免疫性血小板减少症等长期应用糖皮质激素的患者,提示这类免疫受损患者中耶氏肺孢子菌肺炎发生率并不低,传统检查漏诊率较高。2例肺隐球菌病经mNGS确诊,避免了穿刺活检,亦有文献报道通过相同的方法确诊肺隐球菌病[16]。1例24岁急性淋巴细胞白血病患者合并肺毛霉菌病最终依赖CT引导经皮肺穿刺活检确诊。但由于肺隐球菌病和肺毛霉菌病的发病率低、病例数较少,尚无法评估mNGS对其的诊断价值。
BALF mNGS的应用也受到一些因素的影响。首先是BALF的留取,气管镜检查前清洁患者鼻腔与口腔,气管镜检查时应尽量减少皮肤、鼻腔、上呼吸道菌群的污染,大气道抽吸物弃去或留作他用,气管镜嵌入目标肺段取第2瓶灌洗液送检等[4]。这些细节均可能影响检测结果。由于mNGS能无差别地检测样本中的微生物,要求在实验室检验阶段即能对人体皮肤、口腔或上呼吸道微生态菌群建库比对。另外,结核或某些真菌为胞内菌或有夹膜或细胞壁较厚,核酸提取技术就显得尤为重要[17],不同检验公司的提取技术可能有差别。需要指出的是,因为结核或某些真菌核酸提取难度大,检出较少的序列数也需引起重视。
由于mNGS检测无法区分病原微生物定植与感染,IPED的确诊仍需要结合临床,尤其是白色念珠菌感染的诊断,因为其是上呼吸道或口腔常见的定植菌,需综合考虑患者是否有真菌感染的危险因素(主要是免疫状况)、CT影像特征以及G试验、GM试验等检验结果。肺部恶性肿瘤患者下呼吸道可有曲霉和念珠菌的定植,而其他真菌少有定植[18]。除需要考虑上述因素协诊外,笔者认为也可以通过DNA与RNA检测流程的相互对照、分析检出序列数多少和相对丰度等协助判读。
综上所述,BALF mNGS检测为IPFD的诊断提供了新的快速高效的检验方法,尤其是耶氏肺孢子菌、曲霉和念珠菌肺炎,对肺隐球菌病和毛霉菌病的诊断尚需要大样本研究证实。该方法至少在“临床诊断”要求的“微生物学证据”层面具有高敏感性的优势,但能否完全等同于传统的“微生物学证据”,甚至代替“组织病理学证据”,目前尚无定论。此外,真菌、细菌混合感染或不同种类真菌混合感染比较常见,传统微生物学检查漏诊较多。总之,该技术的应用正在改变临床实践。

