食管鳞状细胞癌组织中牙龈卟啉单胞菌感染和负性共刺激因子B7同源体4表达与患者生存的关系
孙 蔚,孙路易,刘怡文,代宁涛,杨海军,孔金玉,郭艺博,周福有,高社干
(1.河南科技大学第一附属医院分子生物学实验室,河南 洛阳 471003;2.河南科技大学第一附属医院河南省微生态与食管癌防治重点实验室,河南 洛阳 471003;3.河南科技大学第一附属医院河南省肿瘤表观遗传重点实验室,河南 洛阳 471003;4.安阳市肿瘤医院河南省食管癌精准防治医学重点实验室,河南 安阳 455000)
食管癌的发病率及病死率极高,全世界每年新发食管癌患者约50万例,且一半以上发生在中国[1]。食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)是食管癌中最常见的类型,约占食管癌的95%以上。ESCC患者预后极差,虽然传统的手术治疗、放射治疗、化学治疗以及靶向治疗、免疫治疗等手段在肿瘤综合治疗中不断发展,但中晚期ESCC患者的5 a生存率仍低于20%[2-3]。ESCC 的病因至今尚不完全明确,其危险因素主要包括吸烟、饮酒、饮食、慢性感染、免疫功能紊乱及遗传易感性等[4]。
有研究表明,多种病原微生物均可通过长期定植于机体,从而促进肿瘤的发生和发展[5-7]。清除病原微生物有助于控制肿瘤的恶性进展,但病原微生物感染对肿瘤的作用机制目前尚不完全明确。牙龈卟啉单胞菌(Porphyromonasgingivalis,Pg)为口腔条件致病菌,机体中其数量改变可引起微生态失衡。若口腔颌面部静脉瓣膜缺如,则Pg可随血液循环播散至全身,参与多种疾病进程[8-10],且与多种肿瘤的发生和发展密切相关[11-14]。本课题组前期研究发现,Pg在ESCC患者癌组织中检出率显著高于癌旁组织,且与患者临床病理学特征及5 a生存期有显著相关性[12-14]。提示Pg感染和ESCC的发生、发展密切相关,但具体致病机制尚不明确。
有研究发现,多种病原微生物均能通过诱导癌细胞负性共刺激因子高表达而逃避免疫监视,为自身长期定植提供有利条件,从而促进肿瘤恶性进展[14-16]。负性共刺激因子B7同源体4 (B7 homolog 4,B7H4)是新发现的共刺激因子家族成员,可协助肿瘤细胞免疫逃逸,与多种肿瘤恶性进展呈显著正相关[17-25]。因此,推测Pg可能通过诱导癌细胞中B7H4高表达而促进ESCC恶性进展。基于此,本研究旨在探讨ESCC组织中Pg感染和B7H4表达的关系及其对患者生存的影响,以期为ESCC的治疗提供参考。
1 资料与方法
1.1 一般资料选择2014年1月至2014年12月安阳市肿瘤医院收治的ESCC患者为研究对象,并收集手术切除的ESCC组织标本。病例纳入标准:(1)经术后病理学检查确诊为ESCC;(2)均行ESCC切除术。排除标准:(1)术前接受过放射治疗、化学治疗和免疫治疗者;(2)病历资料不完整者。本研究共纳入ESCC患者110例,其中男69例,女41例;<60岁49例,≥60岁61例;有吸烟史55例,无吸烟史55例;有饮酒史53例,无饮酒史57例;组织分化程度:低分化22例,中、高分化88例;肿瘤浸润深度:侵及食管壁外膜75例,未侵及食管壁外膜35例;淋巴结转移:有淋巴结转移53例,无淋巴结转移57例;TNM分期:Ⅰ、Ⅱ期63例,Ⅲ、Ⅳ期47例。本研究经安阳市肿瘤医院伦理委员会审核批准,所有患者签署知情同意书。
1.2 主要试剂与仪器免疫组织化学染色试剂盒(过氧化物酶阻断剂、山羊血清、山羊抗鼠/兔聚合物及链霉菌抗生物素蛋白标记的过氧化物酶)购自北京中杉金桥生物技术有限公司,Pg兔多克隆抗体购自美国路易斯维尔大学口腔医学院,B7H4兔多克隆抗体购自美国Abcam公司,柠檬酸抗原修复液、磷酸盐缓冲液(phosphate buffered solation,PBS)、吐温-20 Tris缓冲生理盐水(Tris-buffered saline and tween-20,TBST)、二氨基联苯胺(diamino-benzidine,DAB)显色剂购自北京索莱宝生物技术有限公司;光学显微镜购自日本尼康公司。
1.3 免疫组织化学染色法检测ESCC组织中Pg感染及B7H4表达情况将110份ESCC组织标本常规石蜡包埋,切片(厚3~4 μm);60 ℃溶蜡 1.5 h 后立即放入二甲苯脱蜡3次,每次10 min,梯度乙醇(体积分数100%、95%、90%、85%)依次水化5 min,流水冲洗1 min;94~98 ℃下柠檬酸盐缓冲液抗原修复15 min,充分暴露抗原,PBS冲洗;过氧化物酶阻断剂封闭10 min,PBS冲洗;滴加正常山羊血清室温避光封闭30 min;取2张连续切片,分别加入Pg和B7H4兔多克隆抗体(滴度1200)50 μL,4 ℃孵育过夜,次日复温1 h,PBS冲洗;滴加山羊抗鼠和兔聚合物室温下孵育30 min,PBS冲洗;滴加链霉菌抗生物素蛋白标记的过氧化物酶室温下封闭15 min,PBS冲洗,DAB显色。显微镜下观察显色适当时,立即用蒸馏水终止显色;苏木精复染,梯度乙醇(体积分数85%、90%、95%、100%)依次脱水1 min,二甲苯透明,风干后中性树胶封片。
光学显微镜下每个样本随机挑选5个视野,观察ESCC组织中Pg感染和B7H4表达情况,以染色强度评分和阳性细胞百分比评分的乘积作为免疫组织化学染色评分结果,以5个高倍镜视野评分的均值为最终免疫组织化学染色评分。染色强度评分标准:未着色0分,浅黄色1分,棕黄色2分,棕褐色3分。以癌细胞及间质细胞的细胞质出现浅黄色、棕黄色或棕褐色颗粒为Pg感染阳性,以癌细胞的细胞膜出现浅黄色、棕黄色或棕褐色颗粒为B7H4表达阳性。阳性细胞百分比评分标准:阳性细胞百分比≤5%为0分, 5%<阳性细胞百分比≤25%为1分, 25%<阳性细胞百分比≤75%为2分,阳性细胞百分比>75%为3分。Pg阳性判定标准为免疫组织化学染色评分≥2分[13];B7H4阳性判定标准为免疫组织化学染色评分≥2分[14]。
1.4 随访通过电话联系进行随访,每3个月电话随访1次患者及家属,随访时间为确诊入院至患者死亡的时间或60个月。
1.5 统计学处理应用SPSS 25.0软件进行数据统计与分析。计数资料以例数和百分率表示,2组间生存率比较采用χ2检验;2组间生存时间比较采用Log-rank检验;采用Cohen′s kappa系数分析进行Pg感染与B7H4表达一致性检验,Kappa>0.7表示一致性显著,Kappa0.4~0.7表示一致性较好,Kappa<0.4表示一致性较差;采用Kaplan-Meier法分析Pg感染及B7H4阳性表达与ESCC患者预后的关系,患者生存时间为入院时间至最后一次随访日期或死亡;采用单因素和多因素Cox回归分析Pg感染、B7H4表达及临床病理特征对生存的影响;P<0.05为差异有统计学意义。
2 结果
2.1 ESCC组织中Pg感染和B7H4表达情况结果见图1。在ESCC组织中,Pg感染主要分布于癌细胞的细胞质,B7H4主要表达于癌细胞的细胞膜。110例ESCC患者癌组织标本中,Pg感染阳性且B7H4表达阳性33例(Pg+B7H4阳性组),Pg感染和B7H4表达不满足同时阳性77例(Pg+B7H4阴性组)。

图1 ESCC组织中Pg感染及B7H4表达(免疫组织化学染色,×400)
2.2 ESCC组织中Pg感染与B7H4阳性表达的一致性结果见表1。Cohen′s Kappa系数分析结果显示,ESCC组织中Pg感染与B7H4阳性表达具有显著一致性(Kappa=0.710,P<0.05)。

表1 ESCC组织中Pg感染与B7H4阳性表达的一致性
2.3 Pg感染及B7H4阳性表达与ESCC患者一般临床特征的关系结果见表2。ESCC患者Pg感染及B7H4阳性表达与患者性别、吸烟、饮酒及肿瘤分化程度、浸润深度、淋巴结转移、TNM分期显著相关(P<0.05),与患者的年龄无显著相关性(P>0.05)。
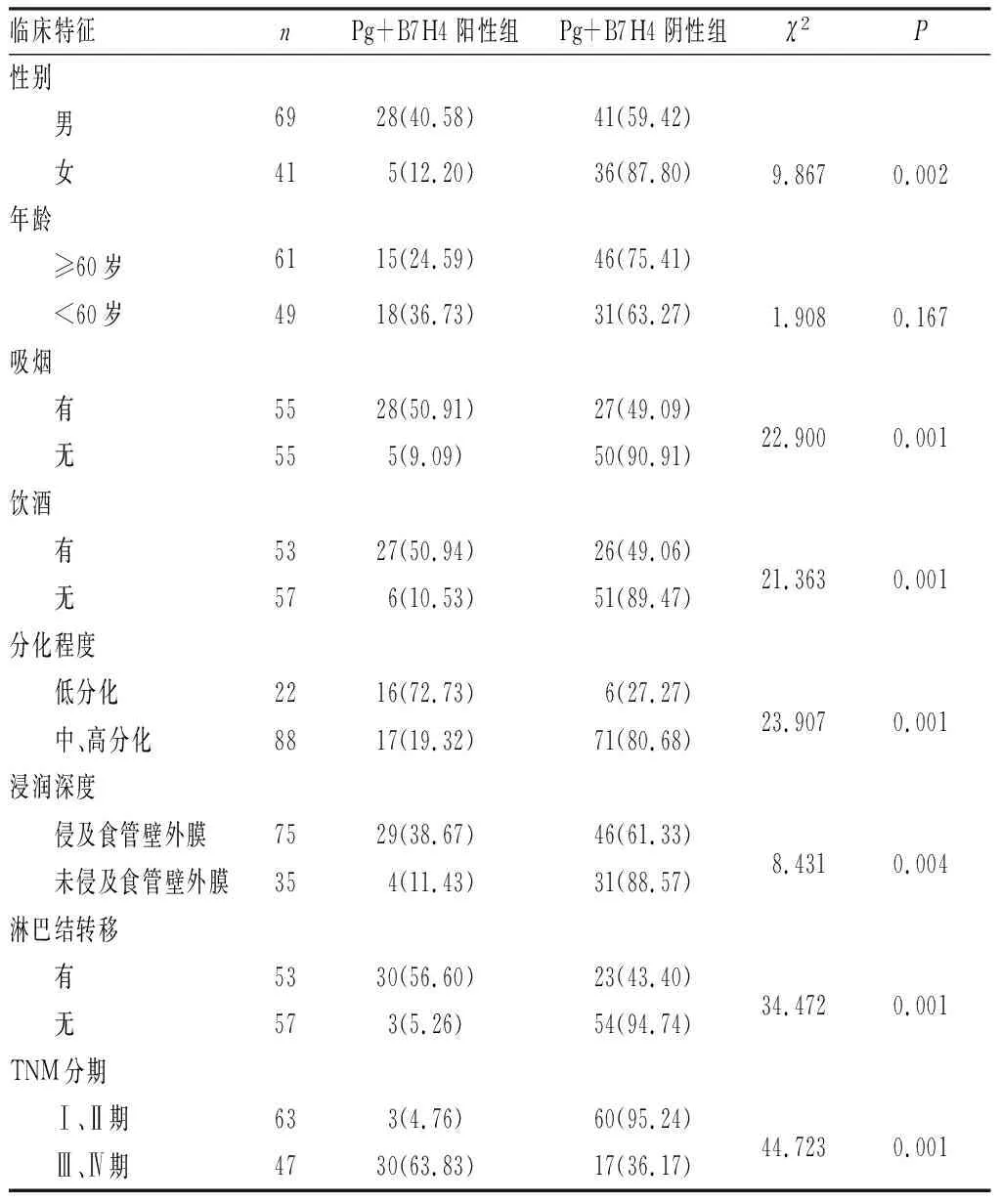
表2 Pg感染及B7H4表达与ESCC患者一般临床特征的相关性
2.4 Pg感染及B7H4表达与ESCC患者预后的关系结果见图2。Kaplan-Meier分析结果显示,110例ESCC患者术后5 a生存率为26.36%,中位生存期为(32.000±3.630)个月(95%置信区间:24.884~39.116);Pg+B7H4阳性组ESCC患者5 a生存率为12.12%,中位生存期为(19.000±5.742)个月(95%置信区间:7.746~30.254);Pg+B7H4阴性组ESCC患者5 a生存率为32.46%,中位生存期为(38.000±5.265)个月(95%置信区间:27.682~48.318);Pg+B7H4阳性组ESCC患者5 a生存率及5 a中位生存期显著低于Pg+B7H4阴性组,差异有统计学意义(χ2=4.926、9.283,P<0.05)。

A:ESCC患者术后5 a 生存曲线;B:Pg+B7H4阳性组与阴性组ESCC患者术后5 a 生存曲线。
2.5 ESCC患者生存影响因素的单因素Cox回归分析结果见表3。110例ESCC患者成功完成术后随访,以ESCC组织中Pg感染且B7H4表达阳性、性别、年龄、吸烟 、饮酒、分化程度及肿瘤浸润深度、淋巴结转移、TNM分期为自变量,以ESCC患者5 a生存结局为因变量进行单因素Cox回归分析,结果显示,性别、吸烟、饮酒及肿瘤分化程度、浸润深度、淋巴结转移、TNM分期、Pg感染且B7H4表达阳性与ESCC患者生存有关(P<0.05)。

表3 ESCC患者生存影响因素的单因素Cox回归分析
2.6 ESCC患者生存影响因素的多因素Cox回归分析结果见表4。将单因素Cox回归分析中差异有统计学意义的因素进一步行多因素Cox回归分析,结果显示,肿瘤分化程度、Pg感染且B7H4表达阳性是影响ESCC患者生存的独立危险因素(P<0.05)。

表4 ESCC患者生存影响因素的多因素Cox回归分析
3 讨论
ESCC发病率及病死率较高,且早期诊断困难,预后极差。因此,寻找精准的早期诊断指标、有效的预防措施及靶向治疗方法尤为重要。长期以来,肿瘤相关研究中有关病原微生物慢性感染的探讨较少,而实际上,多种病原微生物均可通过重塑宿主免疫微环境,在肿瘤细胞中长期定植,从而导致肿瘤免疫逃逸并促进其恶性进展[20-25]。Pg作为毒力最强的口腔致病菌之一,其所释放的内毒素能抑制机体免疫应答,从而有利于其长期定植于机体,促进口腔鳞状细胞癌、鼻咽癌、ESCC及肺癌等多种肿瘤的恶性进展[11-14]。
病原微生物对肿瘤免疫微环境的重塑机制至今尚未完全明确,多数研究认为,病原微生物可通过诱导肿瘤细胞高表达负性共刺激因子,使机体抗肿瘤免疫功能降低甚至丧失[20-25]。幽门螺杆菌、人乳头瘤病毒、乙型肝炎病毒、人类免疫缺陷病毒及Epstein-Barr 病毒均可通过诱导肿瘤细胞B7H4高表达,协助肿瘤细胞逃避免疫监视,从而有利于病原体定植于机体[20-25]。肿瘤细胞中B7H4的高表达与肿瘤恶性进展密切相关。有研究发现,癌细胞高表达B7H4的胰腺癌、胃癌及肺癌患者,其生存率及中位生存时间显著低于癌细胞低表达B7H4的患者[17-19];癌细胞高表达B7H4的宫颈癌与肝癌患者的转移复发率显著高于癌细胞低表达B7H4的患者[20-23];癌细胞高表达B7H4的淋巴瘤患者,癌细胞增殖、侵袭能力显著高于癌细胞低表达B7H4的患者[24]。
本研究中Cohen′s kappa系数分析结果显示,ESCC组织中Pg感染与B7H4阳性表达具有显著一致性,提示Pg感染可能诱导ESCC细胞高表达B7H4蛋白。本课题组前期研究发现,ESCC细胞感染Pg后,随着感染时间的延长,细胞中B7H4蛋白表达水平呈升高趋势[14],与本研究结果一致。
本研究结果显示,ESCC患者Pg感染及B7H4阳性表达与患者性别、吸烟、饮酒及肿瘤分化程度、浸润深度、淋巴结转移、TNM分期显著相关,与患者的年龄无显著相关性;此外,单因素Cox回归分析结果显示,性别、吸烟、饮酒及肿瘤分化程度、浸润深度、淋巴结转移、TNM分期及Pg感染且B7H4表达阳性与ESCC患者生存有关;原因可能为长期吸烟、饮酒易导致口腔环境恶劣,使Pg更容易感染并定植,并诱导癌细胞高表达B7H4;中、高分化程度(恶性程度高)的ESCC组织及其微环境更利于Pg生存及高表达B7H4;Pg感染及其对B7H4的诱导效应可能促进了ESCC的恶性进展。
本研究中Kaplan-Meier分析结果显示,Pg+B7H4阳性组ESCC患者的5 a生存率及5 a中位生存期显著低于Pg+B7H4阴性组;此外,本研究中多因素Cox回归分析结果显示,肿瘤分化程度、Pg感染且B7H4表达阳性是影响ESCC患者生存的独立危险因素,说明Pg感染且B7H4阳性表达及高分化程度均不利于ESCC患者生存,原因可能为ESCC高分化程度有利于Pg在癌组织中生存,且Pg可通过诱导癌细胞高表达B7H4抑制机体免疫反应,促使癌细胞免疫逃逸,进一步恶化病情,从而缩短患者生存期。
因为肿瘤的发生、发展是一个多因素、多步骤的演变过程,所以,Pg的具体致病机制有待进一步探讨,有效清除Pg并抑制癌细胞B7H4表达可能会延缓ESCC恶性进展并延长ESCC患者的生存期,在ESCC 的临床治疗方面具有重要的理论意义和广泛的应用前景。
综上所述, ESCC组织中Pg感染与B7H4阳性表达具有显著一致性,Pg感染且B7H4表达阳性可促进ESCC的恶性进展且不利于ESCC患者生存。

