淀粉样前体蛋白/早老素1转基因小鼠脑皮质中过氧化物酶体增殖剂激活受体α的表达及意义
张李娟,赵舒祥,王若溪,卜勇军,杨 磊,原志庆,李文强,石如玲,
(1.新乡医学院公共卫生学院,河南 新乡 453003;2.新乡医学院护理学院,河南 新乡 453003;3.新乡医学院基础医学院,河南 新乡 453003;4.河南省生物精神病学重点实验室,河南 新乡 453002)
阿尔茨海默病(Alzheimer′s disease,AD)是以进行性认知障碍为特征的神经退行性疾病,β-淀粉样蛋白(β-amyloid,Aβ)在大脑沉积形成老年斑是AD的主要病理特征之一[1]。过氧化物酶体增殖剂激活受体α(peroxisome proliferators activated receptors α,PPARα)是一种核转录因子,参与脂质代谢、能量平衡、氧化应激、炎症反应及神经递质释放等多种生物过程的调控[2-3]。有研究发现,AD患者脑组织内PPARα水平呈低表达,PPARα调控淀粉样前体蛋白(amyloid precursor protein,APP)的裂解过程,减少Aβ生成[4-6]。APP/早老素1(presenilin 1,PS1)转基因小鼠是常见的AD动物模型之一,携带人类突变APP Swedish(K595N/M596L)和PS1 deltaE9基因,能较好地模拟AD病理特征和大脑认知功能状态,如出现Aβ沉积形成的老年斑、学习记忆功能障碍等[7-8]。但目前针对APP/PS1转基因小鼠体内PPARα表达及相关代谢特征的研究较少。基于此,本研究以5月龄APP/PS1转基因小鼠和野生型小鼠为研究对象,观察其行为学、脑组织形态学及PPARα表达和相关生物化学代谢指标的变化,探讨PPARα在AD发病机制中的作用,以期为APP/PS1转基因小鼠作为AD模型提供更多分子水平依据。
1 材料与方法
1.1 实验动物5月龄雄性APP/PS1双转基因C57BL/6J-TgN(APP/PS1)ZLFILAS小鼠(实验组)及同遗传背景同月龄雄性C57BL/6J野生型小鼠(对照组)各10只,体质量21~24 g,购自北京华阜康生物科技股份有限公司[SCXX(京)2014-0004]。饲养环境温度(23±2)℃,湿度50%~60%,昼夜12 h/12 h,自由摄食饮水,适应饲养1周后进行实验。
1.2 主要试剂与仪器总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)检测试剂盒购自南京建成生物工程研究所,Aβ抗体购自美国CST公司,APP抗体购自美国Sigma公司,PPARα、肉碱脂酰转移酶1(carnitine acyltransferase 1,CPT1)及甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体购自美国Santa Cruz公司,脂酰辅酶A氧化酶1(acyl CoA oxidase 1,ACOX1)抗体购自英国Abcam公司,β-actin抗体购自上海齐合生物技术有限公司,山羊抗兔及山羊抗小鼠过氧化物酶标记二抗购自杭州贤至生物科技有限公司,二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒购自丹麦DAKO公司;EthoVision XT 8型Morris水迷宫跟踪成像系统购自德国Noldus公司,电泳及转膜系统购自美国Bio-Rad公司,Amersham Imager 600化学发光成像系统购自美国GE公司。
1.3 实验方法
1.3.1 动物处理及取材2组小鼠适应饲养后,应用Morris水迷宫测定小鼠空间学习记忆能力。Morris 水迷宫实验后,2组小鼠分别取3只,禁食12 h,质量分数1%戊巴比妥钠(40 mg·kg-1)腹腔注射麻醉,40 g·L-1多聚甲醛全身灌流固定,断头取脑,用于脑组织中Aβ免疫组织化学染色。其余7只小鼠取股动脉血1 mL,3 000 r·min-1离心10 min,分离血清,置于-20 ℃冰箱保存,用于血清TC、TG测定;然后断头处死小鼠,分离大脑皮质、肝组织,置于液氮中,于-80 ℃冰箱中保存备用。
1.3.2 Morris水迷宫实验测试2组小鼠空间学习记忆能力2组小鼠于适应饲养后行Morris水迷宫实验,持续 5 d,包括定位航行和空间探索2个阶段。定位航行实验:水下平台置于第3象限(目标象限)固定位置不变,每只小鼠分别从4个象限中央作为入水点,将小鼠面向池壁放入水中,当小鼠爬上平台并在平台上逗留5 s,记录小鼠找到平台所需的时间,即为逃避潜伏期,每天训练4次,每次间隔20 min,持续4 d。空间探索实验:第5天进行空间探索实验,移除平台,将小鼠从第1象限放入水中,记录90 s内小鼠在目标象限游动的时间。
1.3.3 免疫组织化学染色法检测2组小鼠脑组织中Aβ沉积将多聚甲醛固定的脑组织进行常规脱水、石蜡包埋,连续切片(厚度4.0 μm),二甲苯脱蜡,梯度乙醇水化,用柠檬酸缓冲液(pH 6.0)进行抗原修复;滴加Aβ一抗(滴度1500),4 ℃孵育过夜;滴加辣根过氧化物酶标记二抗(滴度11 000),室温孵育50 min;DAB显色,Aβ阳性呈棕褐色。显微镜下观察并用Case Viewer软件扫描染色情况,观察脑皮质和海马组织中Aβ阳性斑块。
1.3.4 Western blot法检测2组小鼠脑皮质、肝组织中PPARα、APP、ACOX1及CPT1蛋白表达取 30 mg 脑皮质或肝组织,加入300 μL裂解液裂解组织,冰浴匀浆,4 ℃、12 000 r·min-1离心15 min,取上清液,测定蛋白浓度。用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白质,取20 μg蛋白,4 ℃条件下转膜,将膜置于质量分数5%脱脂奶粉中封闭后,分别加入PPARα一抗(滴度1500)、APP一抗(滴度11 000)、ACOX1一抗(滴度1500)、CPT1一抗(滴度1500),4 ℃缓慢摇动孵育14 h;然后滴加辣根过氧化物酶标记二抗(滴度14 000),室温孵育2 h。将电化学发光液均匀加在膜的正面,应用Amersham Imager 600成像分析仪采集图像,Image J软件测定目的蛋白与内参蛋白的灰度值,以目的蛋白与内参蛋白灰度比值表示目的蛋白的相对表达量。
1.3.5 2组小鼠血清中TG、TC水平测定采用甘油磷酸氧化酶法测定2组小鼠血清TG水平,胆固醇氧化酶法测定血清TC水平,严格按照试剂盒说明书进行操作。

2 结果
2.1 2组小鼠空间学习记忆能力比较结果见表1。2组小鼠逃避潜伏期随训练时间增加均逐渐缩短;实验组小鼠不同时间点逃避潜伏期短于对照组,但2组间比较差异无统计学意义(P>0.05)。实验组小鼠在目标象限游动时间短于对照组,但2组间比较差异无统计学意义(P>0.05)。

表1 2组小鼠的逃避潜伏期和在目标象限游动时间比较
2.2 2组小鼠脑组织中Aβ沉积情况比较结果见图1。对照组小鼠脑组织中未见到Aβ阳性斑块,实验组小鼠脑皮质和海马区有大量大小不等的Aβ阳性斑块。
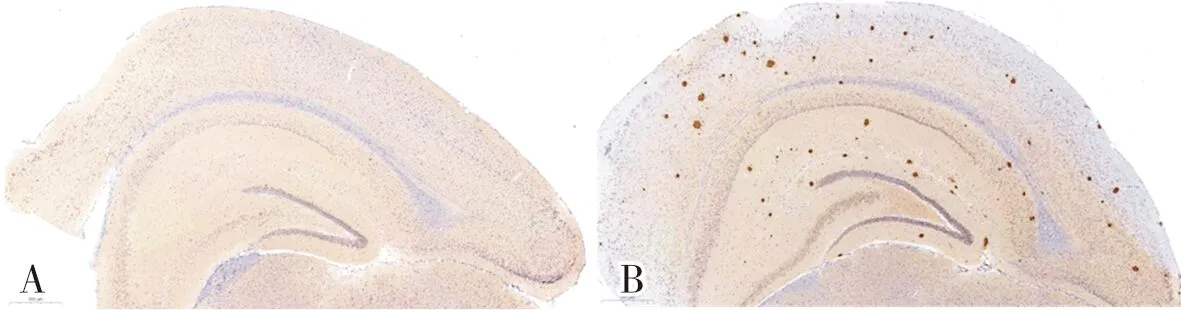
A:对照组;B:实验组。
2.3 2组小鼠脑皮质中PPARα、APP蛋白相对表达量比较结果见图2和表2。实验组小鼠脑皮质中PPARα蛋白相对表达量显著低于对照组,APP蛋白相对表达量显著高于对照组,差异有统计学意义(P<0.05)。
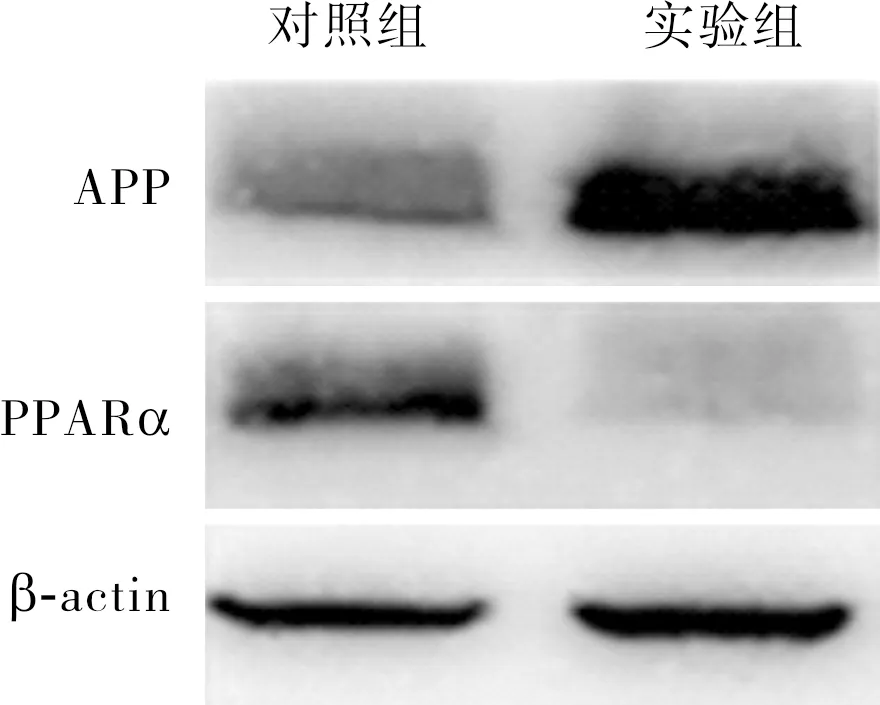
图2 2组小鼠脑皮质中PPARα、APP蛋白表达

表2 2组小鼠脑皮质中PPARα、APP蛋白相对表达量比较
2.4 2组小鼠肝组织中PPARα、ACOX1、CPT1蛋白相对表达量比较结果见图3和表3。实验组小鼠肝组织中PPARα、ACOX1、CPT1蛋白相对表达量显著高于对照组,差异有统计学意义(P<0.05)。

图3 2组小鼠肝组织中PPARα、ACOX1和CPT1蛋白表达

表3 2组小鼠肝组织中PPARα、ACOX1和CPT1蛋白相对表达量比较
2.5 2组小鼠血清中TG、TC水平比较结果见表4。实验组小鼠血清TG水平显著高于对照组,差异有统计学意义(P<0.05);实验组与对照组小鼠血清TC水平比较差异无统计学意义(P>0.05)。

表4 2组小鼠血清中TG、TC水平比较
3 讨论
AD是老年痴呆最常见的类型,是老年人失能和死亡的主要原因,但AD的发病机制并未明晰。研究显示,AD发病与遗传因素、脂质代谢、氧化应激、炎症反应等多种因素有关,这些致病因素可引起Aβ代谢异常,导致Aβ水平过高,进而引起老年斑沉积等病理改变及大脑功能障碍[1]。目前,AD在临床上尚无有效防治措施,进一步深入探索AD发病机制和潜在的治疗靶点对有效预防和治疗该病有重要意义。
APP/PS1转基因小鼠广泛应用于AD发病机制研究,文献报道,APP/PS1小鼠3月龄时出现认知行为学变化,5月龄时脑内存在淀粉样斑块沉积[9]。本研究结果显示,5月龄APP/PS1转基因小鼠脑内淀粉样斑块显著增多,提示5月龄APP/PS1转基因小鼠可较好地模拟出AD特征性病理变化。此外,本研究中Morris水迷宫实验结果显示,实验组小鼠逃避潜伏期略长于对照组,而且在目标象限游动时间较短,但2组比较差异无统计学意义;这说明5月龄APP/PS1转基因小鼠空间学习记忆能力仅有轻微降低,认知功能损害较轻微。因此,认为5月龄APP/PS1转基因组小鼠已经出现特征性病理改变及轻微认知功能损伤。
PPARα属于配体激活转录因子,广泛表达于全身多种组织。一些配体激活PPARα后可通过降低神经炎症、增强抗氧化防御、减少Aβ合成、促进Aβ降解等多种机制发挥神经保护作用[2-3,10-11]。研究显示,AD患者脑内PPARα mRNA水平降低[12-13]。还有研究显示,PPARα基因敲除小鼠脑组织中Aβ生成增多,且小鼠的认知功能下降[5,14]。因此,推测PPARα有望成为治疗AD或其他神经退行性疾病的潜在靶点。另有研究显示,PPARα表达水平与APP有关,APP是一种跨膜糖蛋白,除作为Aβ前体蛋白经淀粉样裂解产生Aβ外,APP还具有多种生理功能。在APP基因拷贝数增多的早发性AD患者脑内PPARα表达降低,且PPARα与APP表达水平呈负相关,小鼠或原代培养的神经细胞过表达人源APP基因后也会引起PPARα表达下降[15],提示APP可能参与了PPARα表达的调控。本研究结果显示,实验组小鼠脑皮质中PPARα蛋白相对表达量显著低于对照组,APP蛋白相对表达量显著高于对照组,因此,推测APP/PS1转基因小鼠脑内PPARα表达降低的原因可能与APP基因水平升高有关。有研究显示,PPARα通过上调α分泌酶表达促进APP非淀粉样途径,减少Aβ生成;而PPARα基因敲除小鼠脑内α分泌酶表达减少、Aβ生成增多[5]。因此,推测APP/PS1转基因小鼠脑组织中Aβ沉积增多的机制除与APP增多有关外,还可能与PPARα表达降低有关。
PPARα在调节脂肪酸分解代谢中具有重要作用,线粒体脂肪酸β-氧化关键酶CPT1和过氧化物酶体β-氧化关键酶ACOX1均受PPARα调控,PPARα激活后上调CPT1和ACOX1的表达[16-17]。另有研究报道,脂质紊乱、高胆固醇和高TG水平可增加AD发病风险[18-19]。曾槟[20]研究报道,8月龄APP/PS1小鼠血清TG、TC水平显著升高。本研究结果显示,与对照组小鼠比较,5月龄APP/PS1转基因小鼠血清TG水平显著升高,且其肝脏组织中PPARα及其靶基因CPT1和ACOX1蛋白水平显著升高。这说明,5月龄APP/PS1转基因小鼠存在血脂升高、肝脏脂肪酸分解代谢加强等脂质代谢紊乱,但目前尚不清楚APP/PS1转基因小鼠血清TG水平升高的原因,其肝脏组织中PPARα、ACOX1和 CPT1等表达升高是否与血清TG升高存在内在因果关系尚不能确定。同时本实验中小鼠肝脏和脑皮质中PPARα表达变化并不一致,其在肝组织中表达增多而在脑皮质中表达却降低,引起这一差异的机制有待进一步研究。
总之,5月龄APP/PS1转基因小鼠存在系统性代谢紊乱,但小鼠的空间学习记忆能力降低并不明显,表明APP/PS1转基因小鼠的代谢紊乱可能先于行为学损伤;另外,APP/PS1转基因小鼠脑皮质中PPARα表达降低、肝组织中PPARα及其靶基因CPT1和ACOX1蛋白表达升高,表明PPARα在AD发病机制中具有重要作用;基于此,PPARα及其靶基因有望成为AD早期诊断的潜在靶点。但关于APP/PS1转基因小鼠肝组织和脑皮质中PPARα表达变化并不一致的原因及代谢紊乱与其基因型之间的内在联系尚有待进一步研究。

