肠道菌群代谢产物琥珀酸对非酒精性脂肪性肝病小鼠的影响
喻江南,宋铃榆,杨红,冉苏叶,刘琦
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)是一种最常见的慢性肝病,包括从单纯脂肪变性到非酒精性脂肪性肝炎,再到晚期肝纤维化、肝硬化,最终发展为肝细胞癌,是减少肝脏相关并发症和降低病死率的关键[1]。研究发现,肠道微生物群可以通过肝—肠轴影响代谢性疾病,包括影响能量代谢、内毒素血症、胆汁酸代谢、胆碱代谢、产生内源性乙醇等,从而影响NAFLD的发生、发展[2-3]。但大多数研究主要聚焦于肠道细菌发酵产生的短链脂肪酸(SCFAs)的作用[4]。很少有研究分析其他有机酸(如琥珀酸或乳酸)的作用。琥珀酸是宿主和微生物的重要代谢物,通常被视为宿主细胞内三羧酸循环的中间代谢产物,在细菌发酵、某些炎性反应和代谢异常时,也会大量积累[5]。其主要由拟杆菌门代谢产生,而拟杆菌门的升高是非酒精性脂肪性肝炎患者肠道菌群主要变化趋势之一[6]。然而针对肠道菌群代谢产物琥珀酸对NAFLD的影响作用,研究甚少。因此本研究拟建立NAFLD小鼠模型,初步探索肠道菌群代谢产物琥珀酸在NAFLD小鼠中的影响作用,报道如下。
1 材料与方法
1.1 材料 (1)动物:C57BL/6雄性无菌小鼠40只[购自湖南省长沙市天勤生物技术有限公司,动物合格证号:430726210100336626,许可证号:SCXK(湘)2019-0014],周龄5周,体质量15~17 g。小鼠饲养于贵州医科大学动物实验中心,温度25℃左右,自动光控(12 h/12 h昼夜交替),小鼠自由饮水。动物实验流程经贵州医科大学动物实验伦理审查批准(200639)。(2)药物与试剂:琥珀酸(上海阿拉丁生化科技股份有限公司);60%高脂饲料(江苏省协同医药生物工程有限责任公司);4%多聚甲醛、三酰甘油检测盒、总胆固醇检测盒、苏木素—伊红(HE)染色剂、油红O染色检测盒(均购自南京建成科技有限公司)。(3)仪器设备:正置白光拍照显微镜(Ci-E,Nikon公司);高速台式低温离心机(Thermo公司);多功能酶标仪(Molecular Devices公司);鱼跃血糖仪(型号305A,江苏鱼跃医疗设备股份有限公司);电子天平(昆山利平剂量设备有限公司)。
1.2 实验方法 2021年9月—2022年3月于贵州医科大学实验室进行实验。随机数字表法将小鼠40只分为正常饮食组(ND组)、正常饮食+琥珀酸处理组(ND+Suc组)、高脂饮食组(HFD组)、高脂饮食+琥珀酸处理组(HFD+Suc组),每组10只,适应性喂养1周,从第2周开始,ND组和ND+Suc组采用正常饮食喂养小鼠,HFD组和HFD+Suc组采用高脂(含有60%脂肪)饲料喂养小鼠建立NAFLD模型,ND+Suc组和HFD+Suc组饮水中混入2.5%琥珀酸[7],ND组和HFD组采用纯净水喂养,各组小鼠均自由饮水。均喂养15周。
1.3 观察指标与方法
1.3.1 小鼠体质量检测:使用电子天平每周监测小鼠体质量,至实验结束。
1.3.2 血糖测定:采用口服葡萄糖耐量试验(oral glucose tolerance test,OGTT),小鼠禁食不禁水12 h,予蒸馏水配制20%D-葡萄糖0.01 ml/g,予小鼠灌胃针灌胃,分别在0、15、30、60、120 min,经小鼠尾静脉取血并弃去第一滴血,电子血糖仪检测第二滴血血糖值。
1.3.3 血清三酰甘油(TG)、总胆固醇(TC)测定: 经小鼠眼球取血后,离心取血清40~80 μl,采用酶联免疫吸附法测定TG、TC水平,按检测盒说明书进行。
1.3.4 肝组织脂质检测:颈椎脱臼法处死小鼠,剪开腹腔暴露视野并取出完整肝脏,观察肝脏颜色、形态,取一完整肝叶予4%多聚甲醛固定,石蜡包埋,切片厚4 μm,置于独立的玻璃切片上;HE染色10 min,后予蒸馏水冲洗10 min去除多余染液,乙醇脱水,二甲苯使切片透明,中性树胶封片处理,显微镜下观察肝细胞病理形态及肝脏脂肪变性情况。油红O染色:配置油红O试剂,并用0.22 μm过滤器过滤,将预先制作好并保存于-20℃的冰冻切片回温5~10 min待染,按油红O染色试剂盒说明书进行,以贮备液∶稀释液=5∶2,配置油红O试剂,滴于切片上并浸没组织染色15 min,蒸馏水水洗15 s,封固剂固定、封片,并于显微镜下观察肝组织脂质沉积情况。
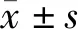
2 结 果
2.1 实验前后4组小鼠体质量变化 实验前ND组、ND+Suc组、HFD组、HFD+Suc组小鼠体质量比较差异无统计学意义(P>0.05)。第15周,ND+Suc组小鼠体质量与ND组差异无统计学意义(P>0.05),HFD组较ND组体质量明显增高(P<0.01),HFD+Suc组较HFD组体质量下降,但仍高于ND+Suc组(P均<0.05),见表1。
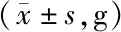
表1 实验前后4组小鼠体质量比较Tab.1 Comparison of body weight of mice in four groups before and after the experiment
2.2 4组小鼠葡萄糖耐量变化比较 喂养15周后,与ND组比较,ND+Suc组血糖各时点(0、15、30、60、120 min)变化差异无统计学意义(P>0.05);与ND组比较,HFD组OGTT 0、15、30、60、120 min血糖水平均显著增高(t/P=7.346/<0.001、6.393/<0.001、4.621/0.002、8.900/<0.001、7.895/<0.001);HFD+Suc组各时点血糖较HFD组降低(t/P=4.457/0.003、4.812/0.001、3.006/0.008、4.598/0.002、2.939/0.009),但仍高于ND+Suc组,差异均有统计学意义(t/P=4.815/0.001、3.323/0.004、3.086/0.006、6.091/<0.001、7.186/<0.001)。见表2。
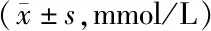
表2 4组小鼠OGTT不同时点血糖水平比较Tab.2 Comparison of blood glucose levels at different time points of OGTT in 4 groups of mice
2.3 4组小鼠血清TG、TC水平比较 ND组血清TG、TC浓度与ND+Suc组比较,差异无统计学意义(P>0.05);HFD组血清TG、TC较ND组小鼠显著增高(P<0.01);HFD+Suc组血清TG、TC水平低于HFD组,但仍高于ND+Suc组,差异均有统计学意义(P<0.05)。见表3。
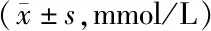
表3 4组小鼠血清TG、TC水平比较Tab.3 Comparison of serum TG and TC levels of mice in four groups
2.4 4组小鼠肝组织脂质比较 光镜下显示,ND组、ND+Suc组小鼠肝脏组织中肝细胞排列整齐,细胞核大而圆,无挤压变形,细胞质未见明显脂肪空泡样变性,小叶结构清晰可见。HFD组小鼠可见肝细胞弥漫分布脂肪沉积,以大小泡混合性肝细胞脂肪变性为主,部分细胞核被挤压变形甚至消失,肝细胞排列紊乱,未见明显炎细胞浸润。HFD+Suc组可见散在分布小空泡样肝细胞脂肪变性,较HFD组明显减轻。油红O染色切片示脂肪滴呈红色,细胞核为淡蓝色,HFD组可见大小不等的红色脂滴弥漫性分布,HFD+Suc组可见红色脂滴散在分布,程度较HFD组小鼠明显减轻,此外,在ND组和ND+Suc组小鼠中未观察到明显脂质沉积,与HE染色的脂肪变性结果一致。见图1。
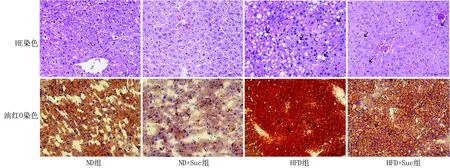
图1 各组小鼠肝脏脂质比较(×200)Fig.1 Comparison of liver lipids of mice in each group (×200)
3 讨 论
NAFLD与内脏脂肪增多和代谢异常密切相关,其中2型糖尿病、肥胖、高脂血症、高血压会显著增加肝硬化和相关并发症的风险[8]。研究证实,益生菌制剂可通过调节肠道菌群改善代谢性疾病进而改善NAFLD[9],然而其机制尚不清楚。血脂代谢异常是NAFLD的主要危险因素。脂肪摄取和生成超过脂肪氧化和输出,导致脂质在肝脏过度沉积,形成脂肪肝,甚至通过氧化应激进一步促进肝细胞损伤和疾病进展[10]。相关研究报道调节肠道菌群可有效改善宿主能量吸收及营养代谢,通过调节肠道菌群控制体质量较其他减肥类药物不良反应更小,更能适应宿主自身微环境[11]。有效控制肥胖是治疗NAFLD的关键所在,通过肠道菌群改善肥胖症状对NAFLD潜在治疗作用还需要更深入研究。其他继发性因素如内分泌紊乱也在NAFLD的发生发展中起关键作用[12]。多项研究证实,NAFLD与2型糖尿病密切相关,其机制主要通过胰岛素抵抗和代偿性高胰岛素血症,导致NAFLD中脂质代谢缺陷和肝脏三酰甘油积累或β细胞功能障碍。与非糖尿病患者比较,T2DM 患者患NAFLD的风险更高,而且患晚期肝病(如肝纤维化、肝硬化和肝细胞癌)的风险也更高[13]。所以有效控制代谢性疾病从而有效管理NAFLD成为研究的重中之重。
越来越多研究表明,NAFLD的高发病率与肠道微生物群密切相关,Chiu 等[14]将非酒精性脂肪性肝炎患者的粪便接种于无菌小鼠肠道,并予高脂饮食喂养,发现非酒精性脂肪性肝炎小鼠肠道菌群加重了肝脏脂肪变性和炎性改变。进一步证实NAFLD的进展与肠道微生物群的不同组成密切相关。Kim 等[15]发现通过调节肠道菌群可以有效调节肠道基因表达,改善血脂水平、肥胖症状,降低肝脏脂肪变性及细胞炎性反应。Zhou等[16]证实,通过粪便微生物群移植调节肠道微生物群可减轻高脂饮食诱导小鼠的非酒精性脂肪性肝病,并且有效改善了门静脉高压。其他研究也进一步证实了肠道菌群作为NAFLD潜在治疗靶点的可行性,通过使用抗生素、益生元、益生菌和合生元等调节肠道微生物群和肠道屏障功能可有效改善NAFLD小鼠脂质积累和肝脏炎性反应[17]。这也提示肠道菌群可能在NAFLD诊疗中有着巨大潜力。但肠道菌群在NAFLD的致病及治疗作用机制尚未完全明确,仍需要大量临床和基础研究深入探索。
琥珀酸是一种由宿主细胞和微生物细胞产生的共同代谢产物之一,在肠道炎性反应和微生物群破坏的情况下可大量积累,并可以启动重要的保护机制,以抵抗代谢应激或组织损伤,但在其他炎性反应刺激的情况下,也可能会调节失衡,并导致疾病。除了对宿主组织的影响外,肠腔内琥珀酸盐的增加还改变了肠道微生物群落的代谢循环,可能导致将琥珀酸盐作为营养源的致病菌增殖。另外琥珀酸积累的肠腔紊乱也可能与丙酸盐、丁酸盐和醋酸盐等在内的抗炎性短链脂肪酸水平的变化,以及共生微生物与致病微生物的相对丰度的变化有关[18]。De Vadder等[19]通过给予小鼠富含纤维或琥珀酸饮食,发现肠道来源琥珀酸能有效增加肠道糖异生,降低小鼠血糖,改善胰岛素抵抗。从而影响肝脏葡萄糖生成,改善血糖调节和能量代谢。但迄今为止还没有相关研究报道肠道来源琥珀酸对NAFLD的影响作用,本研究通过琥珀酸干预高脂喂养小鼠,发现琥珀酸能有效改善NAFLD小鼠肝脏脂质沉积,其机制可能与降低血清三酰甘油和总胆固醇水平,改善葡萄糖调节受损,进而降低肝脏脂质合成有关。
综上所述,琥珀酸作为肠道菌群的一种有机酸,对高脂诱导小鼠NAFLD具有保护作用,然而关于肠道菌群代谢产物琥珀酸在NAFLD中的相关分子机制的研究仍需更深入探索,细胞水平仍在进一步验证之中。本研究为非酒精性脂肪性肝病的临床治疗提供新的参考依据,为调节肠道菌群治疗NAFLD奠定前期基础。
利益冲突:所有作者声明无利益冲突
作者贡献声明
喻江南、宋铃榆:设计研究方案,实施研究过程,论文撰写;杨红、刘琦:提出研究思路,分析实验数据,论文审核,论文修改;冉苏叶:实施研究过程,资料搜集整理,进行统计学分析

