ELF3在宫颈癌组织中的表达及对HeLa细胞增殖的影响
路 彤,李 姗,郑鹏生*
(1 西安交通大学第一附属医院生殖医学科,西安 710061;2 西安市人民医院,西安市第四医院生殖医学中心;* 通讯作者,E-mail:zpsheng@mail.xjtu.edu.cn)
2020年,全球宫颈癌新发病例约60.4万,死亡病例约34.2万,这使宫颈癌稳居女性恶性肿瘤发病率及致死率第四[1]。确诊宫颈癌及因宫颈癌死亡的平均年龄分别是53岁和59岁,这极大地缩短了女性的平均寿命[2]。现已明确,高危亚型人乳头瘤病毒(HPV)慢性感染是宫颈癌的主要病因,这一认识推动了宫颈癌疫苗和癌前病变筛查技术的发展,得益于此,近年来许多地区宫颈癌的发病率及死亡率显著下降[3]。但HPV感染是宫颈癌的必要不充分条件[1],单纯HPV感染大多在短时间内被机体清除,仅有10%~20%发展为侵袭性病变[4],宫颈癌的发生还伴随着癌基因突变、抑癌基因失活及表观遗传改变等。因此,进一步阐明宫颈癌的发生机制、探索有诊断或预后价值的生物标志物对于宫颈癌的防治具有重要意义。
ELF3(E74 like ETS transcription factor 3)基因位于染色体1q32.1,编码蛋白包含371个氨基酸[5],是ETS转录因子家族的一员[5,6],其结构中包含多种DNA结合结构域(如ETS、A/T hook及PNT等),特异性地表达于分化完全的上皮细胞中,在胚胎发育、细胞增殖与分化等多种生理过程中发挥重要作用[7,8]。现有研究表明,ELF3在肿瘤中的作用具有组织特异性,即在不同组织类型的肿瘤中发挥不同的生物学作用。例如,ELF3抑制雌激素受体阳性(ERα+)乳腺癌细胞增殖[9],但却促进HER2阳性乳腺癌的形成[10,11]。同样,ELF3是肺腺癌的癌基因[12],但却抑制非小细胞肺癌细胞的增殖、侵袭及迁移[13]。目前,ELF3在宫颈癌中的表达及意义尚未明确。本研究拟通过Western blot、qRT-PCR等多种方法分析ELF3在宫颈癌组织中的表达特点,并拟构建稳定过表达ELF3的宫颈癌细胞株,通过细胞计数、CCK-8及流式细胞术探索过表达ELF3对宫颈癌细胞增殖能力及细胞周期的影响及可能的机制。
1 材料与方法
1.1 数据平台与主要试剂
Oncominem数据平台网址:https://www.oncomine.org;基因表达谱交互分析(Gene Expression Profiling Interactive Analysis, GEPIA)平台网址:http://gepia.cancer-pku.cn;高通量基因表达(Gene Expression Omnibus,GEO)数据库网址:http://www.ncbi.nlm.nih.gov/geo;Kaplan-Meier分析平台网址:http://kmplot.com。人宫颈癌细胞系HeLa、SiHa和C-33A均购自美国菌种保存中心(ATCC,American Type Culture Collection);胎牛血清(FBS)购自美国Invitrogen公司;高糖DMEM培养基购自美国Gibco公司。pIRES2-AcGFP-Neo真核表达载体由西安交通大学环境与疾病相关基因教育部重点实验室自行构建、保存。抗ELF3多克隆抗体购自美国Abcam公司(货号:#ab97310);抗GAPDH多克隆抗体购自中国Proteintech公司(货号:#60004-1-lg)。
1.2 数据库资料分析
通过数据库资料分析,了解ELF3在肿瘤中的表达情况,并初步评估ELF3在宫颈癌组织和正常宫颈组织中的表达差异。使用Oncominem数据平台分析不同肿瘤组织与相应正常组织中ELF3的表达差异。借助GEPIA平台分析癌症基因图谱(The Cancer Genome Atlas,TCGA)数据库中宫颈鳞状细胞癌和宫颈腺癌(cervical squamous cell carcinoma and endocervical adenocarcinoma,CESC)与正常宫颈组织中ELF3的表达差异,同时分析CESC中,ELF3与细胞周期相关基因CDK2、MCM2、CREPT表达量的相关性。通过GEO数据挖掘,分析宫颈癌组织和正常宫颈组织中ELF3的表达情况。采用Kaplan-Meier曲线法分析宫颈癌患者的无复发生存期(relapse-free survival,RFS)与ELF3表达水平的关系。
1.3 临床样本
宫颈癌组织样本均收集自2014年4月至2017年1月期间于西安交通大学第一附属医院妇科接受手术治疗的宫颈癌住院患者。所有纳入患者术前均未曾接受过放、化疗或免疫治疗,且病历资料完整。正常宫颈标本取材于同时期因子宫肌瘤行子宫全切术者。所有样本的病理诊断均由病理专家出具。本研究已通过西安交通大学医学院第一附属医院伦理委员会的审查(批件号:2014伦审科字第113号),所有患者均已签署知情同意书。
1.4 细胞培养
人宫颈癌细胞系HeLa、SiHa和C-33A均常规培养(37 ℃,5% CO2)于含10%胎牛血清及1%青-链霉素的高糖DMEM培养基中。
1.5 构建质粒及细胞转染
通过本方法构建ELF3过表达载体并建立稳定过表达ELF3的HeLa细胞株及相应的对照细胞,为后续研究提供实验基础和工具细胞。根据GeneBank中检索的ELF3 CDS区序列(NM_001114309.2),借助Premier 6.0软件设计ELF3的特异性引物(正向引物:5′-GGAAGATCTGCCACCATGGCTGCAACCTGTGAGATT-3′;反向引物:5′-ACGCGTCGACTCAGTTCCGACTCTGGAGAACC-3′)。以HeLa细胞为模板,借助PCR获取ELF3的全长cDNA片段。利用限制性核酸内切酶SalⅠ和BglⅡ分别双酶切该PCR扩增产物及pIRES2-AcGFP-Neo表达载体。酶切产物经琼脂糖凝胶电泳,利用胶回收法纯化。随后,使用DNA连接酶连接酶切后的pIRES2-AcGFP-Neo表达载体和ELF3 cDNA片段。连接产物转化至感受态后,挑取阳性克隆并提取其质粒,依次行双酶切鉴定及测序鉴定。测序结果与ELF3基因序列进行比对,选定比对结果完全一致的克隆(命名为:pIRES2-AcGFP1-Neo-ELF3)进行细胞转染操作。按照Lipofectamine 2000说明书,分别将空载体pIRES2-AcGFP-Neo和重组质粒pIRES2-AcGFP1-Neo-ELF3转染至HeLa细胞中。随后借助含G418的培养基筛选阳性克隆,经Western blot鉴定,选定稳定过表达ELF3的单克隆细胞株(命名为:HeLa-ELF3),转染了空载体的HeLa细胞作为对照细胞组(命名为:HeLa-GFP)。扩增、传代后冻存于-80 ℃冰箱或液氮中备用。
1.6 qRT-PCR检测ELF3 mRNA的表达水平
通过此方法检测收集的临床组织样本或本次研究中构建的HeLa-ELF3中ELF3 mRNA的表达水平,以评估ELF3 mRNA在宫颈癌组织及正常宫颈组织中的表达差异,或评估其在外源性过表达ELF3的HeLa细胞中的表达情况。收集选取的7例宫颈癌组织(CC)和7例正常宫颈组织(NC)及处于对数生长期的HeLa-ELF3及对照细胞(HeLa-GFP),利用TRIzol试剂提取总RNA,并用酶标仪测定浓度。接着,借助反转录酶将RNA反转录为cDNA,备用或-20 ℃保存。qRT-PCR引物序列见表1,按照2×RealStar SYBR Mixture说明书操作,使用西安天隆科技有限公司的实时荧光PCR仪进行扩增反应。

表1 qRT-PCR引物序列
1.7 免疫组化染色(IHC)和免疫细胞化学(ICC)检测ELF3的表达
借助IHC检测10例宫颈癌组织、8例高级别鳞状上皮内病变(high-grade squamous intraepithelial lesions,HSIL)和8例正常宫颈组织样本中ELF3蛋白的表达情况,以评估不同组织样本中ELF3蛋白的表达差异。经10%中性福尔马林溶液固定、石蜡包埋的临床组织标本,保存于4 ℃冰箱。切片(厚度5 μm)后,置于烤箱烘烤(65 ℃)4~6 h。依次浸入二甲苯Ⅰ、Ⅱ及无水乙醇Ⅰ、Ⅱ中各10 min,随后将其依次浸入95%,80%乙醇中各5 min。PBS洗涤(1×PBS,5 min/次×3次,下同)后,浸入沸腾的柠檬酸钠修复液中高压修复2 min。PBS洗涤后,浸入3% H2O2中封闭10 min。PBS洗涤。甩除或吸除样片多余水分,滴加稀释浓度为1∶100的抗ELF3多克隆抗体,置于湿盒中孵育(4 ℃)过夜。PBS洗涤后滴加二抗,37 ℃孵育30 min。DAB显色,苏木素染核3 min,分化20 s,返蓝1 min(每一步完成均流水冲洗后进入下一步)。依次浸入80%,90%乙醇及无水乙醇、二甲苯Ⅰ、Ⅱ中各10 min。封片后拍照记录。
通过ICC检测人宫颈癌细胞系HeLa、SiHa及C33-A中ELF3蛋白的表达水平,以助于工具细胞系的选择。灭菌后的0.5 cm盖玻片平铺于3.5 cm培养皿中备用。将处于对数生长期的目标细胞株制备成单细胞悬液,以一定比例接种于前述准备好的皿中,培养48 h(细胞融合度约80%时)后,PBS洗涤。0.2% TritonX-100室温打孔10 min,PBS洗涤。盖玻片细胞面向上粘于载玻片上。后续抗体孵育等步骤同IHC检测所述。
染色结果由两位病理学工作者独立、双盲评定。具体评级细则为:按阳性细胞百分比分5级:<5%(0分),5%~30%(1分),30%~50%(2分),50%~80%(3分),≥80%(4分);按染色强度分4级:阴性(0分),弱(1分),中(2分),强(3分)。评分后计算公式:免疫反应评分(immunoreactivity score, IRS)=阳性细胞百分比评分×染色强度评分。根据IRS评分结果将样本分为阳性和阴性两组,规定IRS>3为阳性。
1.8 Western blot检测ELF3的表达
采用Western blot检测随机选取的8例宫颈癌和8例正常宫颈组织样本及人宫颈癌细胞系HeLa、SiHa、C33-A中ELF3的表达情况并鉴定稳定过表达ELF3的HeLa细胞中ELF3蛋白的表达水平。收集组织样本和处于对数生长期的待测细胞株,用预冷的含1×cocktail的蛋白裂解液裂解后,采用BCA试剂盒测定蛋白浓度并计算上样体积(上样量50 μg)。SDS-PAGE分离蛋白,根据ELF3蛋白的分子量大小,选用的分离胶和浓缩胶浓度分别为10%,5%。随后转至PVDF膜上(转膜60 min),5%脱脂牛奶封闭1 h后,4 ℃过夜孵育稀释浓度为1∶1 000的抗ELF3多克隆抗体或稀释浓度为1∶10 000的抗GAPDH多克隆抗体,洗膜后孵育二抗(室温,1 h)。再次洗膜后,滴加ECL发光液,使用全自动化学发光图像分析系统自动曝光,并用ImageJ软件进行灰度分析。
1.9 细胞计数和CCK-8法检测细胞的体外增殖速度
通过细胞计数和CCK-8法检测HeLa-ELF3及对照细胞的体外增殖速度,评估ELF3对HeLa细胞生物功能的影响。按3×104个细胞/皿将细胞悬液接种于3.5 cm的培养皿中(共准备12皿),并用含1 g/L G418的DMEM培养基常规培养。接种后24 h取任意3皿计数,此后隔天计数3皿。将单细胞悬液以400个细胞/孔的密度接种于96孔板,于接种后第1,3,5,7天按照CCK-8检测试剂盒说明书加样并检测各组OD值(450 nm)。实验结束后,绘制生长曲线并分析。
1.10 流式细胞仪检测细胞周期
通过流式细胞术检测HeLa-ELF3及HeLa-GFP的周期时相分布,评估外源性过表达ELF3对HeLa细胞细胞周期的影响。选取生长状态良好且融合度约80%的细胞,PBS冲洗2次后加入选择培养基(不含FBS的高糖DMEM培养基)培养24 h。而后制备成单细胞悬液,并以50×104个细胞/皿的密度接种于3.5 cm的培养皿中,常规培养24~48 h。收集细胞并用4 ℃预冷的PBS洗2次。加入1 ml已-20 ℃预冷的75%乙醇于4 ℃固定细胞24 h。PBS洗涤2次,加入20 μl RNase及10 μl PI染液,于4 ℃避光染色30 min,流式细胞仪上机检测。
1.11 统计学分析

2 结果
2.1 宫颈癌中ELF3表达上调
Oncomine分析结果表明,ELF3在乳腺癌、卵巢癌等肿瘤中表达上调,而在另一些肿瘤(如头颈癌、肉瘤)中表达下调(见图1A),这提示ELF3具有双重作用。利用GEPIA数据平台生成的ELF3基因在宫颈鳞状细胞癌和宫颈腺癌中匹配TCGA常规数据和GTEx数据的箱线图表明,相较于正常宫颈组织,宫颈鳞状细胞癌和宫颈腺癌中ELF3 mRNA表达水平显著上调(P<0.05,见图1B),GEO数据库分析结果与上述结论一致(P<0.05,见图1B)。借助qRT-PCR分析随机选取的7例宫颈癌和7例正常宫颈组织样本中ELF3 mRNA的表达情况,结果进一步证实了ELF3在宫颈癌中高表达(P<0.01,见图1C)。此外,Kaplan-Meier生存分析结果表明,ELF3 mRNA表达水平与宫颈鳞状细胞癌和宫颈腺癌患者的无复发生存期(RFS)正相关(P=0.019,见图1D)。

图1 宫颈癌中ELF3 mRNA高表达并与不良预后有关Figure 1 High ELF3 mRNA expression in cervical cancer and its association with poor prognosis
IHC检测结果显示ELF3蛋白主要定位于细胞质中,细胞核中也有表达(图2A),宫颈癌和高级别鳞状上皮内病变组织(HSIL)样本的IRS评分均显著高于正常宫颈组样本(7.200 ±4.756,6.875 ±3.399vs2.625 ±3.739,P<0.05,见图2B)。Western blot结果表明,与正常宫颈组织相比,宫颈癌组织样本中ELF3蛋白表达量显著上调(0.56 ±0.49vs0.029 ±0.072,P<0.01,见图3)。

图2 免疫组化染色法检测ELF3蛋白在宫颈癌组织中的表达情况Figure 2 Expression of ELF3 protein in cervical cancer detected by IHC
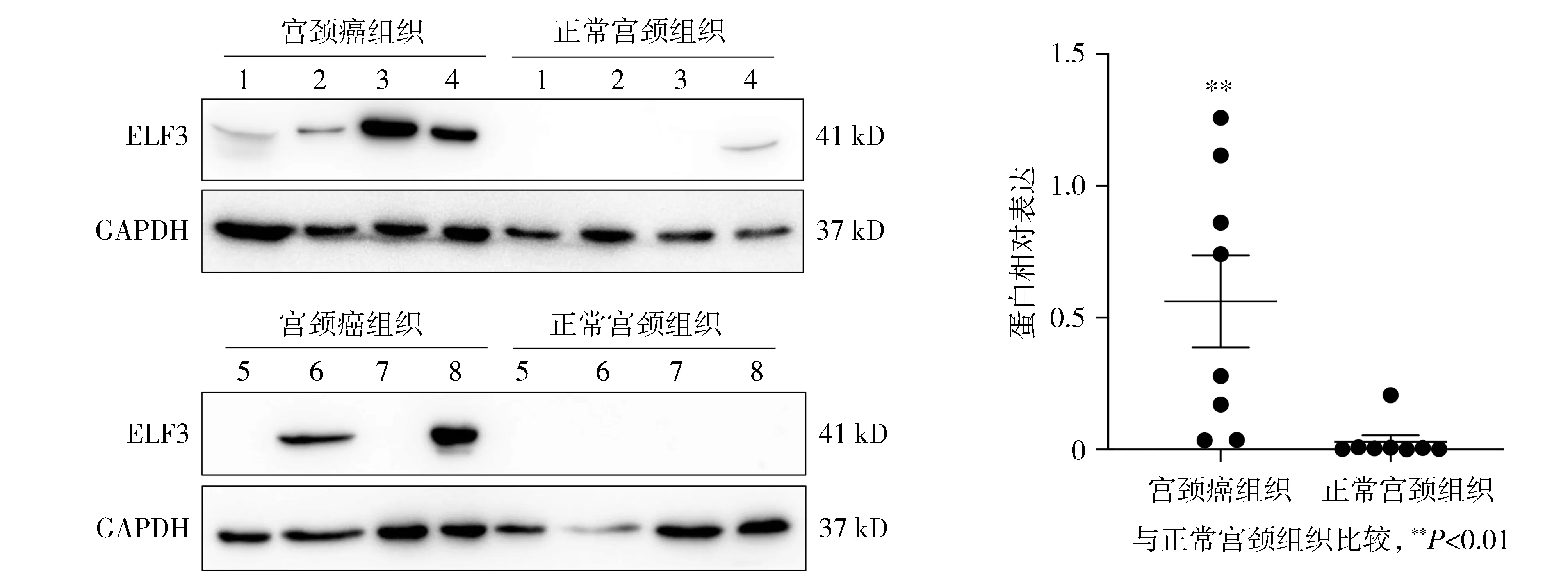
图3 Western blot检测ELF3蛋白在宫颈癌组织中的表达情况Figure 3 Expression of ELF3 protein in cervical cancer detected by Western blot
2.2 成功构建了pIRES2-AcGFP1-Neo-ELF3重组质粒
琼脂糖凝胶电泳检测双酶切后的PCR扩增产物,结果显示,在DNA Marker指示的约1 000 bp处,可见一与预期大小(ELF3:1 116 bp)相符的特异性扩增产物(见图4A)。重组质粒pIRES2-AcGFP1-Neo-ELF3阳性克隆酶切预鉴定结果见图4B。随后,经测序比对确认pIRES2-AcGFP1-Neo-ELF3构建成功。

图4 构建ELF3过表达质粒Figure 4 Establishment of overexpression plasmid of ELF3
2.3 ELF3促进HeLa细胞增殖
ICC和Western blot检测结果显示,C-33A中ELF3的表达量显著高于HeLa和SiHa(见图5)。本研究选用HeLa细胞系作为工具细胞。
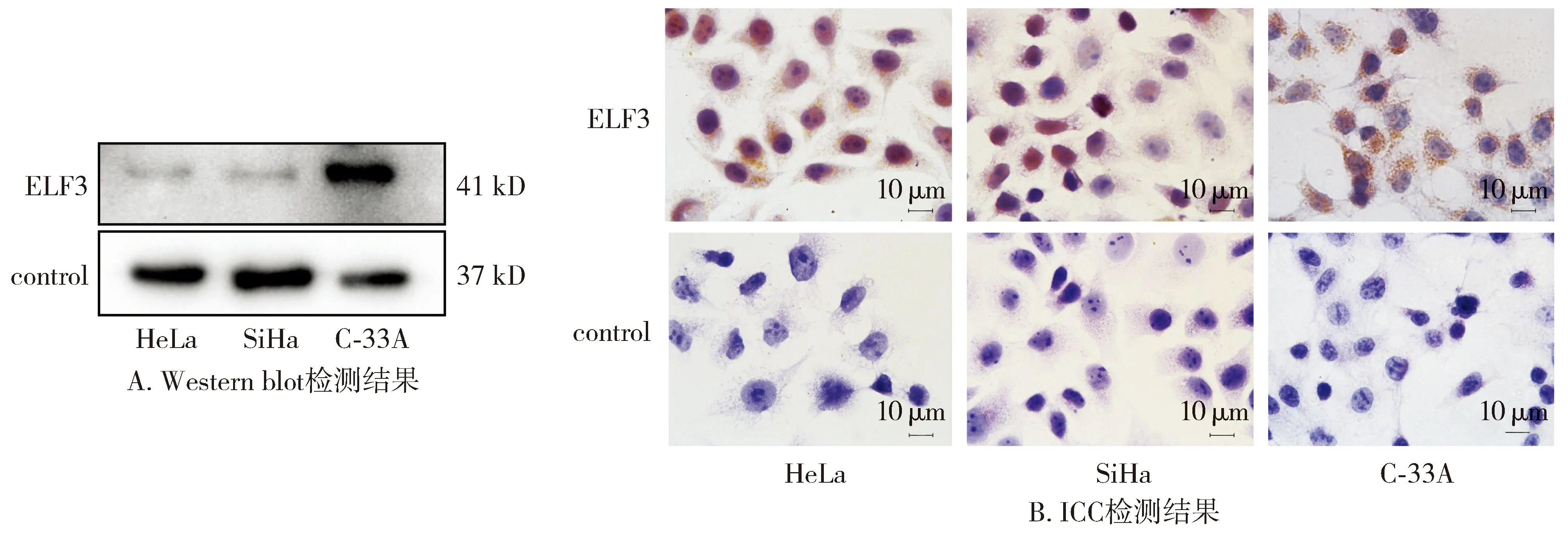
图5 Western blot和免疫细胞化学检测人宫颈癌细胞系中ELF3的表达情况Figure 5 Expression of ELF3 in cervical cancer cell lines detected by Western blot and ICC
G418筛选的阳性克隆细胞株的鉴定结果见图6,转染了过表达ELF3重组质粒的HeLa细胞株中ELF3蛋白及mRNA的表达量均显著高于转染了空载体的对照细胞,这表明稳定过表达ELF3的HeLa细胞株建立成功,命名为HeLa-ELF3。将转染了空载体的细胞命名为HeLa-GFP。

与HeLa-GFP比较,* P <0.05,* * P <0.01
细胞计数实验结果显示,相比于HeLa-GFP,HeLa-ELF3组细胞生长速度显著增快(P<0.05,见图7)。CCK-8实验结果显示,HeLa-ELF3组OD值显著高于HeLa-GFP组(P<0.05,见图7),即细胞活力显著增加。这些结果表明,ELF3可促进HeLa细胞生长及活力。

A.过表达ELF3的HeLa细胞的生长曲线B.CCK-8检测过表达ELF3的HeLa细胞的活力与HeLa-GFP组比较,* P <0.05,* * P <0.01
2.4 ELF3加速HeLa细胞G0/G1期向S期转变
运用流式细胞仪检测HeLa-ELF3及HeLa-GFP的细胞周期,结果显示,HeLa-ELF3中处于G0/G1期的细胞比例显著低于HeLa-GFP组(47.6% ±3.0%vs56.3% ±5.0%,P<0.05,见图8),而处于S期及G2/M期的细胞比例显著高于对照细胞(28.3% ±2.9%vs23.2% ±3.5%,P<0.05;24.4% ±3.0%vs21.2% ±3.3%,P<0.05)。这些结果表明,ELF3可促进HeLa细胞从G0/G1期向S期转变。
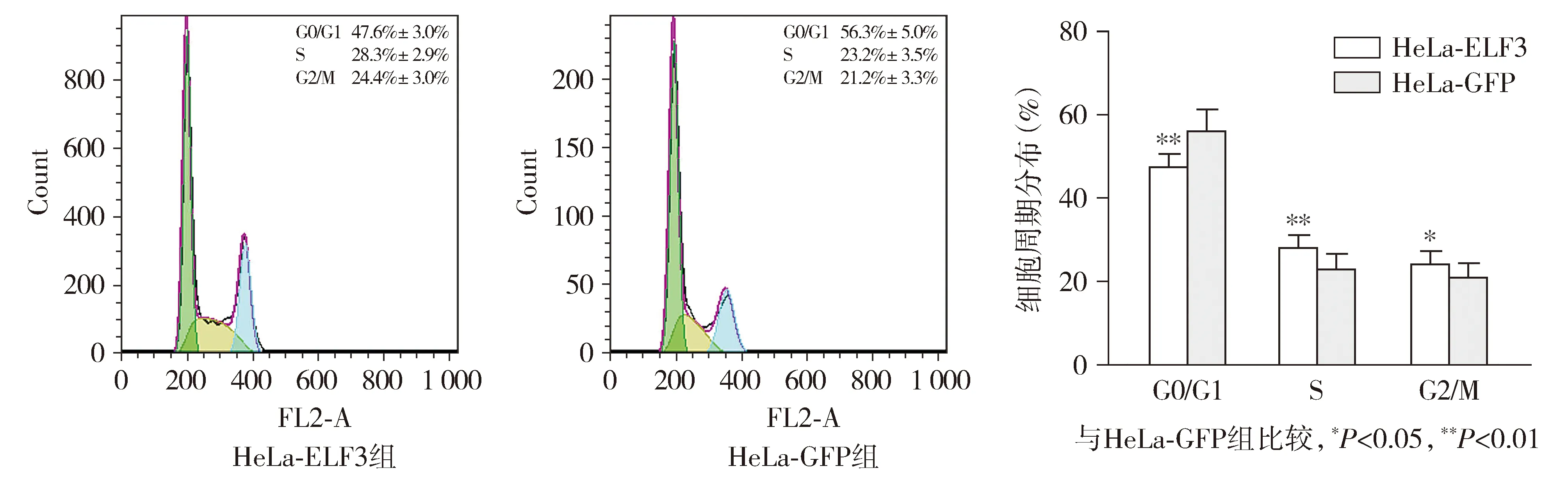
图8 ELF3加速HeLa细胞周期进程Figure 8 ELF3 accelerates cell cycle transition
另外,GEPIA数据平台分析结果显示,CESC中ELF3与CDK2、MCM2、CREPT(RPRD1B)的表达均呈正相关(r>0,P<0.05,见图9)。
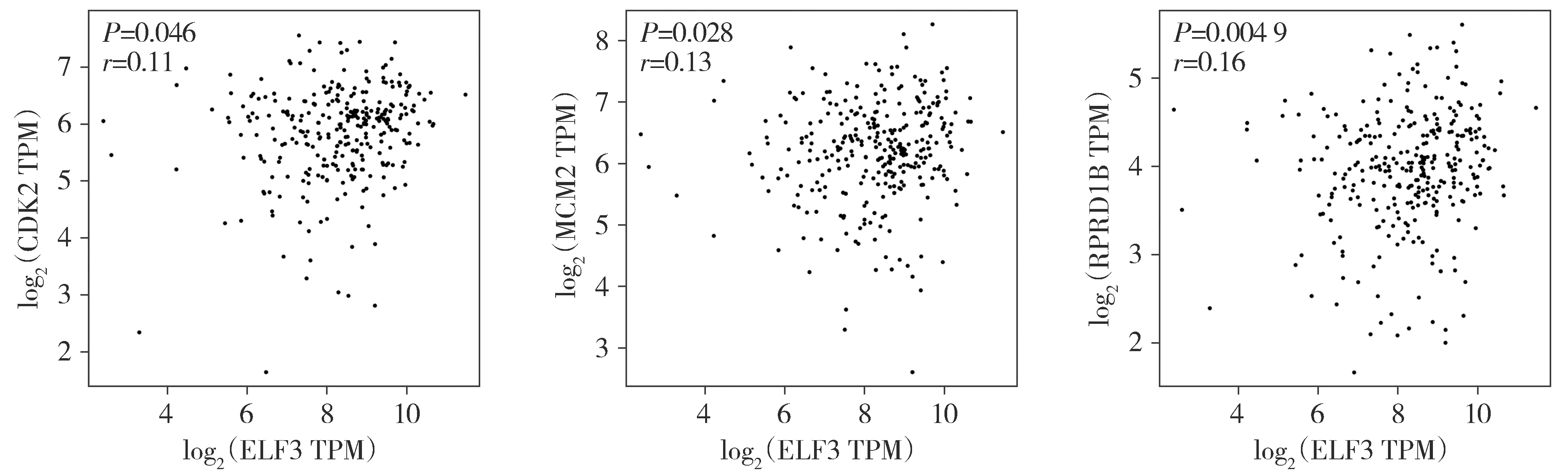
图9 ELF3与CDK2、MCM2、CREPT的表达均呈正相关Figure 9 Positive correlation between ELF3 and CDK2, MCM2, CREPT in CESC
3 讨论
宫颈癌的主要病因是高危亚型HPV慢性感染[14],但流行病学研究和相关实验数据表明,单独HPV感染并不足以诱发宫颈癌[15]。因此,阐明HPV-宿主相互作用中的致癌模式和作用靶点,将可能推动宫颈癌的防治及靶向药物的研发进程,进而有效降低宫颈癌的发病率和死亡率。ELF3在胚胎发育、泌乳等生理过程及多种肿瘤(如肺癌、乳腺癌等)的发生发展中发挥重要作用,但ELF3在宫颈癌中的表达与作用目前尚无报道。本研究结果显示ELF3在宫颈癌组织中高表达并与患者预后不良有关,这提示ELF3在宫颈癌发生发展中可能发挥重要作用。
本次研究成功构建了稳定过表达ELF3的HeLa细胞株。细胞功能学实验结果显示外源性过表达ELF3可促进HeLa细胞增殖及活力。此外,与对照相比,HeLa-ELF3处于S期及G2/M期的细胞比例增高,而处于G0/G1期的细胞比例降低,差异有统计学意义。这表明,ELF3通过加速HeLa的细胞周期进程,促进其分裂、增殖。与本研究结果一致的是,已有研究表明,在非小细胞肺癌中,敲低ELF3的表达后细胞周期G1/S检查点因子CDK4、CCND1、C-MYC和E2F1的表达被抑制,阻滞细胞周期进程,进而抑制肿瘤细胞增殖[16]。已有研究表明,CDK2[17]、MCM2[18]、CREPT[19]等细胞周期相关分子可加速宫颈癌细胞周期进程,促进其增殖。本研究结果显示,宫颈癌组织中ELF3的表达水平与CDK2、MCM2、CREPT的表达均呈正相关。这提示ELF3加速HeLa细胞周期进程可能与这些细胞周期相关分子高表达有关。
综上所述,本研究首次揭示了ELF3在宫颈癌组织中高表达。同时揭示了外源性过表达ELF3通过加速HeLa细胞G0/G1期向S期转变从而促进细胞增殖,而这种细胞生物学功能的改变可能与CDK2、MCM2、CREPT等细胞周期相关分子的高表达有关,但相关分子机制有待进一步研究。本次研究为ELF3成为宫颈癌的治疗靶点或评估宫颈癌患者预后的指标提供基础,但本研究存在组织样本量少、工具细胞系少及缺乏体内实验相关结果等不足。下一步的研究工作将增加样本量、构建其他类型的工具细胞并开展动物实验,进一步证明ELF3对宫颈癌发生发展的影响。

