TLR4在皮肤鳞状细胞癌细胞的表达及其对细胞迁移和侵袭的影响
胡新红,曹天宇,刘 涛,王小霞,吕雅洁
(中国人民解放军空军军医大学第二附属医院皮肤科,西安 710038;* 通讯作者,E-mail:yajie_lv@163.com)
鳞状细胞癌(squamous cell carcinoma,SCC)是常见的皮肤恶性肿瘤,目前在全球范围内的发病率不断增加[1]。虽然许多因素会增加SCC的风险,但有研究显示SCC风险似乎仅与长期累积阳光暴露有关,尤其是在儿童和青年时期最为重要[2]。此外,SCC也是大多数非黑色素瘤皮肤癌相关转移性疾病发生和死亡的原因[3]。组织病理学和正确的手术切除仍然是SCC诊断和治疗的金标准[4]。
Toll样受体4(Toll-like receptor 4,TLR4)是一种膜蛋白受体,也是机体先天免疫系统的关键组成部分[5]。同时,TLR4在人类皮肤、角质形成细胞以及皮肤鳞状细胞癌中均表达[6],其在皮炎、银屑病、SCC和黑色素瘤以及皮肤伤口愈合等皮肤病中均扮演重要作用[7,8]。据报道,TLR4信号传导以MyD88依赖性方式促进SCC的发展,并且是癌变过程中炎症细胞募集所必需的[9]。另外,TLR4与细胞外皮肤液中人高迁移率族蛋白B1(high-mobility group box 1,HMGB-1)的相互作用,会导致角质形成细胞中核转录因子的激活,进而促进上皮肿瘤的发展[10]。同时,TLR4还通过激活T细胞,在预防化学诱导的致癌作用中发挥作用[11]。TLR4在支持细胞生长或诱导凋亡信号中的作用,主要通过激活其他细胞群来呈现[12]。然而,TLR4可能发挥抗肿瘤或促肿瘤作用,但这取决于肿瘤类型以及它是否在肿瘤细胞或免疫细胞中表达[13]。虽然有报道称,TLR4在皮肤SCC中发挥抗肿瘤作用[14],但TLR4影响SCC细胞水平的机制却不清晰。本研究通过分析临床SCC样本特征以及SCC细胞系中TLR4的表达变化和细胞生理功能变化,旨在分子和细胞水平探讨TLR4在SCC细胞中的表达水平,以及对SCC细胞迁移和侵袭的影响。
1 材料与方法
1.1 材料
1.1.1 试剂 人皮肤鳞状细胞癌细胞系(A431、HSC-1和HSC-5)和正常的永生化人角质形成细胞系HcCaT购于美国ATCC菌株保藏中心;脱脂牛奶、过氧化氢、氯仿、异丙醇购于上海生工有限公司;柠檬酸购于恒信生物技术有限公司;一抗TLR4、β-actin、HRP标记山羊抗IgG、二抗抗鼠免疫球蛋白IgG购于美国Abcam公司;显色底物二氨基联苯胺试剂盒购于成都欣亿维生物科技有限公司;胎牛血清、DMEF高糖培养基购于美国Gibco公司;BCA分析试剂盒、结晶紫和Lipofectamine 2000购于碧云天生物技术有限公司;聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)膜购于美国Millipore公司;Trizol试剂、RNA prep pure Tissue Kit和PrimeScript RT合成试剂盒和SYBR®Green qRT-PCR Master Mix试剂盒购于美国Thermo公司;Transwell购于无锡耐思生命科技股份有限公司;所有引物合成于上海生工有限公司。
1.1.2 组织样本 于2018年3月至2020年12月在中国人民解放军空军军医大学第二附属医院收集和分离了80例SCC患者和70例鲍温病(Bowen disease,BD)患者的组织样本,同时收集了40例正常健康受试者的组织样本。所有患者均未接受过包括化疗或放疗在内的术前治疗。本研究所有参与患者均获得知情同意,本研究已获本院伦理委员会审查批准(伦理审批号:201801180023)。所有病例均仔细复查,病理诊断均按照WHO分类[15]。
1.2 方法
1.2.1 皮肤鳞状细胞癌患者的临床特征分析 统计分析80例SCC患者和70例鲍温病患者的基本临床特征,包括年龄、性别和病变部分的分布。患者病变部位分布分析主要包括头、脸、手臂、手、身体、外阴、腿和脚,剩余的病变部位均归为其他。
1.2.2 免疫组织化学法检测蛋白表达水平 SCC组织样本经切片脱蜡,经过氧化氢处理5 min,抑制内源性过氧化物酶活性。滴加山羊血清封闭液,并使用柠檬酸液修复抗原。将SCC组织样本与鼠抗TLR4(1∶200)于4 ℃孵育过夜。PBS冲洗2次,每次3 min;然后与HRP标记的山羊抗小鼠IgG(1∶2 000),室温孵育1.5 h;用PBS冲洗2次,每次3 min。最后,使用显色底物二氨基联苯胺试剂盒检测主要抗体。如文献[16]所述,使用显微镜观察免疫组织化学染色的图像,同时使用Image J软件对蛋白表达水平进行定量分析。
1.2.3 细胞培养 本研究中所使用的细胞系包括人皮肤鳞状细胞癌细胞系(A431、HSC-1和HSC-5)和正常的永生化人角质形成细胞系HcCaT。A431、HSC-1和HSC-5细胞和HcCaT细胞所使用的培养基为DMEF高糖培养基。所有细胞的培养条件为37 ℃、5% CO2,培养基添加10%胎牛血清。
1.2.4 蛋白质印迹检测TLR4蛋白的表达水平 收集各组细胞培养液,离心收集细胞沉淀(4 ℃,3 000 r/min,5 min),超声裂解细胞(180 W,3 min),然后低温高速离心(4 ℃,12 000 r/min,5 min),分离上清液,使用BCA分析试剂盒检测蛋白浓度。采用10% SDS-PAGE分离蛋白,然后转移到PVDF膜上,于室温下用5%脱脂牛奶封闭1 h;将膜与一抗TLR4(1∶1 000)和β-actin(1∶2 000)分别在4 ℃下孵育过夜。然后将它们与二抗抗鼠免疫球蛋白IgG(1∶2 000)在室温下孵育1 h。采用增强化学发光剂检测目的蛋白的表达水平。使用Image Lab软件(Bio-Rad Laboratory)对斑点进行半定量。


表1 本实验所用引物
1.2.6 小干扰RNA转染和分组 待人皮肤鳞状细胞癌(SCC)细胞系(A431、HSC-1和HSC-5)和正常的永生化人角质形成细胞系HcCaT生长到细胞皿的80%~90%时,根据使用说明书,采用Lipofectamine 2000对HcCaT、A431、HSC-1和HSC-5细胞系分别转染针对TLR4的5 nmol/L的si-TLR4(作为转染组)或对照siRNA(作为对照组)。引物信息见表1。
1.2.7 Transwell实验检测细胞侵袭和迁移情况 如文献[14]所述,使用Matrigel包被的Transwell进行各组的细胞侵袭和迁移试验。将50 μl的Matrigel(2 mg/ml)加入Transwell的上室,在37 ℃下孵育30 min。随后,将4×103细胞接种在无血清的DMEM培养基中;在下室加入含10%胎牛血清的600 μl培养基作为化学诱导剂,孵育24 h后,用棉签清除未侵入的细胞。将侵入下膜的细胞用4%多聚甲醛室温固定30 min,并用0.1%结晶紫在室温下染色20 min,在显微镜下(德国卡尔·蔡司)拍摄并计数入侵和迁移的细胞数,共选择5个随机视野进行细胞计数,并计算平均值。
1.3 数据统计分析

2 结果
2.1 皮肤鳞状细胞癌患者的临床特征
80例SCC患者和70例BD患者的临床特征显示,SCC患者和BD患者的平均年龄分别为(72.54 ±3.47)岁和(73.62 ±3.19)岁;从性别分布上看,SCC患者中男性和女性比例为38∶42,BD患者中男性和女性比例为21∶49(P=0.02);从病变部位分布上看,病变位于面部和暴露在阳光下的部位(头和手)在SCC患者和BD患者中分别为45%(共44例)和40%(共28例),病变位于身体非曝光部位(手臂、身体、外阴、腿和脚)在SCC患者和BD患者中分别为55%(共36例)和60%(共42例)。
2.2 TLR4在皮肤鳞状细胞癌组织中高表达
免疫组织化学评估皮肤肿瘤中的TLR4阳性表达的结果显示,正常表皮组织中淡黄色至棕褐色颗粒(阳性染色)分布较稀疏,BD患者病变表皮组织中淡黄色至棕褐色颗粒分布呈带状、较密集,SCC患者病变表皮组织中淡黄色至棕褐色颗粒数量多,分布密集(见图1)。与邻近的正常表皮组织相比,BD和SCC患者病变组织中TLR4阳性表达均升高,差异具有统计学意义(P<0.05,见图2)。

图1 TLR4在SCC和BD组织中高表达 (DAB染色,×400)Figure 1 High expression of TLR4 in SCC and BD tissues (DAB,×400)

与正常组织相比,* P <0.05,* * * P <0.001
2.3 TLR4在皮肤鳞状细胞癌细胞系中mRNA和蛋白质表达水平
RT-qPCR和Western blotting结果显示,与对照组HcCaT细胞系相比,转染组SCC细胞系A431、HSC-1和HSC-5中TLR4的mRNA和蛋白质表达水平均显著升高(P<0.01,见图3)。与对照组相比,转染组中各SCC细胞系A431、HSC-1和HSC-5中TLR4的mRNA和蛋白质表达水平均显著下降(P<0.01);但转染si-TLR4后,SCC细胞系A431、HSC-1和HSC-5中TLR4的mRNA和蛋白质表达水平仍高于HcCaT细胞系(P<0.05,见图3)。
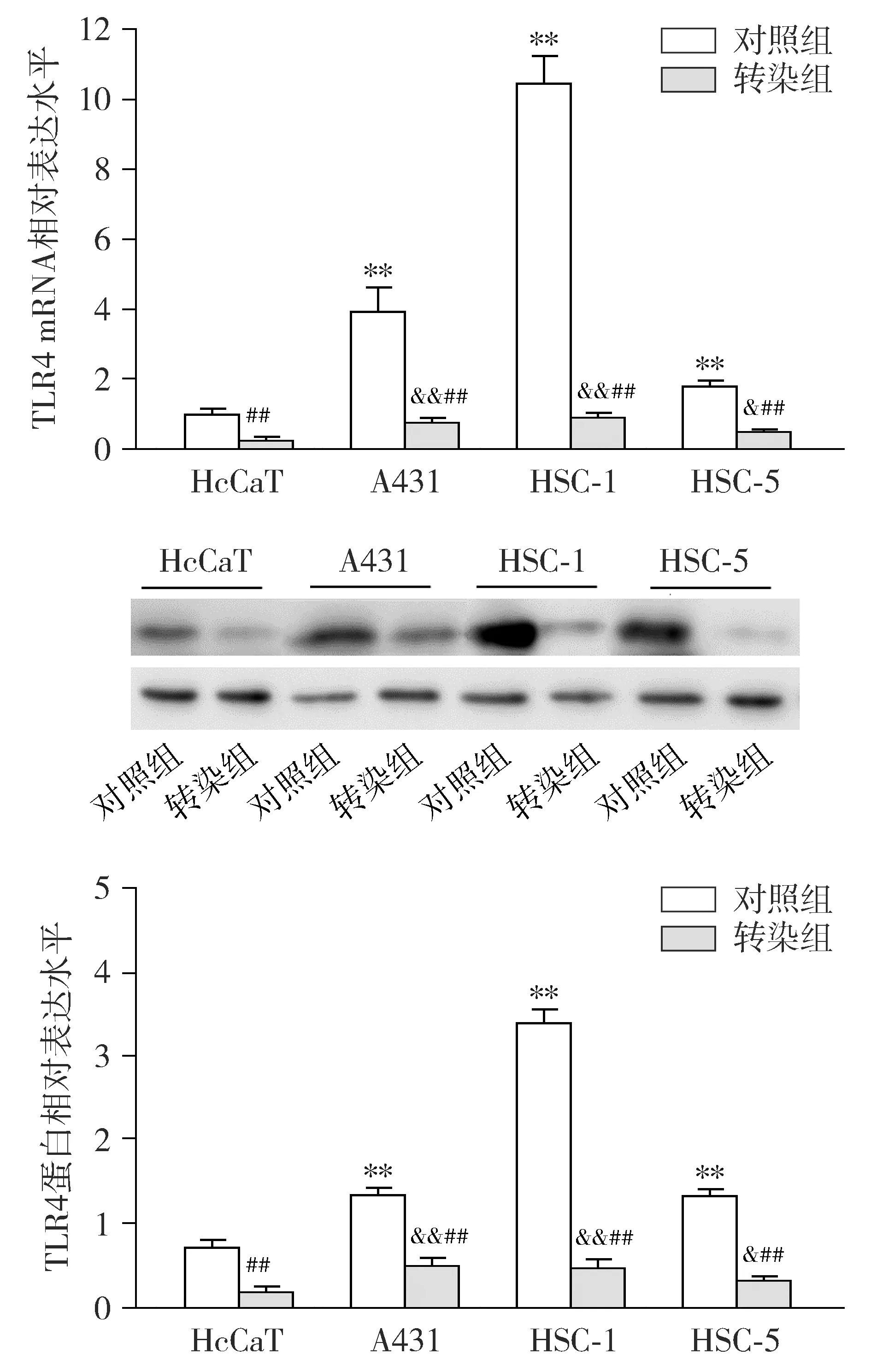
对照组与HcCaT细胞相比,* * P <0.01;转染组与HcCaT细胞相比,& P <0.05,&& P <0.01;同种细胞与对照组相比,## P <0.01
2.4 si-TLR4增强了皮肤鳞状细胞癌细胞的迁移
细胞迁移实验结果显示,与对照组相比,转染组中HcCaT细胞和SCC细胞系中A431、HSC-1和HSC-5的细胞迁移数量均显著升高(P<0.01,见图4)。
2.5 si-TLR4增强了皮肤鳞状细胞癌细胞的侵袭
细胞侵袭实验结果显示,与对照组相比,转染组中HcCaT细胞和SCC细胞系中A431、HSC-1和HSC-5的细胞侵袭数量显著升高(P<0.01,见图5)。
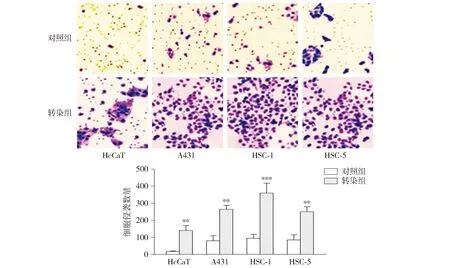
与对照组比较,* * P <0.01,* * * P <0.001
3 讨论
人类表皮肿瘤最常见的形式包括脂溢性角化病、癌前病变如鲍温病或鲍温样丘疹病,以及基底细胞癌或鳞状细胞癌[17]。鳞状细胞癌始于局部侵袭性恶性皮肤肿瘤[18],非典型鳞状细胞的癌巢起源于表皮的不同层,并不规则地延伸到真皮中[19]。鳞状细胞癌的恶性和转移潜能都比较高,已确认某些形式的肿瘤发生与慢性炎症密切相关;也有报道慢性乙型肝炎可诱发肝细胞癌,慢性胃炎或胃溃疡可诱发胃癌[20]。然而,TLR4相关炎症在鳞状细胞癌发展中对细胞的迁移和侵袭的影响,以及所起的作用仍然知之甚少。本研究旨在通过分子和细胞水平,探究TLR4在SCC细胞中的表达水平,以及对SCC细胞迁移和侵袭的影响,以期进一步解析TLR4在鳞状细胞癌发生发展中的机制,为临床领域应用研究提供一定的支持。
本研究中SCC患者中病变位于面部和暴露在阳光下的部位为45%,这与文献中的数据基本符合,研究报道较多SCC患者病变均出现在暴露在阳光下的皮肤上,例如前额、面部、耳朵、头皮、颈部和手背[21]。同时本研究检查了TLR4在非黑素细胞皮肤癌BD和SCC中的表达水平,结果显示BD和SCC患者的病变组织中TLR4阳性表达水平显著提高,且SCC患者TLR4的阳性表达水平也明显高于BD患者。
SCC被认为是一种癌前病变SCC,这种病变会发展演变为侵袭性SCC[22]。研究表明,从正常皮肤逐渐病变的过程中,组织样本中角质形成细胞中TLR4的表达会显著增加[23-25],这些结果表明TLR4表达可能还参与皮肤SCC的形成和进展。本研究表明,与HcCaT(正常的永生化人角质形成细胞系)相比,SCC细胞系A431、HSC-1和HSC-5中TLR4的mRNA和蛋白质表达水平均显著提高。这结果也表明,在SCC形成的过程中,TLR4的表达会逐渐增强。
另外,本研究还发现了一个有趣的现象,在SCC细胞系HSC-1和HSC-5中,TLR4 siRNA转染的HSC-5细胞中TLR4 mRNA和蛋白水平比HSC-1细胞系中TLR4 mRNA和蛋白水平显著降低。文献表明,HSC-1是一种源自低分化人类手部皮肤SCC的细胞系且细胞生长表现出角化特征,例如异种移植小鼠模型中的角质和单个细胞角化[26,27];而HSC-5是一种源自分化良好的人耳廓皮肤SCC的细胞系,缺乏角化能力[28]。同时HSC-1和HSC-5细胞角蛋白表达水平不同。HSC-1和HSC-5细胞之间对TLR4 siRNA反应性的差异可能是由这些细胞生物学差异引起。文献表明,在HSC-5细胞中缺乏TLR4蛋白,当成功敲低后可能影响细胞迁移和CD44表达[23]。这些结果可能是由于HSC-1和HSC-5细胞之间的细胞生物学差异,例如mRNA和蛋白质之间的稳定性差异,或蛋白质降解过程的差异。未来我们也将使用更多SCC细胞系并提供更多证据来支持本研究的结果。
同时,还研究了TLR4的表达对SCC细胞迁移和侵袭的影响。文献表明,从细胞边缘伸出的细长指状膜突起,可能会影响细胞迁移和细胞侵袭[29]。已有研究报道,某些特殊的Toll样受体可以通过活化T细胞以发挥其抗肿瘤作用,如TLR4配体可以通过MyD88依赖性途径间接诱导Th1抗肿瘤免疫应答而实现肿瘤抵抗[30];或通过促进癌细胞凋亡和抑制增殖来发挥抗肿瘤作用,如通过活化TLR2信号而激活Fas/FsaL介导的途径来促进小鼠结直肠癌上皮细胞系CT26凋亡,并抑制了肿瘤细胞的增殖[31]。本研究中,TLR4在SCC细胞系中高表达,通过siRNA干扰实验,发现与对照siRNA转染的HaCaT细胞相比,敲低TLR4的表达促进了细胞的迁移和侵袭,这表明TLR4在SCC的发生发展中存在一定的抗肿瘤作用,这与前人的研究结果也一致。
综上所述,TLR4对皮肤SCC的发生和发展具有抑制作用,抑制的TLR4的表达可能会促进皮肤SCC的恶化进程。未来,我们的目标是研究TLR4在上皮-间质转化中的作用,这与癌细胞迁移和侵袭性密切相关。

