利拉鲁肽通过调节骨髓间充质干细胞外泌体miR-31a-5p/E2F2改善2型糖尿病大鼠β细胞损伤和骨代谢
杨 彬,扈友庄,黄志文
(广东医科大学附属医院老年医学科,湛江 524000;*通讯作者,E-mail:Huangzw1978@126.com)
糖尿病是一种全球范围内高发的代谢障碍疾病[1],其中2型糖尿病(type 2 diabetes, T2DM)占糖尿病病例的95%[1-3]。研究显示,治疗T2DM的一种胰高血糖素样肽-1受体激动剂利拉鲁肽(liraglutide, LIR),可改善糖尿病大鼠β细胞损伤和骨代谢失衡[4,5]。然而其内在机制并不清楚。
骨髓间充质干细胞(bone marrow mesenchyml stem cell, BMSC)来源的外泌体(Exosome, Exo)(BMSC-Exo)在治疗和改善糖尿病和代谢调节中发挥关键作用[6-8]。研究表明BMSC-Exo中miR-31a-5p/E2F2信号轴是骨代谢失衡的关键调节信号[9-12]。另外,LIR可改变切除卵巢的T2DM大鼠BMSC-Exo携带的miRNA[13]。然而,BMSC-Exo中miR-31a-5p/E2F2信号轴是否在LIR治疗T2DM的过程中发挥作用并不清楚。因此,本研究探讨LIR对T2DM大鼠体内BMSC外泌体中miR-31a-5p/E2F2的影响,以及miR-31a-5p/E2F2参与治疗或改善T2DM的β细胞损伤和骨代谢失衡的效果。
1 材料与方法
1.1 仪器与试剂
酶标仪(美国Thermo Fisher Scientific);超高速离心机(德国Herolab公司);透射电子显微镜(日本电子株式会社)。LIR(诺和诺德(中国)制药有限公司,国药准字J20110026);链脲佐菌素STZ(美国Sigma),DispaseⅡ酶(上海翊圣生物科技有限公司);聚偏二氟乙烯膜(美国Millipore Corporation);ALP活性测定试剂盒,兔抗CD9、CD63、RANK、E2F2、骨形态发生蛋白2(BMP-2)、磷酸甘油醛脱氢酶(GAPDH)的第一抗体(英国Abcam公司);SuperSignal West Pico化学发光底物和Dounce匀浆器(美国Thermo Fisher Scientific)。miRNA拟似物(miR-mimic)(上海吉凯基因科技有限公司),qPCR引物(北京天根生物化学有限公司)。蛋白抽提试剂盒、化学发光试剂盒(美国赛默飞公司);二喹啉甲酸(bicinchoninic acid,BCA)、蛋白浓度测定试剂盒、TUNEL试剂盒(上海碧云天生物技术有限公司);反转录试剂盒(日本TaKaRa公司)。
1.2 动物和分组
50只6周龄SD雄性大鼠来源于广东医学院实验动物中心(合格证书编号:(粤)2002A013号)。动物饲养于23~25 ℃的光照/黑暗周期为12 h的环境中,每2只动物饲养于1个笼子,活动不受限制,且可以自由采食和饮水(生产许可证:SCXK(粤)2009-0039,饲养设施许可证号:SSXK(粤)2019-2029)。本研究中的所有动物操作程序均经我院动物伦理委员会批准(审批号:2020092号)。
将50只大鼠数字随机表法分为5组:LIR+miR-mimic+T2DM组、LIR+T2DM组、T2DM组、control组、LIR组,每组10只。LIR+miR-mimic+T2DM组给予高脂高糖饮食(20%蔗糖,15%黄油,10%的蛋黄粉,2%的胆固醇和73%的基础食品),高脂高糖饮食开始的同时,静脉注射0.2 mg/kg的LIR,2次/d,并且同时静脉注射2 μmol/L的miR-mimic,1次/7 d,LIR和miR-mimic注射均持续2个月,高糖饮食2个月后,向大鼠腹膜内注射35 mg/kg的STZ 2次(间隔3 d)。LIR+T2DM组不注射miR-mimic,而T2DM组不注射miR-mimic和LIR,其余操作方法同LIR+miR-mimic+T2DM组。control组接受标准实验动物饮食(脂肪3%,蛋白质20%,碳水化合物55%),不进行任何药物和诱导的干预。LIR组接受标准实验动物饮食,其余操作同LIR+T2DM组。LIR+miR-mimic+T2DM组、LIR+T2DM组、T2DM组高脂高糖饮食开始后3 d检测大鼠尾静脉血糖,随机血糖<16.7 mmol/L的大鼠剔除实验。以下所提到的实验方法均是按此分组进行。
1.3 骨髓的分离
诱导和给药结束后,将5组大鼠吸入2%异氟烷3 h进行安乐死。经过酒精彻底消毒全身后在双侧股骨下端皮肤开小口,充分暴露股骨及胫骨;用镊子提起并剪下双侧股骨,在无菌磷酸盐缓冲盐水中冲洗双侧股骨,去除附着的脂肪组织、结缔组织和骨膜,进行骨髓提取。解剖附骨后,用装有2 ml无菌PBS溶液的注射器冲洗每个股骨的骨髓,反复打成均匀的悬浮液,然后将悬浮液转移至无RNase的离心EP管中,并保存在-80 ℃。
1.4 BMSC-外泌体的制备与鉴定
1.4.1 BMSC-外泌体的制备 取4 ml 1.3中5组的悬浮液于15 ml离心管中,于4 ℃下以2 000g离心5 min后,转移上清至新的15 ml离心管。重复该步骤,依次以3 500g离心15 min、10 000g离心30 min、120 000g离心140 min。最后一次离心完成后,弃去上清,用4 ml无菌PBS将沉淀重新悬浮,用0.22 μmol/L无菌过滤器过滤,转入5 ml离心管中,在4 ℃下以120 000g离心70 min。离心后弃去上清,离心管底部残留的微量沉淀即为BMSC-外泌体。加入100 μl的无菌PBS悬浮液,放置于-80 ℃冰箱保存备用。
1.4.2 外泌体的鉴定 取10 μl外泌体悬液,滴入载样铜网中,保留1.5 min,滴加2%醋酸双氧乙铀溶液染色1 min后,用滤纸吸干,再在室温下晾1 min。将载样铜网置于样品室,使用透射电子显微镜观察和拍照,并测量外泌体直径。
1.4.3 外泌体表面标记蛋白分析 分别取各组等体积的BMSC-外泌体,使用蛋白抽提试剂盒提取总蛋白,并采用BCA法测定蛋白浓度。采用蛋白免疫印迹法检测BMSC-外泌体的表面标记蛋白CD9和CD63,取BMSC蛋白和BMSC-外泌体蛋白进行SDS-PAGE,每个样品设置6个复孔,每孔加入的总蛋白量相同;将凝胶上的蛋白湿转到硝酸纤维素膜上,加入2%牛血清白蛋白于室温下封闭2 h,然后加入兔抗鼠CD9、CD63一抗,于4 ℃孵育过夜,抗体使用比例分别为1 ∶800、1 ∶500;使用TBST溶液漂洗后加入辣根过氧化物酶标记IgG二抗,抗体使用比例为1 ∶1 000,于室温下孵育1 h,再次用TBST溶液漂洗,根据化学发光试剂盒说明进行显色。拍照后采用Image-J图像处理软件处理图片。
1.5 分离胰腺β细胞
诱导和给药结束后,将5组大鼠麻醉并在无菌条件下安乐死。用无菌磷酸盐缓冲盐水冲洗胰腺,取3只新鲜胰岛组织用于标志物检测。剩余组织用剪刀剪碎后加入以DispaseⅡ酶进行消化,使用新鲜配制的无菌D-Hanks液清洗,用PBS液调整细胞密度为5×103/100 μl,作为胰腺β细胞凋亡实验的准备。
1.6 TUNEL实验检测β细胞的凋亡
用TUNEL检测试剂盒检测β细胞的凋亡。细胞统计TUNEL阳性细胞核的数量和总细胞核数。每组3个载玻片中随机选择5个高倍视野(×200)来评估细胞凋亡率。
1.7 破骨细胞标记物RANK的免疫组化检测
将1.3中分离的骨髓组织制作石蜡块。切片后取石蜡切片,加入抗原修复液进行抗原修复。加入兔抗鼠的RANK一抗(抗体使用比例分别为1 ∶800)孵育20 min,用PBS洗涤3次,加入生物素标记山羊抗兔IgG二抗(抗体使用比例为1 ∶2 000)孵育2 h。根据DAB辣根过氧化物酶显色试剂盒说明进行显色。显色后用蒸馏水冲洗,再使用苏木精复染,于显微镜下观察,拍照后采用Image-Pro plus 6.0图像分析软件标记并统计的阳性表达RANK的细胞数,阳性标记为黄色、棕黄色、棕色。
1.8 实时荧光定量PCR检测miR-31a-5p和Bax mRNA、Bcl-2 mRNA的表达
用Trizol试剂提取分离5组β细胞和BMSC-Exo的总RNA。检测260 nm的吸光度来定量RNA的浓度。提取的总RNA(0.84 μg)用PrimeScript RT试剂盒在PCR仪上反转录合成cDNA。反转录PCR反应条件:16 ℃ 0.5 h,41 ℃ 0.5 h,85 ℃ 5 min,4 ℃循环。cDNA保存于4 ℃。qPCR反应体系为20 μl,其中引物10 μl、SYBR Green酶反应体系10 μl。扩增程序为:94 ℃预变性4 min,94 ℃变性,60 ℃退火2 min,45个循环,75 ℃下延伸1 min。胰岛组织中的Bax和Bcl-2基因使用内参基因为GAPDH,外泌体中的miR-31a-5p使用内参基因为U6。计算Ct值,用2-ΔΔCt计算相对表达量。实验设置6个复孔,并且重复3次。引物见表1。

表1 实时荧光定量PCR引物序列
1.9 蛋白免疫印迹检测E2F2和BMP-2蛋白表达
将5组大鼠的骨髓悬浮液进行充分匀浆。样品经过与上样缓冲液混合,在沸水浴中煮5 min,-20 ℃保存。用12%十二烷基硫酸钠聚丙烯酰胺凝胶分离蛋白质,并转移至聚偏二氟乙烯膜上。用5%脱脂奶粉封闭2 h后,将膜与兔抗E2F2(1 ∶500)、BMP-2(1 ∶600)、GAPDH(1 ∶5 000)蛋白第一抗体在4 ℃孵育过夜,在25 ℃下与辣根过氧化物酶偶联的二抗(1 ∶20 000)孵育2 h。使用SuperSignal West Pico化学发光底物对膜上的蛋白进行显色,通过Geliance 200显色系统进行拍照。使用Image J软件分析条带灰度值。GAPDH作为内参蛋白。实验重复3次。
1.10 ALP活性检测
根据ALP活性测定试剂盒提供的说明检查了1.3中分离的骨髓悬浮液中ALP的活性。将50 μl冷PBS与上清液混合并匀浆。随后在4 ℃微量离心机中13 000g离心15 min,上清液用20 μl终止液终止样品中的ALP活性,加入50 μl pNPP溶液(5 mmol/L)和10 μl ALP酶溶液,避光25 ℃孵育60 min。加入20 μl终止液终止反应,用酶标仪测450 nm处吸光度。
1.11 双荧光素酶基因报告实验
通过PCR扩增含有miR-31a-5p结合位点的E2F2 3′ UTR cDNA片段。将扩增产物克隆到荧光素酶基因终止密码子下游的PGL3载体中。E2F2的突变体(MUT)使用TaKaRa MutanBEST试剂盒(日本TaKaRa)构建。对于在BMSC细胞中进行的荧光素酶测定,使用Lipofectamine 2000将24孔板中的细胞与200 ng/孔荧光素酶报告基因构建体、400 ng/孔miR-mimic或其阴性对照(negative control, NC)共转染。5 ng/孔的海肾荧光素酶质粒作为内部对照。在转染后24 h收获细胞,根据制造商的说明用双荧光素酶报告基因检测试剂盒(上海碧云天)检测荧光素酶活性。
1.12 统计学分析
2 结果
2.1 BMSC-Exo的鉴定结果
BMSC-Exo的粒径分布是91~113 nm。CD9和CD63在BMSC-Exo表面均有表达;BMSC-Exo的结构是圆盘形囊泡状膜结构(见图1)。
2.2 T2DM大鼠的β细胞凋亡变化
与control组比,T2DM组大鼠体内β细胞的凋亡细胞数明显增加(P<0.01);大鼠胰岛组织中Bax mRNA表达量增加,而Bcl-2 mRNA表达量减少,差异均有统计学意义(P<0.01)。而与control组比,LIR组的上述指标的变化均差异有统计学意义(P>0.05)。与T2DM组比,LIR+T2DM组大鼠β细胞凋亡率明显降低(P<0.01),且胰岛组织中Bax mRNA表达量减少,而Bcl-2 mRNA增加(P<0.01)。与LIR+T2DM组比,与LIR+miR-mimic+T2DM组大鼠β细胞凋亡率明显增加(P<0.01),Bax mRNA表达量增加,而Bcl-2 mRNA减少,差异均有统计学意义(P<0.01,见图2和表2)。
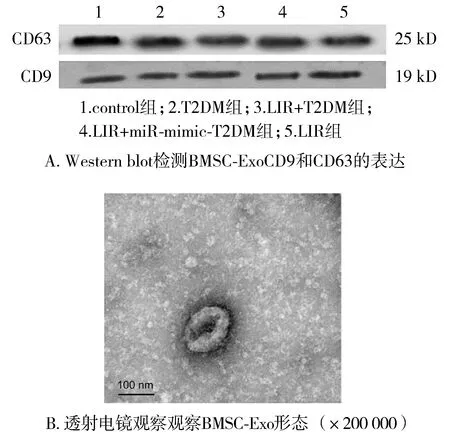
图1 骨髓间充质干细胞外泌体的鉴定Figure 1 Verification of bone marrow mesenchymal stem cell exosomes
2.3 T2DM大鼠的骨代谢变化
与control组比较,LIR组的破骨细胞数目(RANK标记)、成骨细胞标记物ALP活性、BMP-2的表达差异均无统计学意义(P>0.05)。T2DM组造模后大鼠骨髓中破骨细胞数目(RANK标记)增加,而成骨细胞标记物ALP活性和BMP-2的表达减少,差异均有统计学意义(P<0.01)。与T2DM组比,LIR+T2DM组骨髓中破骨细胞数(RANK标记)减少,而成骨细胞标记物ALP活性和BMP-2的表达增加,差异均有统计学意义(P<0.01)。与LIR+T2DM组比,与LIR+miR-mimic+T2DM组大鼠骨髓中破骨细胞数(RANK标记)增加,而成骨细胞标记物ALP活性和BMP-2的表达降低,差异均有统计学意义(P<0.01,见图3、图4和表3)。

绿色荧光为TUNEL染色的凋亡细胞,蓝色荧光为DAPI染色的细胞核图2 大鼠胰腺β细胞TUNEL染色 (×200)Figure 2 TUNEL staining of β cells in pancreas of rats (×200)
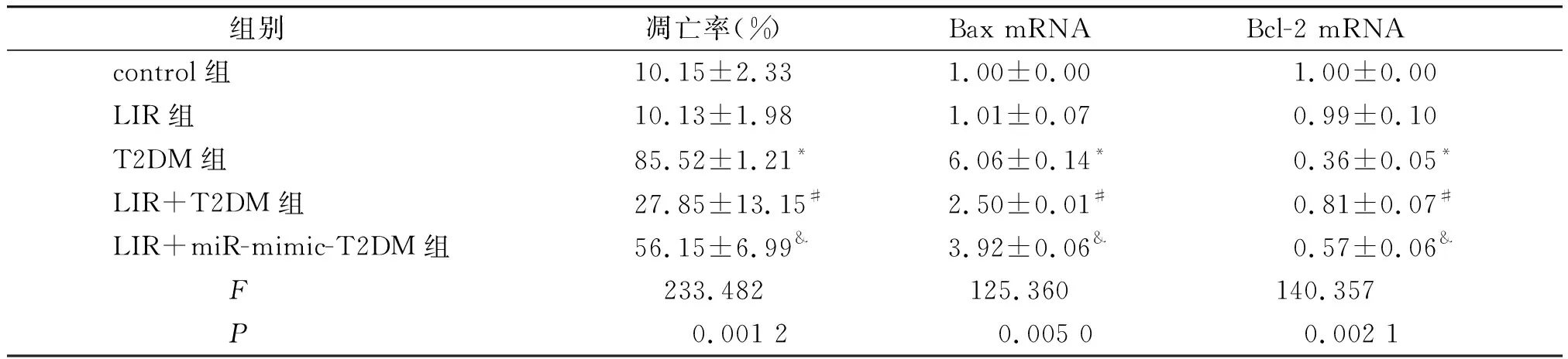
表2 T2DM大鼠细胞凋亡率及凋亡相关mRNA的表达变化
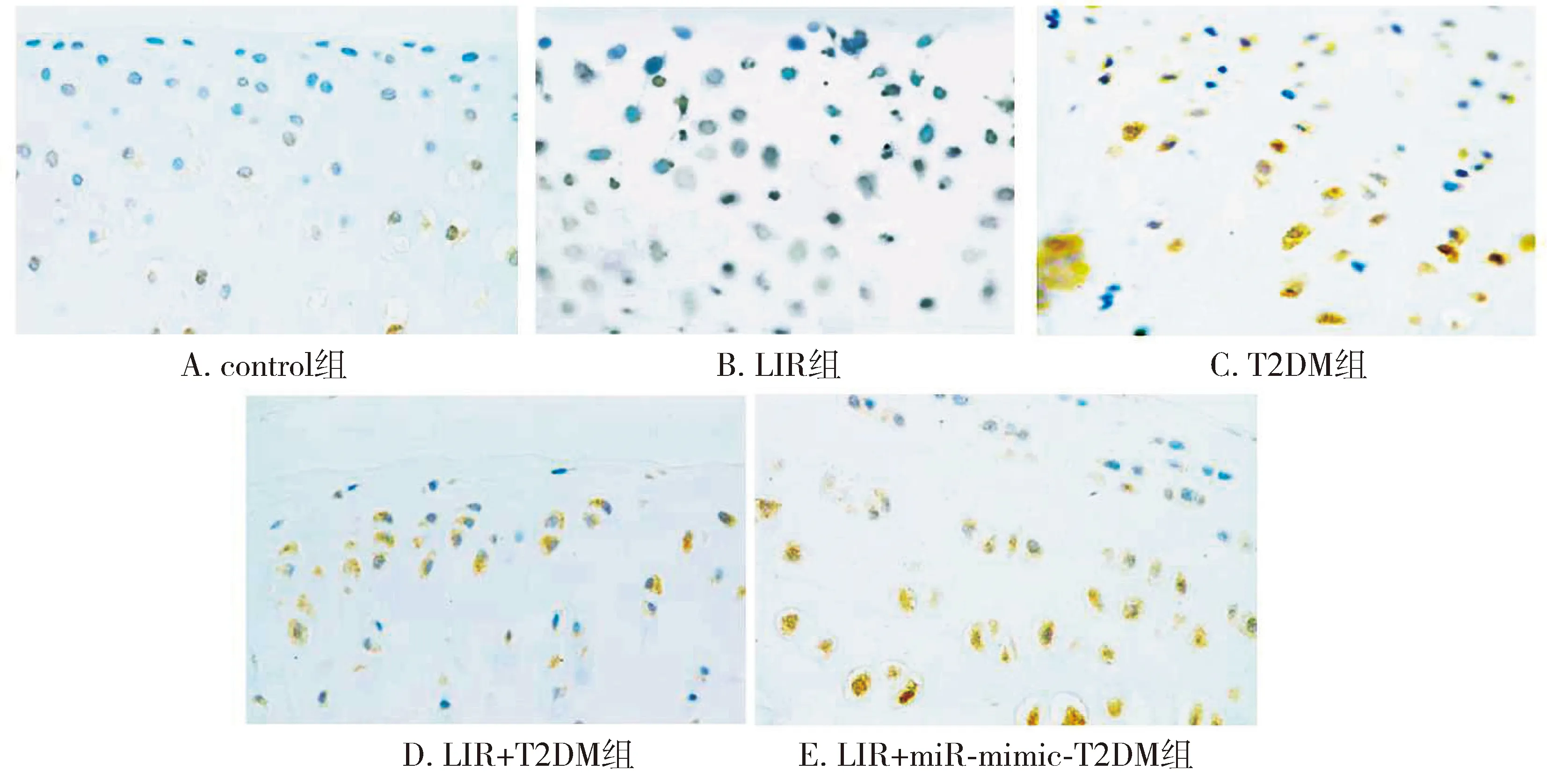
RANK染色以标记破骨细胞,其中黄色、黄棕色、黄褐色均为破骨细胞阳性,蓝色为破骨细胞阴性图3 破骨细胞标志物RANK的免疫组化染色检测结果 (×200)Figure 3 Immunohistochemical staining results of osteoclast marker RANK (×200)

图4 利拉鲁肽对2型糖尿病大鼠成骨细胞标志物BMP-2表达的影响Figure 4 Effect of LIR on the expression of osteoblast marker BMP-2 in type 2 diabetic rats
2.4 T2DM大鼠miR-31a-5p的表达
与control组比,T2DM组造模后外泌体中miR-31a-5p上调,差异有统计学意义(P<0.01)。与T2DM组比,LIR+T2DM组外泌体中miR-31a-5p下调,差异有统计学意义(P<0.01)。与LIR+T2DM组比,与LIR+miR-mimic+T2DM组外泌体中miR-31a-5p上调,差异有统计学意义(P<0.01)。另外,LIR组与control组比,miR-31a-5p的表达差异无统计学意义(P=0.479,见图5)。
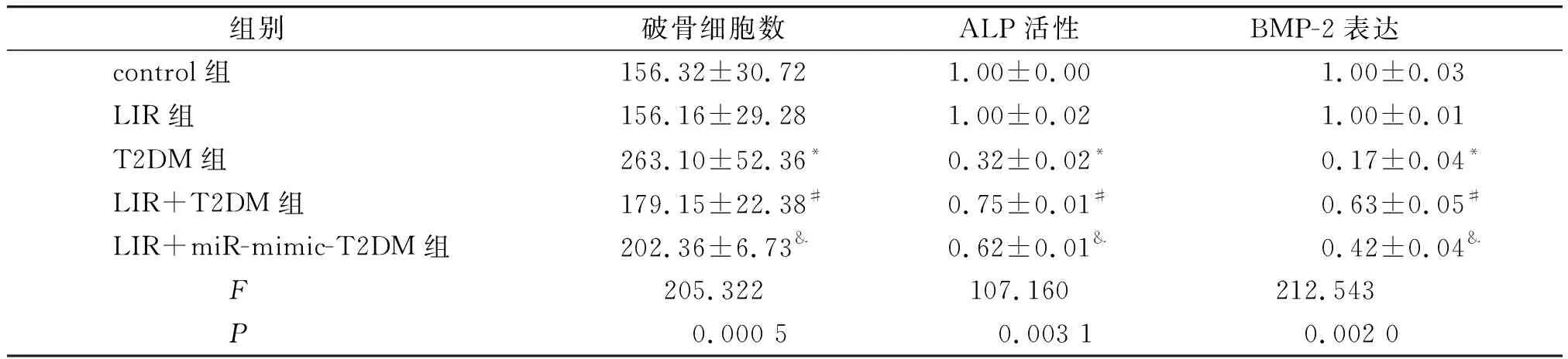
表3 T2DM大鼠体内破骨细胞数、ALP活性以及BMP-2的表达变化

与control比较,*P<0.05;与T2DM比较,#P<0.05;与LIR+T2DM比较,&P<0.05图5 miR-31a-5p在外泌体中的相对表达水平Figure 5 The relative expression levels of miR-31a-5p in exosomes
2.5 E2F2是miR-31a-5p的靶基因
生物信息学分析预测miR-31a-5p的靶基因是否为E2F2。蛋白免疫印迹结果显示,与control组比,T2DM组造模后外泌体中E2F2下调,差异有统计学意义(P<0.01)。与T2DM组比,LIR+T2DM组外泌体中E2F2上调,差异有统计学意义(P<0.01)。与LIR+T2DM组比,LIR+miR-mimic+T2DM组外泌体中E2F2下调,差异有统计学意义(P<0.01)。另外,LIR组与control组间比较,E2F2的表达差异无统计学意义(P>0.05,见图6)。
为确定miR-31a-5p是否直接与E2F2的3'UTR结合并引起翻译抑制,我们在293T细胞中采用了双荧光素酶报告基因检测,结果显示,miR-31a-5p直接与E2F2的3'UTR结合(见图7A)。而且,与E2F2突变组相比,E2F2野生组的报告基因在mimic处理后荧光素酶活性显著降低(P=0.003),但与E2F2突变组相比,E2F2野生组的报告基因在NC处理后荧光素酶活性差异无统计学意义(P=0.732,见图7B)。
3 讨论
本研究发现,T2DM大鼠的BMSC来源外泌体中miR-31a-5p表达明显上调,而E2F2的蛋白水平明显下调;同时发现LIR治疗T2DM组中miR-31a-5p的水平被抑制,而E2F2被上调。但是,单独使用LIR注射健康大鼠,并未观察到miR-31a-5p和E2F2的表达改变。我们在进一步的研究中发现,在BMSC中E2F2是miR-31a-5p的靶基因。使用miR-31a-5p的拟似物miR-mimic上调miR-31a-5p,观察到LIR对T2DM大鼠β细胞和骨代谢的改善作用被减弱,同时E2F2的表达明显下调。本研究表明,LIR通过调节T2DM体内BMSC来源外泌体的miR-31a-5p/E2F2从而改善T2DM大鼠β细胞损伤和骨代谢失衡。本研究为利拉鲁肽治疗T2DM的机制研究及BMSC-Exo在T2DM的临床治疗提供实验依据,本研究为T2DM的预防和治疗提供新的思路。

与control比较,*P<0.05;与T2DM比较,#P<0.05;与LIR+T2DM比较,&P<0.05图6 利拉鲁肽对2型糖尿病大鼠E2F2表达的影响Figure 6 Effect of LIR on the expression of E2F2 in type 2 diabetic rats
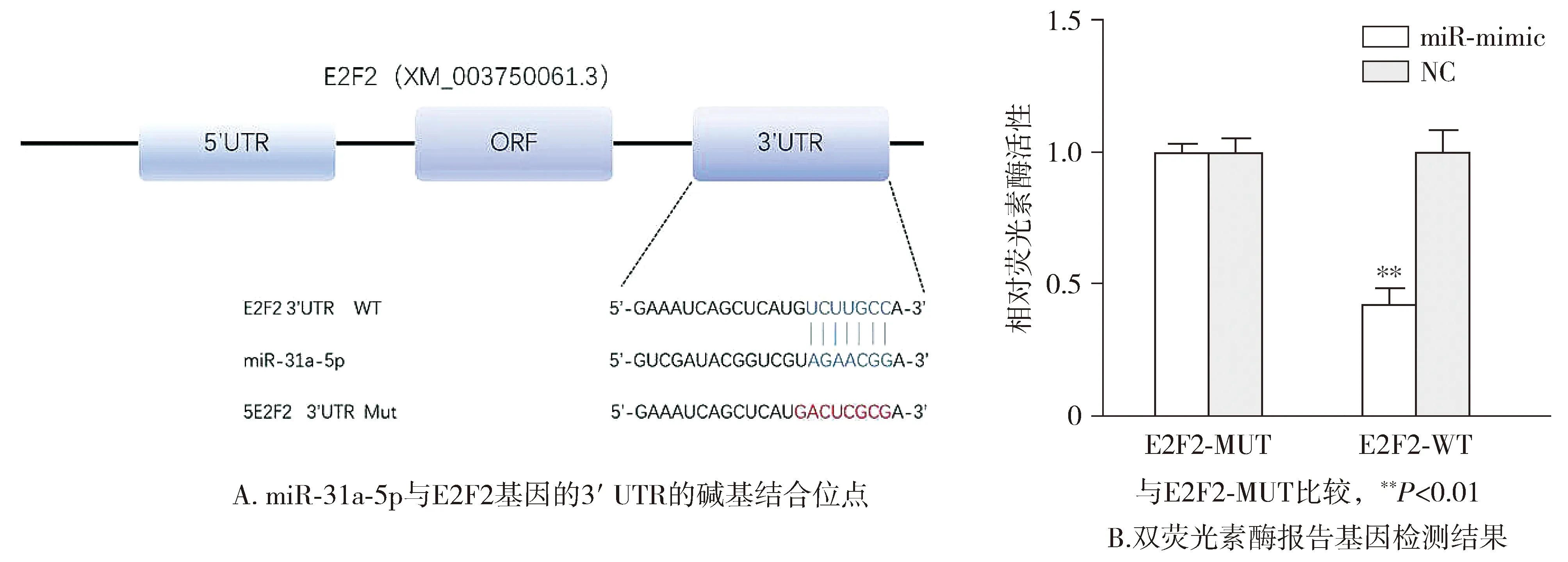
图7 miR-31a-5p靶向E2F2基因Figure 7 miR-31a-5p targets E2F2 gene
从目前的已发表的证据可知,LIR治疗对T2DM大鼠的β细胞损伤和骨代谢失衡均有明显的改善作用[4,14]。Li等[13]在观察了T2DM大鼠的骨髓外泌体的miRNA谱后发现,LIR治疗可导致miRNA谱发生明显改变。经生物信息学分析,这种miRNA的改变可直接靶向胰岛素分泌和胰岛素信号通路[13]。表明LIR可能通过改变骨髓外泌体miRNA的表达调节胰岛β细胞的功能。另外,证据显示,在衰老且骨代谢失衡的骨髓组织中BMSC来源外泌体中携带的miR-31a-5p表达增加,而且miR-31a-5p通过促进细胞衰老形成并损害BMSC的功能导致成骨细胞的减少并进一步抑制转录因子E2F2[12]。本研究在T2DM模型中观察到了类似的结果,T2DM大鼠造模后14 d和21 d的BMSC外泌体中miR-31a-5p的表达均增加,而外泌体中的E2F2的蛋白水平明显下调。结合上面miRNA表达谱的证据,我们假设LIR可以改变T2DM中的miR-31a-5p的表达和E2F2的蛋白水平。本研究的结果与假设的一致,T2DM大鼠在给予LIR后,我们观察到BMSC外泌体中miR-31a-5p的表达均明显下调以及E2F2明显上调。以上研究表明,LIR可以抑制T2DM大鼠BMSC外泌体中的miR-31a-5p并上调E2F2。
另外,本研究得到一个关键的证据,LIR通过调节BMSC外泌体中的miR-31a-5p/E2F2信号轴改善了T2DM大鼠β细胞损伤和骨代谢失衡。外泌体参与微环境内遗传信息的交换。特别是,miRNA在外泌体介导的信息运输中起着至关重要的作用[15]。这些发现有助于理解LIR的骨保护机制和β细胞调节机制[15]。研究发现,E2F2转录因子缺陷的小鼠可发展出非自身免疫性,胰岛素依赖型糖尿病。而且,野生型骨髓的移植可以预防或挽救E2f2-/-小鼠的糖尿病[16]。在本研究中LIR明显恢复了T2DM大鼠BMSC中外泌体E2F2的表达。而且我们的研究表明LIR很可能通过抑制miR-31a-5p从而促进E2F2蛋白水平的增高,其原因是我们通过荧光素酶报告基因法证实E2F2在BMSC中是miR-31a-5p的靶基因。
在过去的10多年中,miRNA通过影响mRNA的翻译和稳定性迅速成为基因表达的重要调节剂[17]。本研究证实了E2F2是miR-31a-5p在BMSC中的靶基因。而且miRNA可以通过调节靶基因诱导多种细胞过程的变化,包括细胞增殖、细胞分化和细胞衰老[18,19]。但是,它们在细胞外环境中的不稳定性限制了它们的应用。外泌体是一种具有磷脂双分子层膜的囊泡,可保护miRNA免受降解,并在细胞之间转移它们,从而调节细胞间的通讯。本研究表明,T2DM大鼠BMSC外泌体的miR-31a-5p被明显上调。已有报道显示外泌体中的miR-31a-5p与骨髓微环境中的骨生成和骨吸收有密切关系,其中抑制BMSC外泌体中的miR-31a-5p可以减少破骨细胞的生成,增加成骨细胞的生成,这种双重调节表明,miR-31a-5p在骨骼形成和骨骼吸收中均起着至关重要的调节作用[12]。本研究观察到T2DM大鼠给予LIR后,BMSC外泌体中的miR-31a-5p的水平明显下降,并伴随破骨细胞数目减少以及β细胞的凋亡率下降,而使用miR-mimic恢复miR-31a-5p的表达后,骨髓中破骨细胞数目和β细胞的凋亡率均增加。这些结果表明LIR可通过抑制BMSC外泌体的miR-31a-5p水平改善β细胞损伤和骨代谢失衡。
本研究仍存在一定局限性,首先,样本量不足,仍需要进一步扩大动物的样本量和种类进行验证,并且在多种β细胞中反复观察,以确定本研究结果的普遍适用性。其次,缺乏LIR治疗糖尿病并涉及外泌体机制研究的文献报道,以此为契机,本研究为外泌体转运的信号机制参与调控糖尿病治疗等研究提供了新的研究基础。在后续研究中,本课题组将加大样本量,并利用不同的糖尿病动物模型更进一步加强对LIR治疗糖尿病后BMSC的外泌体转运的信号机制进行深入研究。
综上所述,本研究结果表明LIR通过调控T2DM大鼠BMSC中外泌体miR-31a-5p/E2F2信号轴从而对T2DM大鼠的β细胞损伤和骨代谢失衡具有调控作用。本研究为LIR临床治疗T2DM提供了潜在的治疗机制,为LIR的治疗效果评估和机制探究提供了研究基础。

