生物支架联合嗅鞘细胞移植治疗脊髓损伤的研究进展
郭 栋,杨于冰,贺西京,李嘉熙,谭清华,刘东藩,常素娥
(西安交通大学第二附属医院骨二科,西安 710004;*通讯作者,E-mail:xijing_h@vip.tom.com)
脊髓损伤(spinal cord injury,SCI)时,神经元受到原发性机械性损伤,继发性引起炎症反应、脂质过氧化、局部缺血、自由基产生、神经胶质瘢痕形成和轴突脱髓鞘等,严重抑制了神经功能的恢复和轴突再生[1]。SCI的大量研究已经证明,移植到受伤脊髓中的嗅鞘细胞(olfactory ensheathing cells,OECs)能够促进轴突的再生[2]。OECs是一种特殊的神经胶质细胞,兼有星形胶质细胞、少突胶质细胞和施万细胞等的多重功能,其神经修复能力优于其他类型胶质细胞,同时表现出向损伤区迁移的作用,具有促进轴突再生,重建神经环路的能力。OECs还具有分泌神经营养因子,刺激髓鞘再生和吞噬作用。这些OECs的生物学特性使其在治疗SCI中应用广泛[3]。
细胞移植可以促进支架整合和提高损伤神经再生潜能。生物支架可以创造适合细胞迁移和分化的三维环境和为细胞递送营养物质,同时桥接受伤的脊髓,在结构和化学上支持轴突再生,最终改善患者生活质量[4]。生物支架联合OECs的治疗策略已取得一定进展。本文针对生物支架联合OECs在SCI修复中的研究进展进行阐述,展示了OECs联合生物支架治疗SCI的发展趋势,并对目前存在的问题进行了讨论。
1 OECs的生物学功能
越来越多的研究表明,OECs可以促进轴突再生和重建神经回路,最终实现SCI功能恢复。同时,OECs还可以分泌神经营养因子等发挥神经保护作用。OECs的迁移特性、再髓鞘化和免疫调节作用也越来越被重视。OECs具有以下生物学功能[2,5]:①神经营养作用:OECs移植到SCI损伤区后能够提供大量的神经营养分子。有文献报道OECs可以分泌脑源性神经生长因子、神经生长因子-3等,可有效促进神经元存活和轴突延伸,实现损伤区的长距离跨越[5]。②调节炎症反应:首先OECs可以吞噬坏死神经碎片改善局部炎症微环境,同时OECs移植可以促进白细胞介素4和白细胞介素13等抗炎细胞因子表达,抑制白细胞介素6和肿瘤坏死因子-α等炎症因子的表达,从而促进神经元存活和神经轴突延伸。③迁移作用:OECs可以实现在损伤区的纵向和横向迁移,而不受胶质瘢痕的阻碍。更吸引人的是,OECs可以通过伴随神经轴突的生长而实现长距离迁移,OECs的迁移特性可能在中枢神经损伤后神经纤维再生中起关键作用。④再髓鞘化:SCI后的中枢神经轴突通常不能延伸并与靶细胞重新连接,但移植的OECs可以与新生轴突进行整合,实现髓鞘的再形成。⑤异质性:OECs通常从嗅球或者嗅黏膜提取,而不同来源的OECs在体内移植后的神经保护和神经再生过程中发挥不同的作用。充分发挥不同来源OECs的优势和生物支架联合应用为治疗SCI提供了新的路径。
2 天然聚合物生物支架联合OECs治疗SCI
天然聚合物生物支架通常能与受伤的脊髓良好整合,不会引起剧烈的炎症反应。此外,天然聚合物可以很好地模拟脊髓本身的微环境。已经用于OECs移植治疗SCI的天然生物材料有胶原蛋白、纤维蛋白、丝素蛋白、海藻酸盐、壳聚糖等。OECs联合天然聚合物生物支架治疗SCI的相关研究见表1[6-14]。
2.1 胶原蛋白
胶原蛋白是细胞外基质蛋白的最大组成部分。明胶来源于胶原蛋白水解,并含有精氨酸-甘氨酸-天冬氨酸等基序。与不含明胶的水凝胶相比,将明胶混合到聚合物中可促进轴突延伸,还为脊髓背根神经节提供了更高的黏附力。据报道,负载神经干细胞的胶原支架在T8 SCI大鼠模型中还可促进神经再生和运动功能的恢复[15]。同时,胶原蛋白已被用于负载OECs的复合支架,表现出促进OECs的附着、增殖和减少细胞的凋亡[11]。

表1 OECs联合天然聚合物生物支架治疗脊髓损伤的实验研究
2.2 纤维蛋白
纤维蛋白是一种纤维状和非球状蛋白,已被广泛用作神经组织工程研究中的生物支架[16]。含有神经营养因子-3的纤维蛋白支架在SCI后2周接受延迟治疗后促进神经纤维再生[17]。在另一项研究中,纤维连接蛋白在脊髓半切模型中被证明支持再髓鞘化和轴突生长[18]。体外实验结果显示基于纤维蛋白的生物支架可以促进OECs黏附、增殖和延展,同时提高脊髓背根神经突起的生成[7,10]。虽然基于纤维蛋白的OECs复合生物支架并没有在SCI的动物模型中进行研究,但是仍表现出巨大的潜力。
2.3 丝素蛋白
丝素蛋白是一种天然生物聚合物,具有高生物相容性和低免疫原性以及足够的生物降解性和弹性模量,适合体内应用[19]。有研究显示丝素蛋白可以促进细胞附着和周围神经的再生[20]。此外,还有实验证明了基于丝素蛋白的水凝胶可以支持神经元生长以进行中枢神经组织修复[21]。至关重要的是,丝素蛋白纤维可以引导神经元生长的方向[22]。同时,负载间充质干细胞的多孔丝素蛋白支架可以促进脊髓损伤后大鼠的轴突再生和髓鞘形成,这比单通道的支架更具优势[23]。在Wu等[6]的研究中,基于丝素蛋白的生物支架促进了OECs的黏附、生长、增殖和迁移。此外,丝素蛋白可以减轻损伤局部组织的炎症反应和氧化应激,同时显示出缓慢的生物降解速率,这更拓展了丝素蛋白在OECs治疗脊髓损伤中的应用,具有良好的应用前景[24]。
2.4 壳聚糖
壳聚糖是通过甲壳素脱乙酰化获得的天然阳离子多糖,可设计为细胞调节、生长和分化的支架,已经广泛开发为神经再生领域中有前途的替代治疗策略。壳聚糖的上述功能是由于其独特和吸引人的性质,如相容性、生物降解性、无毒、通过支架/纳米颗粒控制神经营养因子或干细胞的释放[25]。同时,壳聚糖支架可以起到很好的支撑和桥接作用,不但能抑制瘢痕组织的形成,还能介导神经再生和促进SCI后运动功能的恢复[26]。Liu等[27]开发了一种由壳聚糖、透明质酸衍生物和基质胶构成的新型生物墨水,利用3D生物打印技术制造了含有神经干细胞的生物支架,并首次在动物试验中探索了它们在SCI修复中的应用。在Zhu等[28]的研究中显示,负载OECs的生物支架可以促进细胞黏附、扩散和增殖,神经营养蛋白的分泌,促进背根神经节生长,促进轴突再生和功能恢复。然而,基于壳聚糖的水凝胶在应用时,巨噬细胞可以被壳聚糖中存在的N-乙酰葡糖胺的受体介导激活引起炎症反应,这可能限制了壳聚糖在脊髓损伤中的应用[29]。在此,基于OECs和壳聚糖的生物支架的研究较少。
2.5 海藻酸盐
海藻酸是一种天然存在于某些褐藻物种中的酸性线型多糖。这种亲水、可生物降解、生物相容且无免疫原性的多糖水凝胶被用作脊髓生物支架[11]。海藻酸盐水凝胶可以成功递送干细胞,将交联的海藻酸盐植入完全横断的脊髓中有助于轴突生长和胶质瘢痕减少[30]。然而,基于多糖的水凝胶由于缺乏用于细胞黏附的必需蛋白质组分而具有局限性,因此它们通常被修饰或与蛋白质结合,如通过添加精氨酸-甘氨酸-天冬氨酸结合肽(the integrin-binding peptide arginine-glycine-aspartic acid,RGD)来促进细胞的黏附[11]。最早在Novikova等[10]的研究中将海藻酸盐和纤维连接蛋白联合应用作为负载OECs的生物支架,促进OECs增殖,改善脊髓背根神经节的生成。在后来的进一步研究中,RGD肽修饰的海藻酸盐可以促进OECs的存活和黏附[11]。组织工程和再生医学的主要挑战之一是能够保持最佳细胞功能和移植后存活,在此,海藻酸盐作为OECs的载体在治疗SCI的应用中具有巨大的潜力。
3 人工合成生物支架联合OECs治疗SCI
人工合成生物支架可以根据研究者的需求进行精准定制,如设计特定的降解时间、孔隙率和物理结构。此外,人工合成生物支架通常不会引起免疫排斥反应。与天然聚合物相比,人工合成材料能够被大批量生产,可以降低生物支架的使用成本。已经用于OECs治疗SCI的人工合成的生物材料有聚乳酸-羟基乙酸共聚物(PLGA)、聚乙二醇(PEG)、自组装肽(SAPs)、聚吡咯(PPy)等。OECs联合人工合成生物支架治疗SCI的相关研究见表2[31-37]。
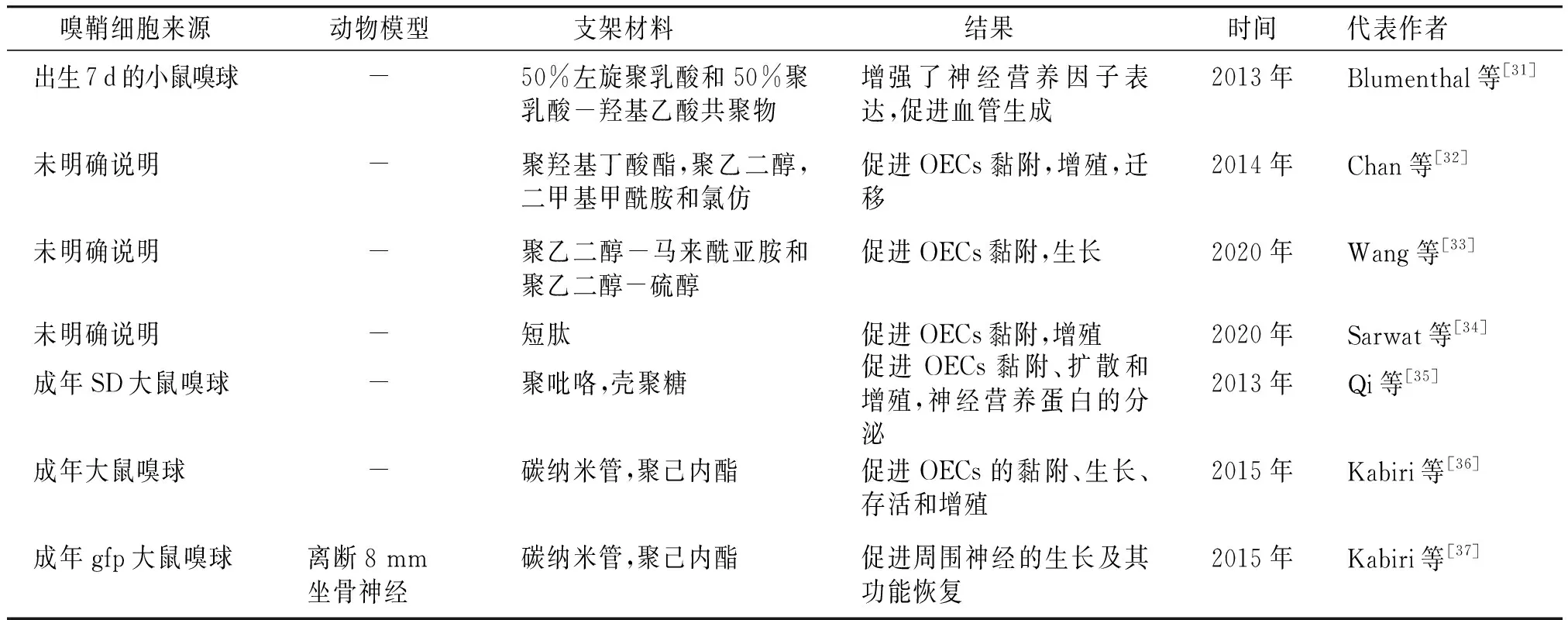
表2 OECs联合人工合成生物支架治疗脊髓损伤的实验研究
3.1 聚乙二醇
聚乙二醇(PEG)是一种无毒、亲水的合成聚合物。这种低免疫原性聚合物通过保护细胞完整性和减少SCI急性期炎症因子的释放来减轻炎症反应并抑制局部胶质瘢痕生成[38]。而且,PEG是生物医学应用中最常用的合成聚合物,可以作为水凝胶增强弹性模量的添加材料,同时具有支持胶质细胞生长、新生血管形成以及有髓轴突在损伤区的再生[39]。除此之外,PEG还可以通过改性被设计成不同的降解率,增加细胞黏附[4]。在Chan等[32]的研究中,基于PEG的生物支架表现出可以促进OECs黏附、增殖、迁移的作用。在最近的一项研究中,Wang等[33]设计的细胞黏附肽修饰的多孔PEG水凝胶可以引导OECs的定向迁移。
3.2 聚乳酸-羟基乙酸共聚物
聚乳酸-羟基乙酸共聚物(PLGA)是聚乳酸和聚乙醇酸的合成共聚物,具有生物相容性和可生物降解性[40]。由PLGA微球组成的透明质酸生物支架被植入半切的大鼠脊髓中,表现出植入物与脊髓组织的良好整合,同时抑制了炎症反应和胶质瘢痕的形成[41]。但是Li等[42]将负载OECs的PLGA支架植入损伤区后观察12周,没有观察到坐骨神经功能的恢复。这可能是因为PLGA的分解会产生乙醇酸和乳酸,改变了损伤局部的pH值,抑制了神经组织的修复过程,这可能限制了它作为OECs载体在组织工程中的应用。
3.3 自组装肽
自组装肽(SAPs)可以自发形成组织良好的纳米结构,这种特性对于广泛的生物医学应用非常有利。对于神经损伤,SAPs具有良好的生物相容性,可以为神经细胞的存活和延展提供适当的三维环境,同时可以设计成具有营养因子缓释功能的多功能支架[43]。此外,SAPs可以提供有利于细胞增殖和分化的微环境,以及神经网络重建和受损神经的功能恢复[44]。用于SAPs的最常见序列是RGD、异亮氨酸-赖氨酸-缬氨酸-丙氨酸-缬氨酸(isoleucine-lysine-valine-alanine-valine,IKVAV)、酪氨酸-异亮氨酸-甘氨酸-丝氨酸-精氨酸(tyrosine-isoleucine-glycine-serine-arginine,YIGSR)和RADA16自组装肽(16-amino acid Type I-SAP,RADA16)。IKVAV和RGD可以促进受损神经的细胞分化、黏附和轴突生长[45,46]。有研究发现基于RGD的生物支架提高了OECs的存活率[11]。同时在Zhang等[8]的研究中,将RADA16和RGD引入自组装的纳米纤维水凝胶中,促进OECs的黏附、增殖和减少神经细胞凋亡。在其他研究中发现,将IKVAV和RADA16复合形成一种新型纳米纤维水凝胶,可以增强轴突延伸,细胞附着和神经再生[45,47]。
3.4 导电聚合物
导电聚合物在神经组织工程领域应用广泛。聚吡咯(PPy)可以通过与其他材料混合制成不同的导电复合生物支架[35]。此外,聚己内酯通常用于静电纺丝的制备[37]。静电纺丝技术用于制作管状、多孔等形式的纤维,可以与多种材料结合使其功能化,包括蛋白质(如胶原蛋白和层粘连蛋白)、导电物质、细胞黏附肽(如RGD,IKVAV和YIGSR)[48]。通过物理或共价连接方法将蛋白质与导电物质如碳纳米管或PPy进行交联构建复合生物支架可以促进细胞黏附、轴突伸长、细胞迁移、信号传递和SCI后运动功能的恢复[49]。
有研究发现,在直径为1 μm的静电纺丝纤维上培养时,来自大鼠脊髓背根神经节的神经突起延长最大,同时大量研究表明微米级的纤维直径更适合于轴突的延伸(>750 nm)[49,50]。此外,与随机方向的纺丝相比,定向对齐的纺丝更能促进血管形成、轴突再生和更好的髓鞘形成,从而导致更快的运动功能恢复[51,52]。Qi等[35]的研究显示,PPy和壳聚糖组成的复合支架在体外实验中证明了可以促进OECs黏附、扩散和增殖,以及神经营养因子的分泌。在最近的研究中发现,导电复合支架可以促进OECs的黏附和迁移[53]。同样在应用碳纳米管的研究中发现其可以促进OECs的黏附、生长、存活和增殖[36]。总之,结合静电纺丝工艺和水凝胶的优势在脊髓损伤修复中具有巨大潜力。
4 脱细胞生物支架
脊髓本身的复杂结构在基本的化学反应中很难复制,因此研究者开始尝试将脊髓本身的细胞去除来获取其三维结构。脱细胞支架及其衍生物(水凝胶等)可以保留脊髓组织中的特异性组分,包括关键的结构和功能蛋白[54]。
脱细胞支架可以促进神经元黏附、迁移、增殖、分化,并诱导血管生成。Liu等[55]结合脱细胞脊髓和温敏水凝胶的优点,提供了一种多功能仿生脊髓支架,使外源生长因子持续释放,同时具有以脱细胞基质为核心的灰质和以缓释碱性成纤维细胞生长因子温敏水凝胶为白质的灰白质区域。在最近的一项研究中发现脱细胞支架联合OECs可以促进损伤部位的轴突再生[56]。移植进入的OECs可以跨越胶质瘢痕,在脊髓损伤后桥接病变部位,并为轴突再生提供条件,同时更好地发挥了OECs本身的神经保护作用,增强神经元存活,并促进损伤部位轴突的再生[56]。但是,脱细胞支架在OECs移植治疗脊髓损伤的应用中依然较少。
5 问题与展望
脊髓损伤仍然是一种在临床上难以治疗的病理生理学疾病。生物支架的应用可以减少胶质瘢痕,并为促进细胞生长和分化提供空间[57]。然而,许多挑战仍未解决。生物材料的优点和缺点使得支架的选择非常困难,这在OECs中的应用更加困难。
OECs通常来源于原代嗅觉神经系统,当OECs植入脊髓损伤局部后,不断恶化的微环境导致移植的OECs逐渐死亡,神经再生很少[58]。因此,制定有效的策略来加强OECs的治疗潜力,包括促进OECs增殖和分泌神经生长因子和抗炎因子的能力,具有极其重要的意义[2]。在本团队的前期研究中发现OECs可以通过分泌神经营养因子改变SCI后损伤区的局部微环境,进而减轻胶质瘢痕的形成,还可以通过抑制硫酸软骨素蛋白聚糖的表达和促进生长相关蛋白43的表达,促进SCI后的轴突再生,更加拓展了OECs治疗SCI的应用前景[59]。用于OECs的生物支架已经有了很多研究,同时取得了可靠的研究基础,但是并没有在临床试验中进行研究。它们有效地转化用于人体可能需要一定的时间。另一方面,在对生物支架的研究中,大多数研究者并没有对不同来源的OECs进行比较,如嗅球来源的OECs和嗅黏膜来源的OECs。大量研究显示嗅球来源的OECs表现出对神经再生和轴突延伸具有更强的作用,而嗅黏膜来源的OECs在炎症反应的调节、防御反应、细胞迁移等过程中起着关键作用[5]。对此,本文也对在生物支架研究中OECs的不同来源进行了总结,可以供研究者参考。未来可以进一步探索不同生物材料及物理结构对不同来源OECs生物学功能的影响。目前的研究表明,OECs在体内和体外的表达不同,例如,在体外,OECs作为神经营养生长因子的来源促进轴突生长;在体内,它们可以与新生轴突进行整合,实现髓鞘的再形成[60]。同时大量的研究仍局限于体外实验,这说明仍然需要大量的动物实验去证明基于OECs的生物支架在治疗SCI中的作用。此外,利用前沿生物打印技术与细胞移植相结合也能进一步提高OECs的治疗效果。本团队也在积极探索构建多功能多响应式水凝胶,为进一步在治疗SCI中应用创造条件[61]。
未来的研究方向可能集中在以下几个方面:首先构建合适的促神经生长药物递送系统与OECs移植相结合,可以提高OECs治疗SCI的效果。此外,探索更微创的细胞递送策略以改善神经系统内的再生,最大限度地减少SCI后的二次损伤也是很有必要的,在未来可以利用微流控技术构建“肽-OECs-水凝胶”水凝胶微球实现药物和细胞的微创递送。同时,探索OECs来源的外泌体或联合其他细胞共同用于细胞移植治疗SCI也具有巨大的潜力。在神经修复领域中的大量研究显示导电聚合物可以引导轴突定向延伸,从而促进神经再生,这意味着导电复合生物支架在脊髓损伤修复过程中具有重要的作用,通过添加导电聚合物与其他生物材料联合应用探索OECs的定向迁移与归巢机制也是很有潜力的研究方向。最后,基于生物3D打印技术制造的支架可以精确地适合不规则的病变部位,同时可以通过模仿脊髓白质和灰质不同的神经元密度和分布构建三维仿生人工脊髓,是一项令人惊喜的发现。基于OECs的生物3D打印支架却没有进一步研究。将OECs作为生物3D打印支架的种子细胞之一,同时结合多种细胞不同的生物学特性实现多细胞3D打印构建新型三维仿生人工脊髓可以为未来实现精准医疗奠定基础。总之,基于OECs的复合三维仿生支架仍然值得研究者去进一步探索。

