内质网应激参与调控肺心病心肌细胞线粒体途径凋亡
单 虎,张 蓉,张秋红,杨 侠,陈海娟,张 洁,李雅莉,张 明*
(1西安交通大学第二附属医院呼吸与危重症医学科,西安 710004;2陕西省人民医院消化内一科;#共同第一作者;*通讯作者,E-mail:zhangmingdr@163.com)
慢性肺源性心脏病是慢性阻塞性肺疾病、肺间质纤维化等慢性呼吸系统病的常见并发症,由于缺乏有效的防治措施,该病死亡率较高,5年生存率仅32.4%[1]。慢性缺氧是慢性肺源性心脏病的主要病因,目前认为慢性缺氧主要通过诱导肺动脉高压和心肌细胞直接损伤两种途径参与慢性肺源性心脏病的发病过程[2,3]。心肌细胞是一种高度依赖氧气和能量的组织细胞,在缺氧微环境中,心肌细胞在细胞器水平迅速进行适应性调节,如线粒体中代谢相关酶活性改变、线粒体质量控制、内质网应激、线粒体非折叠蛋白反应等。线粒体和内质网作为维持心肌细胞功能的重要细胞器,可以在线粒体-内质网结构耦联这一功能平台上实现交互作用,继而参与细胞内钙信号调控、线粒体形态调节、内质网应激、脂质合成和转运等功能。当心肌细胞长期处于缺氧微环境时,线粒体和内质网适应性调节无法维持心肌细胞功能,最终诱发心肌细胞自噬和凋亡[4-7]。然而,内质网应激是否参与慢性缺氧诱使心肌细胞线粒体途径凋亡尚未见研究证实。本研究拟通过构建慢性缺氧大鼠模型探索内质网应激在慢性缺氧诱导线粒体途径心肌细胞凋亡过程中的作用和机制,为研究慢性肺源性心脏病发病机制和治疗靶点提供理论依据。
1 材料与方法
1.1 实验动物与分组
8周龄清洁级雄性Wistar大鼠24只,体质量200~250 g,购于西安交通大学医学部实验动物中心(许可证号:SCXK(陕)2018-001)。大鼠饲养环境温度(25±1)℃,相对湿度60%~80%,自由进食进水。适应性喂养1周,将大鼠随机分为对照组、低氧组和干预组。对照组大鼠24 h均在普通饲养笼中喂养,每天给予生理盐水灌胃;低氧组大鼠在玻璃饲养笼中喂养,笼内氧浓度由气体浓度控制器(上海塔望智能科技有限公司)控制,每天固定8 h将氧浓度降至10%±0.5%,其余16 h内氧浓度等同于实验室空气,同时每天给予生理盐水灌胃;干预组大鼠喂养方式同低氧组,每天给予4-苯基丁酸(4-PBA)混悬液(0.5 mg/kg)灌胃。三组大鼠均连续喂养21 d,并称重记录。
1.2 主要试剂
高质纯化线粒体分离试剂盒(上海杰美基因医药科技有限公司),组织蛋白裂解液(武汉博士德生物工程有限公司),线粒体膜电位检测试剂盒(上海碧云天生物技术有限公司),TUNEL细胞凋亡原位检测试剂盒(武汉博士德生物工程有限公司),4-苯基丁酸(4-Phenylbutyric acid,4-PBA,ERS抑制剂,美国Sigma公司),抗葡萄糖调节蛋白78(glucose-regulated protein 78,GRP78)兔多克隆抗体购自北京博奥森生物技术有限公司(bs-1219R),抗CCAAT/增强子结合蛋白同源蛋白(CCAAT/enhancer-binding protein homologous protein,CHOP)兔多克隆抗体购自美国Sigma公司(SAB5700602),抗Bcl-2兔多克隆抗体购自武汉三鹰生物技术有限公司(26593-1-AP),抗GAPDH兔多克隆抗体购自杭州贤至生物有限公司(AB-P-R 001),抗细胞色素C兔多克隆抗体购自武汉博士德生物工程有限公司(BM4571),抗COXⅣ兔多克隆抗体购自武汉博士德生物工程有限公司(A05442-1),HRP标记羊抗兔二抗购自武汉博士德生物工程有限公司(BA1054),Hoechst 33258细胞核探针购自美国Sigma公司。
1.3 心脏称重评估心脏肥大情况
三组大鼠喂养21 d后称重,腹腔注射10%水合氯醛麻醉大鼠,开胸充分暴露心脏,从主动脉及肺动脉根部分离并取出心脏,此后操作在冰面上进行。用4 ℃ PBS溶液冲洗心腔内血液至澄清,滤纸吸除水分后称重。用眼科剪分离心包、脂肪组织、心房、右心室、室间隔和左心室,将右心室组织吸干后称重,以右心室质量所占比例反映右心肥大情况。取部分新鲜右心室组织用于提取心肌组织线粒体以检测线粒体膜电位水平和线粒体内蛋白质表达水平,剩余组织置于液氮并-80 ℃冰箱保存,用于提取心肌组织总蛋白。
1.4 线粒体提取
称取新鲜右心室组织0.5 g,按照高质纯化线粒体分离试剂盒说明书分离并纯化线粒体,向提取的新鲜心肌组织线粒体混悬液中加入0.2 ml预冷的保存液,轻柔吹打重新悬浮线粒体,随后进行蛋白定量。用含100 μg蛋白质的线粒体进行膜电位检测,剩余线粒体用于裂解提取蛋白质。
1.5 线粒体膜电位检测
在避光环境下使用JC-1荧光探针用于检测线粒体膜电位,按照线粒体膜电位检测试剂盒说明书操作,首先制备JC-1染色工作液,向0.1 ml新鲜提取的含100 μg蛋白质的线粒体中加入0.9 ml JC-1染色工作液,混匀,37 ℃孵育20 min,离心弃上清,用染色缓冲液洗涤2次。用荧光酶标仪分别设定激发波长525 nm,发射波长590 nm测定红色荧光值,设定激发波长490 nm,发射波长530 nm测定绿色荧光值。红色与绿色荧光比值代表线粒体膜电位水平。
1.6 Western blot法测定蛋白表达水平
组织匀浆法获取右心室心肌组织总蛋白,线粒体溶解液提取线粒体总蛋白,用Bradford法蛋白定量。取40 μg蛋白质变性后经SDS-PAGE凝胶电泳分离,转印至PVDF膜,用含10%脱脂奶粉的PBST室温封闭2 h,分别用GRP78抗体(1 ∶1 000稀释)、CHOP抗体(1 ∶2 000稀释)、bcl-2抗体(1 ∶800稀释)、GAPDH抗体(1 ∶1 000稀释)、细胞色素C抗体(1 ∶1 000稀释)、COXⅣ抗体(1 ∶1 000稀释)孵育4 ℃过夜,用1 ∶20 000稀释的HRP标记二抗37 ℃孵育2 h。使用ECL发光试剂盒进行显色,用Image Plus Pro图像处理软件进行灰度分析。
1.7 TUNEL法检测细胞凋亡
常规石蜡包埋右心室组织,用3%双氧水处理,按照TUNEL细胞凋亡原位检测试剂盒操作,先后用1 ∶100倍稀释的ASBC-FITC和Hoechst 32258染色。最后用Vectashield抗荧光淬灭封片剂封片,荧光显微镜观察绿色荧光标记的细胞为凋亡细胞,蓝色荧光标记的为所有细胞的细胞核。
1.8 统计学分析
所有数据采用SPSS 17.0软件进行统计学分析,各组数据以均数±标准差表示,组间差异采用单因素方差分析(ANOVA),组间两两比较采用LSD检验,以P<0.05为差异有统计学意义。
2 结果
2.1 慢性缺氧及4-PBA对大鼠心脏肥大的影响
与对照组相比,缺氧组大鼠进食量少,生长速度慢,然而心脏体质比(心脏质量/体质量,g/kg)却相对升高(P<0.001),右心室质量分析显示缺氧组大鼠右心室占比增高,右心室体质比(右心室质量/体质量,g/kg)增高(均P<0.001,见表1)。与缺氧组相比,干预组大鼠心脏体质比、右心室体质比、右心室占比均有所降低(分别为P≤0.001,见表1)。提示慢性缺氧可诱发大鼠出现以右心室肥大为主的病理改变,而4-PBA干预可部分缓解慢性缺氧所诱导的右心室肥大。

表1 慢性缺氧时大鼠心脏形态变化及4-PBA的干预作用
2.2 慢性缺氧及4-PBA对大鼠心肌组织线粒体膜电位的影响
与对照组相比,缺氧组大鼠右室心肌组织线粒体膜电位明显降低(P<0.001),而干预组大鼠右室心肌组织线粒体膜电位则高于缺氧组(P=0.014,见图1),这提示慢性缺氧可引起大鼠右室心肌组织线粒体膜电位降低,而4-PBA干预可减轻慢性缺氧对线粒体膜电位的影响。
2.3 慢性缺氧及4-PBA对大鼠心肌组织内质网应激的影响
与对照组相比,缺氧组大鼠右室心肌组织内质网应激标志分子CHOP、GRP78表达水平明显升高(均P<0.001),而干预组大鼠CHOP、GRP78表达水平明显低于缺氧组(P分别为0.047,0.007,见图2),提示慢性缺氧诱发大鼠右室心肌组织内质网应激,且4-PBA可显著抑制慢性缺氧的上述作用。

与对照组相比,*P<0.01;与缺氧组相比,#P<0.05图1 慢性缺氧时大鼠心肌组织线粒体膜电位变化及4-PBA的干预作用Figure 1 Effect of chronic hypoxia on myocardial mitochondrial membrane potential and the interference effect of 4-PBA

与对照组相比,*P<0.05;与缺氧组相比,#P<0.05图2 慢性缺氧对大鼠心肌组织内质网应激相关蛋白表达的影响及4-PBA的干预作用Figure 2 Effect of chronic hypoxia on the protein expression involved in ERS and the interference effect of 4-PBA
2.4 慢性缺氧及4-PBA对大鼠心肌组织凋亡的影响
与对照组相比,缺氧组大鼠右室心肌组织细胞凋亡率明显升高(P<0.001),而干预组大鼠细胞凋亡率则低于缺氧组(P<0.001,见图3),提示慢性缺氧诱导大鼠右室心肌细胞凋亡,4-PBA干预可部分缓解慢性缺氧的促凋亡作用。
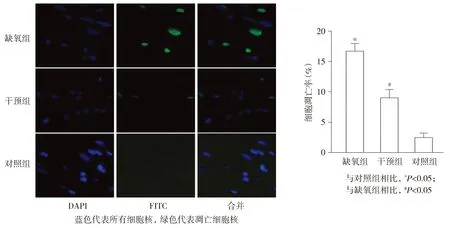
图3 慢性缺氧对大鼠心肌凋亡的影响及4-PBA的干预作用 (×400)Figure 3 Effect of chronic hypoxia on the cardiomyocyte apoptosis and the interference effect of 4-PBA (×400)
2.5 慢性缺氧及4-PBA对线粒体途径细胞凋亡的影响
与对照组相比,缺氧组大鼠右室心肌组织Bcl-2表达水平明显升高(P=0.001),细胞内总细胞色素C表达水平未见明显变化(P=0.294,见图4),但线粒体内细胞色素C含量明显降低(P=0.001,见图5),提示缺氧组大鼠右室心肌组织内细胞色素C大量释放。与缺氧组相比,干预组大鼠Bcl-2表达水平有所降低(P=0.020),细胞内总细胞色素C表达仍未见差异(P=0.514,见图4),但线粒体内细胞色素C含量有所升高(P=0.017,见图5),提示4-PBA可部分抑制慢性缺氧对大鼠右室心肌组织线粒体途径细胞凋亡的活化作用。

与对照组相比,*P<0.05;与缺氧组相比,#P<0.05图4 慢性缺氧对大鼠心肌组织凋亡相关蛋白表达的影响及4-PBA的干预作用Figure 4 Effect of chronic hypoxia on the expression of apoptosis-related proteins and the interference effect of 4-PBA

与对照组相比,*P<0.05;与缺氧组相比,#P<0.05图5 慢性缺氧对大鼠心肌组织线粒体内细胞色素C表达的影响及4-PBA的干预作用Figure 5 Effect of chronic hypoxia on the expression of cytochrome C in myocardial mitochondria and the interference effect of 4-PBA
3 讨论
长期缺氧导致的肺动脉高压是目前研究慢性肺源性心脏病发病机制的热点方向,心肌细胞缺氧再复氧损伤相关研究证实缺氧可诱发心肌细胞线粒体损伤甚至线粒体途径细胞凋亡,然而慢性缺氧对心肌细胞损伤和凋亡的具体机制并未引起足够重视[8]。线粒体是为维持心肌细胞功能而供应能量的重要细胞器,同时线粒体损伤也是介导细胞凋亡的重要途径之一,而内质网在维持细胞内钙稳态及调节细胞凋亡方面与线粒体有诸多功能重叠,二者之间的交互作用关系非常紧密[4-7]。基于此,本研究拟通过动物实验探索内质网在慢性缺氧诱发慢性肺源性心脏病心肌细胞线粒体途径凋亡中的作用。
本研究通过常压间歇缺氧法成功建立以右心室肥大为主的慢性肺源性心脏病大鼠模型,在该模型大鼠右心室心肌组织中观察到明显的细胞凋亡现象,以及活化的内质网应激。为明确内质网应激在慢性缺氧诱发心肌细胞凋亡中的作用和可能机制,本研究利用JC-1探针测定线粒体膜电位,结果证实缺氧组大鼠心肌组织线粒体膜电位明显降低,同时Bcl-2表达水平明显升高,线粒体内细胞色素C含量降低,提示线粒体释放更多的细胞色素C进入细胞质,上述结果提示慢性缺氧刺激下线粒体途径细胞凋亡明显活化。随后,通过分析干预组大鼠与缺氧组大鼠右心室组织中细胞凋亡和蛋白质表达水平的变化,证实4-PBA干预在抑制内质网应激的同时,可以显著降低心肌细胞Bcl-2表达水平和线粒体内细胞色素C的释放,同时心肌组织细胞过度凋亡得到部分缓解。由此可见,抑制内质网应激可以有效缓解慢性缺氧刺激诱发的线粒体途径细胞凋亡。
线粒体是心肌细胞中最为重要的细胞器之一,约占心肌细胞体积的45%,主要负责供给心肌细胞收缩所需要能量[9]。在心肌细胞凋亡时,线粒体结构和功能均发生明显改变,提示线粒体参与心肌细胞凋亡[10-13]。现已证实,线粒体是细胞凋亡的执行者和重要调节点,线粒体凋亡途径受bcl-2家族调控,线粒体膜通透性转换孔在凋亡信号诱导下开放,引发线粒体肿胀,并通过释放凋亡诱导因子和细胞色素C,启动细胞死亡过程[14-17]。本研究证实慢性缺氧刺激下,心肌细胞发生内质网应激的同时,Bcl-2表达水平上调,线粒体膜电位降低,线粒体中细胞色素C释放增加,启动线粒体途径细胞凋亡。同时,以4-PBA干预下调心肌细胞内质网应激水平,结果发现慢性缺氧刺激所诱发的线粒体膜电位降低、细胞色素C释放和Bcl-2高表达得到部分缓解,提示内质网应激作为线粒体途径细胞凋亡的上游参与慢性缺氧诱发慢性肺源性心脏病的发病过程。
作为两种重要的细胞器,线粒体和内质网之间存在着密切的联系,二者之间不但存在线粒体-内质网结构耦联(mitochondrion endoplasmic reticulum physical coupling,MAM),还存在共同诱导细胞凋亡的调节蛋白[18,19]。例如存在于内质网上的酪氨酸蛋白激酶C-Ab1可在内质网应激发生后转运至线粒体中,促进线粒体释放细胞色素C并继而活化凋亡过程[20]。MAM在线粒体与内质网双向反馈调节中发挥着重要的作用,当内质网应激发生后,这一物理结构可在线粒体与内质网之间传递钙信号,将内质网中的大量钙离子转运进入线粒体中,造成线粒体钙超载,并引起线粒体膜通透性转换孔开放、线粒体肿胀和线粒体途径细胞凋亡[19]。心脏是一个对氧气高度依赖的器官,任何引起机体系统性缺氧的疾病都可能导致心肌组织慢性缺氧,继而引发心肌收缩功能降低,甚至心力衰竭[6,21]。因此,探寻慢性缺氧情况下心肌细胞功能变化的机制将为临床上救治慢性肺源性心脏病等缺氧性心脏病提供新的线索。本研究证实慢性缺氧环境中内质网应激可通过活化线粒体凋亡途径介导心肌细胞凋亡,而其中具体机制尚需进一步研究探索,下一步将以细胞钙稳态和MAM为重点深入探索其中的机制。
综上所述,本研究通过动物实验揭示了慢性缺氧可诱发心肌细胞内质网应激,继而引起线粒体凋亡途径,参与慢性肺源性心脏病的发病过程。明确内质网应激介导的线粒体凋亡途径在慢性肺源性心脏病中的作用有助于阐明慢性肺源性心脏病的发病机制,并证实靶向内质网保护的药物可以应用于以心肌细胞保护为策略的慢性肺源性心脏病治疗中。

