育亨宾对肾移植中肾间质纤维化的抑制作用及其机制
张瑞琴,吴东娟,韩士超,李 转,陈利娟,贺海玲
(空军军医大学西京医院泌尿外科,西安 710032;*通讯作者,E-mail:759421091@qq.com)
肾移植(renal transplantation,RT)是治疗终末期肾病最有效的治疗方法[1]。在肾移植中,肾缺血再灌注损伤(ischemia reperfusion injury,IRI)和上皮-间质转化(epithelial-mesenchymal transition,EMT)是导致移植肾功能丧失的重要因素[2]。在IRI中,肾组织中产生的炎症因子肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、转化生长因子-β(transforming growth factor-β,TGF-β)和活性氧可进一步促进黏附分子的表达,从而诱导激活的中性粒细胞和单核巨噬细胞聚集在损伤部位,进一步加重损伤。此外,IRI可诱导补体系统激活,促进炎症反应,导致肾小管上皮细胞凋亡,进一步加重肾脏IRI[3]。EMT的特征是上皮细胞转化为肌成纤维细胞,并伴随上皮标志物如E-钙黏蛋白(E-cadherin)的下调,以及间质标志物如α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)的上调[4]。EMT受各种生物介质调节,如TNF-α、TGF-β、Ang Ⅱ等,从而促进纤维化进程[5,6]。育亨宾(Yohimbine,Yoh)是一种α2受体拮抗剂,已被报道通过抑制NF-κB通路改善颞下颌关节软骨细胞炎症[7]。另外,育亨宾对大鼠缺血再灌注、脂多糖(lipopolysaccharide,LPS)或顺铂诱导的急性肾损伤具有抑制作用[8-10]。然而,尚不清楚育亨宾对移植肾纤维化的影响。因此,本研究通过使用0.1 mg/kg和0.5 mg/kg育亨宾治疗肾移植大鼠16周,探讨了育亨宾对大鼠肾移植后纤维化的抑制作用及其分子机制。
1 材料与方法
1.1 材料
1.1.1 药品与试剂 育亨宾购自美国Sigma-Aldrich公司;大鼠TNF-α ELISA试剂盒购自武汉菲恩生物科技有限公司;大鼠TGF-β1 ELISA试剂盒购自博辉生物科技(广州)有限公司;环孢菌素A购自华北制药股份有限公司;青霉素购自瑞阳制药有限公司;苏木精-伊红(HE)染色试剂盒、Masson三色染色试剂盒、RIPA缓冲液、BCA蛋白质检测试剂盒购自碧云天生物技术研究所;血清肌酐(Scr)和血尿素氮(BUN)检测试剂盒购自南京建成生物工程研究所;ECL试剂盒购自美国Thermo Fisher Scientific公司。
1.1.2 实验动物 成年雄性F344大鼠和Lewis大鼠(200~250 g)购自西安交通大学实验动物中心[许可证号:SCXK(陕)2020-001]。所有大鼠均饲养在恒温(24 ℃)、恒湿(55%)、12 h光/暗周期环境中,对大鼠提供自来水和标准饲料,不限制饮食。
1.2 方法
1.2.1 肾移植 参考文献[11]方法,在F344大鼠(供体)和Lewis大鼠(受体)之间进行原位左肾移植。移植术后10 d切除受体右肾。从受体肾移植术当天开始,每天1次腹腔注射环孢菌素A(5 mg/kg),持续14 d;腹腔注射青霉素20万U/d,持续3 d。
1.2.2 动物分组和治疗 将48只Lewis大鼠随机分为4组:对照组、肾移植组、0.1 mg/kg育亨宾治疗组(低剂量组)和0.5 mg/kg育亨宾治疗组(高剂量组),每组12只。对照组大鼠行右肾切除。其他组大鼠为肾移植大鼠。从肾移植后的第1天起,每周2次向低剂量组和高剂量组大鼠腹腔分别注射0.1 mg/kg和0.5 mg/kg的育亨宾(2 ml),对照组和肾移植组大鼠腹腔注射2 ml的0.9%生理盐水。共治疗16周。
1.2.3 组织学染色检测肾组织形态和纤维化 治疗结束后,分离左肾,石蜡包埋制作4 μm厚的切片,然后按照说明书通过苏木精-伊红(HE)染色来观察肾组织形态,通过Masson三色染色观察肾纤维化情况。纤维化面积计算方法如下:随机选取5个视野,在放大200倍下记录纤维化面积,并以纤维化面积占整个面积的百分比表示。
1.2.4 肾功能评估 使用直径1.0 mm的玻璃毛细管从大鼠眼眶后静脉丛采血,离心分离血清。按照试剂盒的说明通过肌氨酸氧化酶法检测Scr,通过二乙酰肟比色法检测BUN。
1.2.5 酶联免疫吸附法(ELISA)测定血清炎症因子水平 根据ELISA试剂盒说明,使用大鼠TNF-α和TGF-β1 ELISA试剂盒检测大鼠血清TNF-α和TGF-β1的水平。
1.2.6 免疫组化检测α-SMA、E-cadherin和Smurf1蛋白表达情况 肾组织石蜡切片用二甲苯脱蜡,复水。在柠檬酸缓冲液(10 mmol/L,pH 6.0)中加热至98 ℃,并维持10 min。切片在室温下用3%H2O2甲醇浸泡20 min。在10%脱脂牛奶封闭1 h后用磷酸盐缓冲盐水(PBS,pH 7.4)洗涤3次,随后在4 ℃下将切片与一抗孵育过夜。一抗为兔抗α-SMA(1 ∶300稀释)、E-cadherin(1 ∶500稀释)、Smurf1(1 ∶500稀释)单克隆抗体。然后,切片与生物素化山羊抗小鼠/兔IgG二抗(1 ∶500稀释)在37 ℃孵育1 h,之后行3,3-二氨基联苯胺显色,苏木精复染。用奥林巴斯光学显微镜拍摄切片,放大倍数为200倍,用Image-Pro Plus软件进行图像分析。染色强度计算为积分光密度。
1.2.7 Western blotting检测肾组织中蛋白表达水平 使用RIPA缓冲液裂解肾组织,然后使用BCA试剂盒检测蛋白含量。蛋白质提取液(50 μg/泳道)通过8%~12% SDS-PAGE分离,然后电转移到PVDF膜上。将膜在室温下用5%的脱脂牛奶封闭1 h,然后在4 ℃与一抗孵育过夜。一抗如下:α-SMA(1 ∶3 000稀释)、E-cadherin(1 ∶5 000稀释)、Smurf1(1 ∶5 000稀释)、Akt(1 ∶2 000稀释)、p-Akt(1 ∶2 000稀释)、mTOR(1 ∶5 000稀释)、p-mTOR(1 ∶5 000稀释)、P70S6K(1 ∶3 000稀释)、p-P70S6K(1 ∶3 000稀释)和GAPDH(1 ∶5 000稀释)。GAPDH作为内参蛋白。用TBS-T洗涤3次后,与辣根过氧化物酶标记的抗兔或抗鼠免疫球蛋白二抗(1 ∶5 000稀释)室温孵育1 h。采用增强化学发光试剂盒显影。
1.3 统计学数据分析
2 结果
2.1 育亨宾对肾移植大鼠肾组织形态和纤维化的影响
本研究中,12只对照组大鼠行右肾切除。36只大鼠进行肾移植。肾移植16周后,共有13只大鼠死亡,总存活率为72.92%。对照组、肾移植组、低剂量组和高剂量组大鼠依次存活10,7,9,9只,存活率依次为83.33%,58.33%,75.00%和75.00%。HE染色结果显示,对照组大鼠肾组织结构正常;肾移植组大鼠肾小管扩张、上皮萎缩、间质炎性细胞浸润、间质间隙明显扩张,胶原沉积明显;低剂量组和高剂量组大鼠肾组织形态较肾移植组好转,高剂量组大鼠肾组织形态基本恢复正常(见图1)。Masson三色染色中,胶原纤维呈蓝色,肌纤维呈红色,蓝色染色区域代表纤维化区域(见图1)。定量分析显示,与对照组比较,肾移植组大鼠肾组织纤维化面积明显增加(P<0.05);与肾移植组比较,低剂量组和高剂量组大鼠的肾组织纤维化面积明显减小(P<0.05);与低剂量组比较,高剂量组大鼠的肾组织纤维化面积明显减小(P<0.05,见图1)。
2.2 育亨宾对肾移植大鼠血清炎症因子的影响
与对照组比较,肾移植组大鼠血清中TNF-α和TGF-β1水平升高(P<0.05);与肾移植组比较,低剂量组和高剂量组大鼠血清中TNF-α和TGF-β1水平降低(P<0.05);与低剂量组比较,高剂量组大鼠血清中TNF-α和TGF-β1水平降低(P<0.05,见表1)。
2.3 育亨宾对肾移植大鼠肾功能的影响
与对照组比较,肾移植组大鼠Scr和BUN水平升高(P<0.05);与肾移植组比较,低剂量组和高剂量组大鼠Scr和BUN水平降低(P<0.05);与低剂量组比较,高剂量组大鼠Scr和BUN水平降低(P<0.05,见表2)。
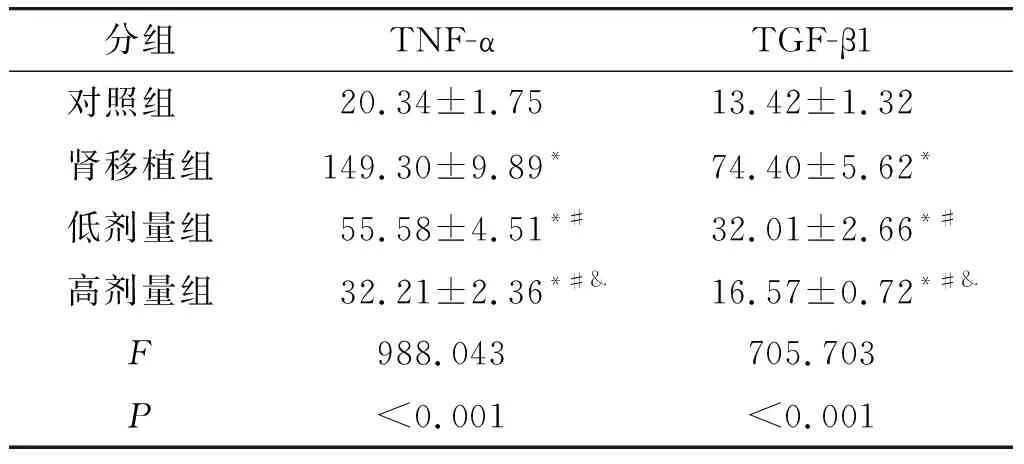
表1 ELISA法检测大鼠治疗16周后的血清TNF-α和TGF-β1水平 (pg/ml)
2.4 育亨宾对肾移植大鼠肾组织EMT的影响
免疫组化染色结果显示,与对照组比较,肾移植组大鼠肾组织中α-SMA的相对积分光密度升高,E-cadherin的相对积分光密度降低(P<0.05);与肾移植组比较,低剂量组和高剂量组大鼠肾组织中α-SMA的相对积分光密度均降低,E-cadherin的相对积分光密度均升高(P<0.05);与低剂量组比较,高剂量组大鼠肾组织中α-SMA的相对积分光密度降低,E-cadherin的相对积分光密度升高(P<0.05,见图2)。
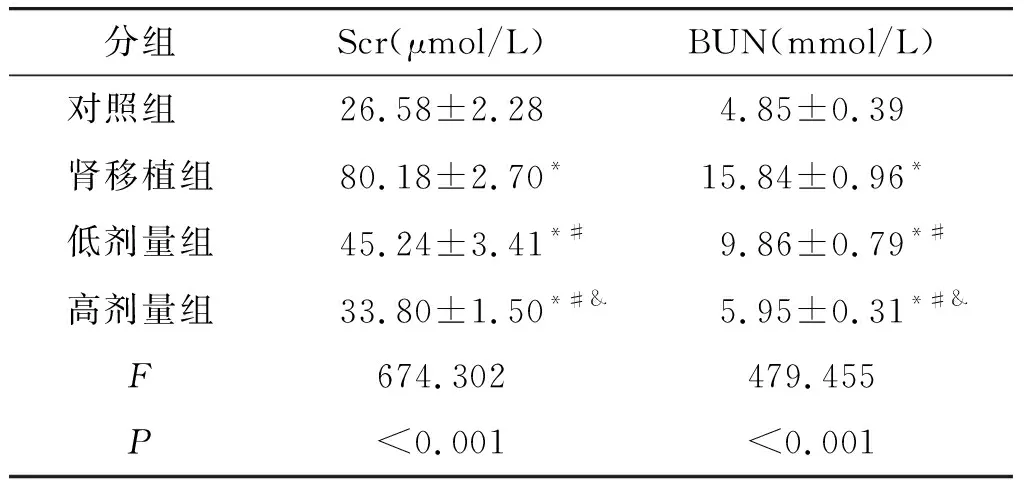
表2 各组大鼠治疗16周后的Scr和BUN水平
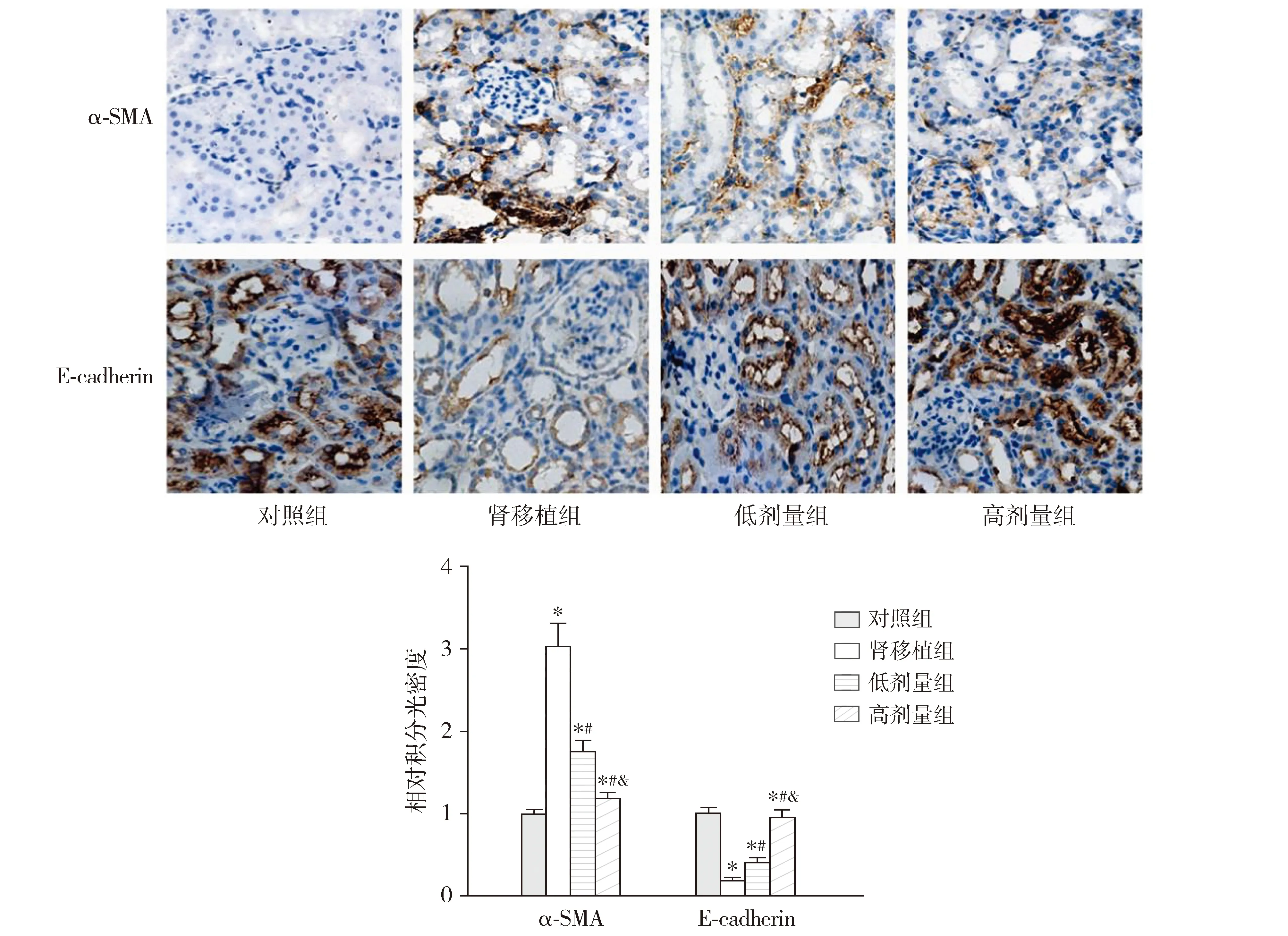
与对照组比较,*P<0.05;与肾移植组比较,#P<0.05;与低剂量组比较,&P<0.05图2 治疗16周后大鼠肾组织α-SMA和E-cadherin的免疫组化染色 (×200)Figure 2 Immunohistochemical staining of α-SMA and E-cadherin in renal tissue of rats in each group after 16 week treatment (×200)
Western blotting结果显示,与对照组比较,肾移植组大鼠肾组织中α-SMA的蛋白相对表达量升高,E-cadherin降低(P<0.05);与肾移植组比较,低剂量组和高剂量组大鼠肾组织中α-SMA的蛋白相对表达量均降低,E-cadherin的蛋白相对表达量均升高(P<0.05);与低剂量组比较,高剂量组大鼠肾组织中α-SMA的蛋白相对表达量降低,E-cadherin的蛋白相对表达量升高(P<0.05,见图3)。
2.5 育亨宾对肾移植大鼠肾组织Smurf1表达的影响
免疫组化染色结果显示,与对照组比较,肾移植组大鼠肾组织中Smurf1的相对积分光密度升高(P<0.05);与肾移植组比较,低剂量组和高剂量组大鼠肾组织中Smurf1的相对积分光密度均降低(P<0.05);与低剂量组比较,高剂量组大鼠肾组织中Smurf1的相对积分光密度降低(P<0.05,见图4)。Western blotting结果显示,与对照组比较,肾移植组大鼠肾组织中Smurf1的蛋白相对表达量升高(P<0.05);与肾移植组比较,低剂量组和高剂量组大鼠肾组织中Smurf1的蛋白相对表达量均降低(P<0.05);与低剂量组比较,高剂量组大鼠肾组织中Smurf1的蛋白相对表达量降低(P<0.05,见图4)。
2.6 育亨宾对肾移植大鼠肾组织Akt-mTOR-P70S6K信号通路的影响
Western blotting结果表明,与对照组比较,肾移植组大鼠肾组织中p-Akt/Akt、p-mTOR/mTOR和p-P70S6K/P70S6K的蛋白相对表达量均升高(P<0.05);与肾移植组比较,低剂量组和高剂量组大鼠肾组织中p-Akt/Akt、p-mTOR/mTOR和p-P70S6K/P70S6K的蛋白相对表达量均降低(P<0.05);与低剂量组比较,高剂量组大鼠肾组织中p-Akt/Akt、p-mTOR/mTOR和p-P70S6K/P70S6K的蛋白相对表达量均降低(P<0.05,见图5)。
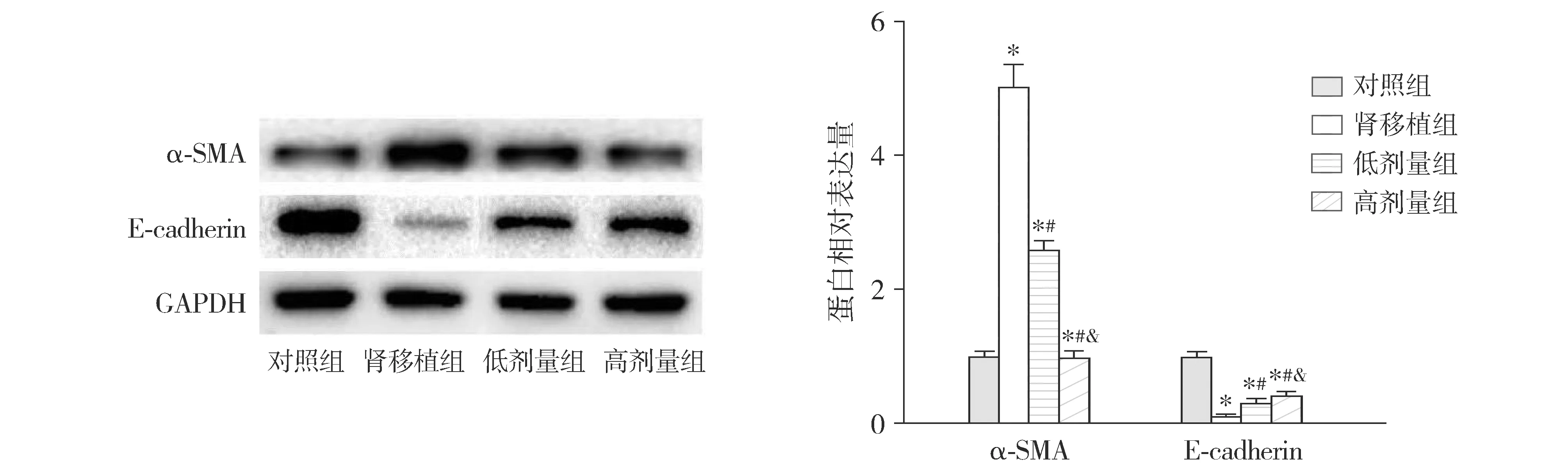
与对照组比较,*P<0.05;与肾移植组比较,#P<0.05;与低剂量组比较,&P<0.05图3 Western blotting检测大鼠治疗16周后的肾组织α-SMA和E-cadherin的蛋白表达Figure 3 Protein expression of α-SMA and E-cadherin in renal tissue in rats after 16 week treatment detected by Western blotting
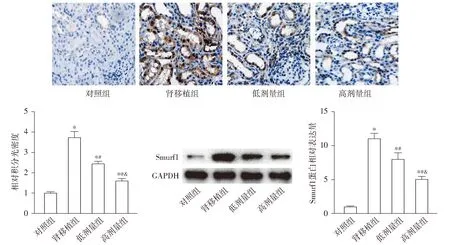
与对照组比较,*P<0.05;与肾移植组比较,#P<0.05;与低剂量组比较,&P<0.05图4 免疫组化染色和Western blotting检测大鼠治疗16周后的肾组织Smurf1的表达 (×200)Figure 4 Expression of Smurf1 in kidney tissue of rats after 16 week treatment detected by immunohistochemical staining and Western blotting (×200)
3 讨论
目前,临床中用于改善肾移植后排斥反应的药物相对较少,急需要开发新的药物。有文献报道了育亨宾对肾损伤的抑制作用。例如,Shimokawa等[10]研究显示,在LPS诱导的大鼠急性肾损伤模型中,育亨宾可阻断NF-κB的核定位,抑制炎性细胞因子和诱导型一氧化氮合酶(iNOS)表达,增强细胞外信号调节激酶和cAMP反应元件结合蛋白的磷酸化,从而预防LPS诱导的急性肾损伤。Tsutsui等[9]报道,育亨宾抑制了顺铂诱导的急性肾损伤大鼠升高的肾血浆去甲肾上腺素、肾组织中肿瘤坏死因子-α(TNF-α)、单核细胞趋化蛋白-1(MCP-1)和cleaved Caspase-3的表达,从而改善了肾功能并抑制了细胞凋亡。基于上述文献报道,我们推测育亨宾可能是一种提高肾移植成功率的潜在药物。因此,本研究探索了育亨宾对肾移植大鼠肾功能和纤维化的影响,结果显示,经过16周的治疗后,育亨宾以剂量依赖性方式改善了移植肾形态并减轻了肾纤维化,并且降低了肾移植大鼠Scr和BUN水平,这些结果说明育亨宾可有效减轻肾移植后的肾损伤。由于肾移植过程中不可避免地会发生肾IRI,这也是导致移植肾功能丧失的重要因素之一。肾IRI诱导肾组织中产生TNF-α、TGF-β等炎症因子是其损伤肾功能的主要途径[3]。为了进一步研究育亨宾对移植肾的保护作用,本研究考察了育亨宾对血清炎症因子的影响。结果显示,在肾移植大鼠中,育亨宾治疗明显降低了血清TNF-α和TGF-β1水平。Shimokawa等[8]研究发现,育亨宾抑制了大鼠急性缺血再灌注后肾静脉去甲肾上腺素水平、TNF-α和MCP-1 mRNA水平,表明育亨宾通过抑制α2C-肾上腺素受体和抑制促炎细胞因子的表达来预防缺血再灌注所致的肾损伤。因此,本研究推测,育亨宾减轻肾移植中IRI诱导的炎症反应可能也是其肾保护作用的一种机制。
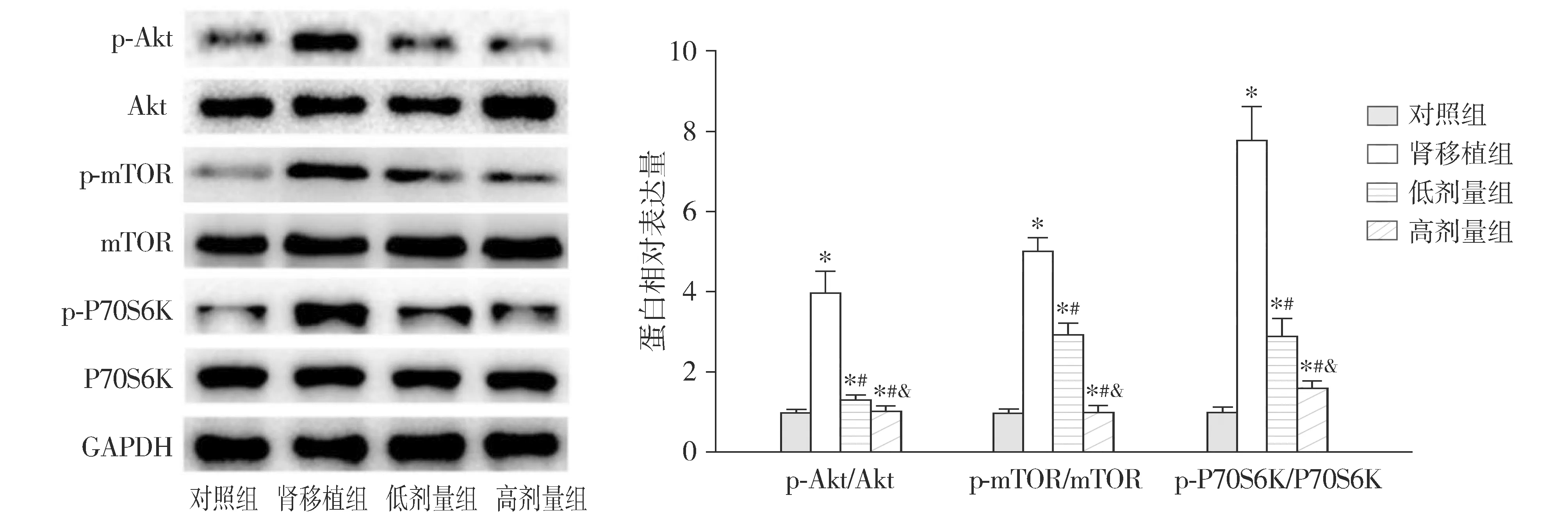
与对照组比较,*P<0.05;与肾移植组比较,#P<0.05;与低剂量组比较,&P<0.05图5 Western blotting检测大鼠治疗16周后肾组织Akt、mTOR、和P70S6K的磷酸化水平Figure 5 The phosphorylation levels of Akt, mTOR and P70S6K in kidney tissue of rats after 16 week treatment detected by Western blotting
Smad泛素化调节因子1(Smurf1)是一种E3泛素连接酶,已被证实参与多种生物学过程,包括胚胎发生、肿瘤生长、骨形成和肝脏脂肪变性[12-14]。据报道,Smurf1参与调节糖尿病肾纤维化和移植肾纤维化[2,15],Smurf1-Smad7信号调节肾上皮细胞向成纤维细胞的转化[16],抑制Smurf1可减轻糖尿病小鼠的肾纤维化[15]。本研究表明,育亨宾抑制了肾移植大鼠肾组织中Smurf1的表达,这可能也是育亨宾抑制肾纤维化的机制之一。
EMT在CAD的发病机制中起着至关重要的作用。对单侧输尿管梗阻和链脲佐菌素诱导的糖尿病肾病小鼠模型的研究表明,抑制EMT可通过阻断TGF-β/Smad通路减轻肾脏纤维化[17,18]。因此,靶向EMT为预防肾纤维化和改善肾移植受者的预后提供了新的途径。本研究探索了育亨宾对肾移植大鼠肾组织EMT的影响,结果表明育亨宾治疗抑制了肾组织中α-SMA的表达,而促进了E-cadherin的表达,从而抑制了EMT。在此基础上,本研究进一步考察了调控EMT的重要信号通路,即Akt-mTOR-P70S6K信号通路。其他文献报道,TGF-β1通过Akt信号通路促进EMT和同种异体移植物间质纤维化[19]。肝细胞生长因子可通过Akt-mTOR-P70S6K信号通路明显抑制TGF-β1诱导的人脐静脉内皮细胞和人肾小球内皮细胞EMT[20]。硼替佐米通过抑制NF-κB/TNF-α/Akt/mTOR/P70S6K/Smurf2通路来抑制移植肾间质纤维化[21]。本研究也发现育亨宾抑制了Akt-mTOR-P70S6K信号通路。此外,还有文献指出,TGF-β1、Smurf1与Akt-mTOR-P70S6K信号通路存在相互作用,共同调节肾纤维化[2]。这些结果充分说明育亨宾对肾移植大鼠肾纤维化的抑制作用与Akt-mTOR-P70S6K信号通路有关。
综上所述,本研究首次揭示育亨宾可改善肾移植大鼠的肾形态和功能,并减轻肾纤维化,育亨宾对移植肾的保护作用可能通过Smurf1和Akt-mTOR-P70S6K信号通路来介导。在未来,育亨宾有望成为提高肾移植成功率的新型药物。

