类风湿关节炎合并间质性肺疾病患者外周淋巴细胞亚群失衡特点分析
孟利花,谢戬芳,段培青,王泉丽,程 超,肖 玲
(1太原市中心医院风湿免疫科,太原 030001;2山西医科大学第二医院风湿免疫科;*通讯作者,E-mail:mlhproject12345111@163.com)
类风湿关节炎(rheumatoid arthritis,RA)是一种常见的由异常免疫反应引起的主要侵及小关节的慢性、对称性、进行性风湿性疾病[1]。免疫细胞功能和/或数量的改变所致的慢性炎症可促进RA患者滑膜关节软骨退化和软骨下骨侵蚀,亦累及多器官、多组织功能障碍从而增加死亡风险[2,3],如间质性肺疾病(interstitial lung disease,ILD)[4,5]。ILD是一组由慢性炎症参与并介导的肺实质疾病,主要表现为肺实质不同程度的炎症改变和纤维化破坏,其临床表现、疾病进展和预后类型具有高度异质性[6]。高分辨率CT (high-resolution computed tomography, HRCT)目前仍是发现早期肺组织病变和肺功能障碍最重要的方法,但亦存在局限性[7,8]。随着对免疫学以及组织病理学的深入研究,淋巴细胞亚群在RA及ILD等免疫相关性疾病发病中的重要作用被进一步认知[3,9,10]。本研究通过观察RA-ILD患者外周淋巴细胞水平的改变,发现在其发病机制中扮演重要角色的淋巴细胞亚群,为RA-ILD的诊断与治疗提供新的理念与靶点。
1 资料与方法
1.1 研究对象
收集2017年1月至2019年9月在山西医科大学第二医院风湿免疫科就诊的RA患者143例,其中合并ILD共43例,未合并ILD患者100例。所有的RA患者均满18周岁且符合美国风湿病学会(ARA)1987年和2010年修订的RA分类标准[11,12],并且完善外周血淋巴细胞检测及一般实验室化验及检查。所有的RA患者均行肺部高分辨CT(high-resolution computed tomography,HRCT)检查,有网格状、蜂窝状、牵引性支气管扩张等ILD影像学指标和ILD临床特征的43例患者被诊断为RA-ILD[13]。
RA患者排除标准:①合并其余风湿性疾病,如系统性红斑狼疮、干燥综合征、银屑病关节炎等;②曾诊断结核、结节病、淀粉样变,及有恶性肿瘤病史;③近期有严重感染或慢性感染处于活动期患者,有HIV、病毒性肝炎等感染史;④合并有严重的肝、肾、心、肺功能障碍者。
本研究筛选同期就诊于本院体检中心且性别、年龄相匹配的的健康受试者57例,其中女性36例,男性21例,平均年龄(60±3.89)岁,均无风湿性疾病及ILD病史,且符合以上排除标准。收集所有健康人群外周血并用流式细胞术检测淋巴细胞亚群水平,检测经费由研究人员课题经费资助。所有健康人群均知情同意。研究方案已通过山西医科大学第二医院伦理委员会批准(2016 KY-007)。
1.2 观察指标
1.2.1 一般资料 收集所有受试者的性别、年龄,以及所有患者的用药方案、病程、关节肿胀数(swollen joint count,SJC)、关节压痛数(tender joint count,TJC)、以及疾病活动评分(disease activity score,DAS)28等资料。
1.2.2 一般实验室指标 包括红细胞沉降率(erythrocyte sedimentation rate,ESR)、C反应蛋白(C-reactive protein,CRP)、白细胞计数(white blood cell,WBC)、红细胞计数(red blood cell,RBC)、血小板计数(platelet,PLT)、淋巴细胞(lymphocyte,LY)和血小板/淋巴细胞比值(platelet/lymphocyte ratio,PLR)。
1.2.3 淋巴细胞水平 流式细胞术检测所有受试者外周血中淋巴细胞亚群绝对计数及百分比,包括T、B、CD4+T、CD8+T、NK细胞以及包括Th1细胞、Th2细胞、Th17细胞和调节性T细胞(regulatory T cells,Treg)在内的CD4+T细胞亚群。
1.3 淋巴细胞检测方法
1.3.1 标本采集 受试者清晨空腹状态下采集静脉血,置于肝素钠抗凝管,摇匀后置于室温。
1.3.2 流式细胞术检测外周血淋巴细胞亚群 荧光标记的单克隆抗体:异硫氰酸荧光素(FITC)标记的CD3抗体、藻红蛋白(PE)标记的CD8、CD16、CD56抗体、多甲藻素叶绿蛋白(PerCP)标记的CD45抗体、别藻蓝蛋白(APC)标记的CD4、CD19抗体。用上述抗体孵育淋巴细胞T(CD3+CD19-)、B(CD3-CD19+)、CD4+T(CD3+CD4+)、CD8+T(CD3+CD8+)、NK(CD3-/CD16+CD56+),随后用流式细胞仪及Procount法分析细胞绝对计数及百分比。
1.3.3 流式细胞术检测CD4+T淋巴细胞亚群 Th1(CD4+IFN-γ+)/Th2(CD4+IL-4+)/Th17(CD4+IL-17+)细胞:分别将10 μl PMA、10 μl Ionomycin和1 μl GolgiStop加入80 μl肝素抗凝静脉血细胞,37 ℃温育5 h。随后将标本分为A和B管,均加入抗CD4-FITC抗体染色,在室温下避光放置30 min,A管加入人抗IL-4-PE与IFN-γ-APC,B管加入人抗IL-17-PE,室温放置30 min后用磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗涤细胞,上机检测。
Treg细胞(CD4+CD25+Foxp3+):80 μl肝素抗凝静脉血用人抗CD4-FITC和抗CD25-APC进行表面标记,避光孵育30 min后,用人抗Foxp3-PE进行染色,上机检测。
上述细胞在24 h内通过流式细胞仪(Calibur,BD,USA)进行检测,并基于正向(FSC)和侧向(SSC)散射图案的门分化淋巴细胞。计算CellQuest软件(Becton-Dickinson)检测门中的104个细胞并分析百分比以分析淋巴细胞各亚群水平,其中CD4+T淋巴细胞各亚群的细胞绝对计数=各亚群阳性细胞的百分比×CD4+T细胞绝对数。
1.4 统计学方法
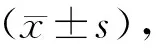
2 结果
2.1 RA合并与不合并ILD患者一般资料比较
本研究共纳入100例RA-non-ILD患者与43例RA-ILD患者,RA-ILD患者病程明显长于RA-non-ILD患者,差异有统计学意义(P<0.05)。两组间年龄、性别及甲氨蝶呤、来氟米特等免疫抑制药物的用药比例差异无统计学意义(P>0.05,见表1)。
表1 RA-non-ILD与RA-ILD患者一般资料及免疫抑制药物用药情况
2.2 RA-non-ILD与RA-ILD患者一般实验室指标比较
RA-ILD组的PLT和PLR值明显高于RA-non-ILD组,其余疾病活动度指标ESR、CRP、TJC、SJC和DAS28以及WBC、RBC、和LY水平无明显差异(P>0.05,见表2)。

表2 RA-non-ILD与RA-ILD患者疾病活动度及一般实验室指标比较 M(Q25,Q75)
2.3 健康对照(HC)、RA-non-ILD与RA-ILD外周血淋巴细胞水平比较
与HC相比,RA-non-ILD患者外周T细胞、CD8+T细胞、NK细胞绝对数明显下降,CD4+T细胞百分比升高,而RA-ILD患者外周T细胞与B细胞数目下降,差异均有统计学意义(P<0.05)。相比于RA-non-ILD患者,RA-ILD患者的T细胞数目与CD4+T细胞数目及百分比下降,而CD8+T细胞百分比升高,差异有统计学意义(P<0.05,见表3)。
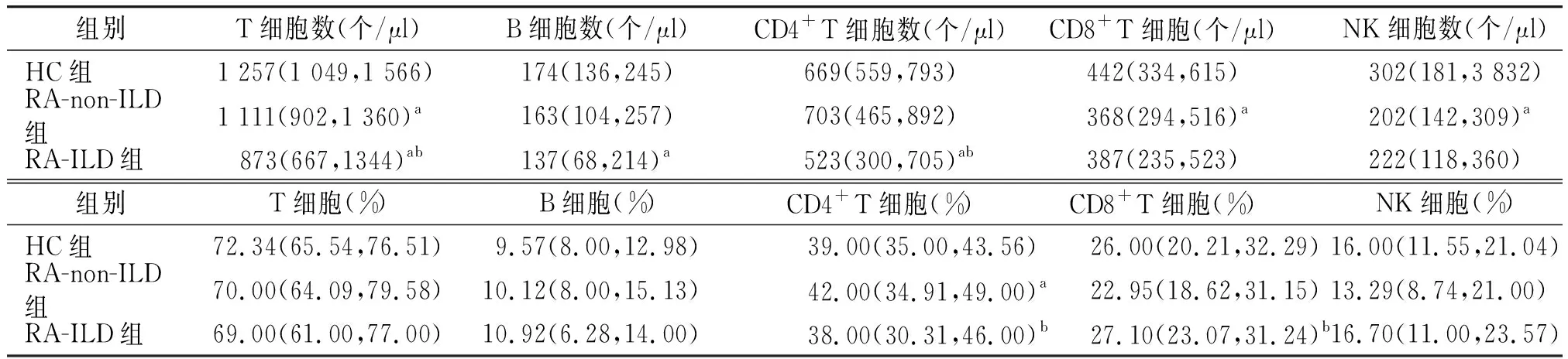
表3 HC、RA-non-ILD和RA-ILD患者外周淋巴细胞亚群水平比较 M(Q25,Q75)
2.4 HC组、RA-non-ILD与RA-ILD外周CD4+T淋巴细胞亚群水平比较
无论是否合并ILD,RA患者的Th1细胞与Treg细胞绝对计数、Th1细胞百分比以及Th1/Th2均明显低于HC,差异有统计学意义(P<0.05),而仅有合并ILD的RA患者外周血中Th17细胞下降(P<0.05)。另外,与RA-non-ILD患者相比,在所有的CD4+T细胞亚群中,RA-ILD患者中只有Th2细胞计数下降(P<0.05,见表4)。

表4 HC、RA-non-ILD、RA-ILD患者外周CD4+T亚群细胞水平比较 M(Q25,Q75)
2.5 RA合并ILD的淋巴细胞亚群相关危险因素
以RA患者是否合并ILD为因变量(合并ILD赋值为1,未合并ILD赋值为0),将前期组间分析中三组间存在差异的指标分别作为协变量,利用二元logistics回归方程进一步分析RA患者发生ILD的相关因素。由表5可知,在纳入的指标中,仅有病程、CD4+T细胞数及百分比、Th2细胞数与RA患者是否合并ILD存在相关性(P<0.05)。换言之,病程越长、CD4+T细胞与Th2细胞数目下降以及CD4+T细胞百分比的下降是RA患者合并ILD的危险因素。
3 讨论
由于ILD具有高度异质性,并且可导致结缔组织病的诊断和治疗复杂化,其发病机制、诊断和治疗受到越来越多的关注[14]。ILD是RA患者死亡的重要原因之一[5],虽然目前RA-ILD确切的发病机制仍未完全阐明,临床治疗方案尚存在争议,但已有诸多研究[3,9,10,15]证实无论是RA还是ILD,淋巴细胞水平异常所介导的免疫功能紊乱均在其发病过程中扮演着重要的、不可或缺的角色。因而,探讨RA-ILD患者外周淋巴细胞水平的改变对于其发生发展过程中免疫机制的深入研究以及临床的诊疗新理念的建立具有重要的意义。

表5 二元logistic回归分析RA合并ILD的危险因素
本研究中,在年龄、性别相匹配的情况下,RA-ILD患者有更长的病程,发生ILD的风险随着RA病程的延长而增加[7]。相比于未合并ILD的RA患者,RA-ILD患者有更高的PLR值。作为一种简单、可靠且廉价的反映全身炎症的实验室指标,PLR已被作为各种癌症和心血管疾病的预后或诊断标志物[16]。在最近的研究中发现RA患者的PLR水平显著高于健康对照,表明PLR可能是提示RA患者亚临床慢性炎症的潜在指标[17]。Chen等[16]发现PLR值在RA-ILD患者中升高,显著高于RA-non-ILD患者及健康对照,这与本研究结果相似。但本研究在logistics回归中并未发现PLR对于RA患者发生ILD的影响,与既往研究[16]中PLR可用作区分RA-ILD患者与RA-non-ILD患者的新型生物标志物这一观点存在差异,这或许与纳入病例数和观察对象的基本特征存在差异有关。
与健康对照相比,RA患者无论是否合并ILD,其外周淋巴细胞数目均有一定程度的改变,其中RA-non-ILD患者的T细胞、CD8+T细胞、NK细胞下降,而RA-ILD患者外周T细胞与B细胞数目下降。但与未合并ILD患者组相比,RA-ILD患者的T细胞、CD4+T细胞数目下降,提示T细胞,尤其是CD4+T细胞参与RA患者中ILD的发生发展,其余淋巴细胞的下降或许与RA的免疫机制相关。T淋巴细胞是体内主要的免疫细胞类型之一,多聚集于肺组织间质纤维化和蜂窝状改变的区域,在相对正常的肺组织区域较少[18],炎症T细胞的浸润被认为是肺纤维化过程中最先发生的病理改变[19]。随着肺部炎症和纤维化的进程,T淋巴细胞会进一步浸润并分化[20]。特发性肺纤维化患者的肺实质中浸润有大量的CD4+T细胞[20]。RA-ILD患者支气管肺泡灌洗液及肺组织病理活检中均可观察到炎性细胞的聚集,大多数CD4+T细胞和CD20+淋巴细胞聚集在淋巴滤泡、肺泡壁和T淋巴细胞中,提示CD4+T淋巴细胞在RA患者发生ILD中有着重要作用[21],而淋巴细胞在病变组织的聚集或许是外周血中相应细胞亚群减少的原因之一。
CD4+T淋巴细胞在抗原刺激及相应细胞因子的作用下,可分化为多种细胞亚群,其中应用及研究最为广泛的是Th1细胞、Th2细胞、Th17细胞以及Treg细胞,也是本研究中观察的指标。既往虽无研究观察外周CD4+T细胞在RA-ILD中的水平,但有一项病例报道称RA-ILD患者经来氟米特治疗后出现肺损伤的同时,外周血淋巴细胞显著下降,随着肺功能的恢复,淋巴细胞也随之恢复至基线水平,提示淋巴细胞水平参与肺损伤的过程[22]。与上述报道相似,本研究发现RA-ILD患者外周血Th1细胞、Th17细胞、Treg细胞绝对计数较之健康人群均明显下降,但与RA-non-ILD患者相比,仅有Th2细胞计数在RA-ILD患者中是下降的,且可作为RA患者合并ILD的危险因素。这一结果提示以部分亚群细胞数目下降为主的CD4+T细胞亚群失衡参与了RA及RA-ILD的发生发展过程,而Th2细胞水平的下降与ILD的发生更为相关。
Th2细胞表达的细胞因子TGF-β,是一种有效的免疫抑制和抗炎调节因子,也是最有效的促纤维化细胞因子,细胞因子IL-4和IL-13可以通过激活成纤维细胞增殖和胶原蛋白的生成来促进肺纤维化的发展以促进愈合[23,24]。既往报道博来霉素刺激的T-bet-/-小鼠的肺纤维化形成与外周血中Th2细胞因子水平升高和促纤维化因子TGF-β1的表达升高有关[25]。在博来霉素刺激的肺纤维化小鼠模型中,过度表达Th2细胞分化重要因子GATA-3促进肺组织中TGF-β的表达,小鼠存活率下降,而外源性补充Th1细胞因子干扰素-γ可改善小鼠肺纤维化程度,提高生存率[26]。这一结果与Th2细胞促纤维化作用一致。特发性肺纤维化患者支气管肺泡灌洗液中,CD4+T细胞上CXCR3的表达明显降低,CCR4的表达明显升高[27],上述Th2细胞及细胞因子在肺组织中水平与本研究中所观察到RA-ILD患者外周Th2细胞数目水平下降的结果存在矛盾,或许是外周参与肺组织纤维化过程的重要淋巴细胞Th2细胞在众多趋化因子的作用下迁移至肺组织并表达相关细胞因子所致。另外,在RA的炎症反应中,淋巴细胞可以通过启动细胞凋亡级联反应被清除[28],导致淋巴细胞水平降低,这与本研究的结果一致。
综上所述,Treg数目下降所介导的免疫耐受缺陷是RA发生的重要免疫学机制[3],随着RA病情的迁延及免疫失衡的加重,外周CD4+T细胞水平及Th2细胞的下降或许可促进ILD的进程,是RA患者发生ILD的危险因素,这为RA-ILD患者免疫治疗及发病机制的深入研究方向提供初步临床参考。

