芦丁减轻LPS诱导的牙周膜干细胞炎症、成骨分化和成脂作用
兰 婷,贾 如
(1西北妇女儿童医院口腔科,西安 710061;2西安交通大学附属口腔医院修复科;*通讯作者,E-mail:jiaru1987@mail.xjtu.edu.cn)
牙周炎是一种慢性炎性疾病,可引起牙龈脱离和牙槽骨崩解[1]。文献表明,牙周炎与骨质疏松症等全身性疾病相关[2],而且牙周炎与免疫反应有关,并受革兰氏阴性细菌脂多糖(lipopolysaccharide,LPS)的影响[3],但目前尚未完全阐明LPS-宿主相互作用的具体机制。牙周膜干细胞(periodontal ligament stem cells,PDLSCs)主要分布于牙周膜组织,其功能主要负责牙周韧带和牙槽骨的稳态[4,5],PDLSCs具有成骨分化潜力,可以修复和再生受损的牙周骨组织[6]。研究表明,PDLSCs可迁移至牙周病变的部位并介导牙周再生[7],PDLSCs在免疫缺陷小鼠中移植后会产生牙骨质/牙周韧带(periodontal ligament,PDL)样组织[8]。然而,炎性环境会损害PDLSCs的成骨分化[8],文献研究结果也表明,多种炎性因子对PDLSCs成骨分化具有抑制作用[9]。
芦丁也称为维生素P或紫槲皮苷,是一种黄酮醇类黄酮,主要存在于果蔬植物中,其具有许多药用价值,如抗癌、抗炎和抗氧化活性。文献表明,芦丁能够治疗炎性疾病和促进骨骼的再生[10],芦丁还可以在骨髓间充质干细胞中发挥骨保护作用[11]。同时也有研究表明,芦丁对骨细胞具有成骨促进作用,影响骨细胞的增殖活性[12]。Toll样受体(toll-like receptor,TLRs)是一类跨膜受体,可以识别并结合相应病原体相关分子,激活信号转导途径并诱导炎症细胞因子等一些免疫效应分子的表达[13]。TLR4是LPS和脂质A的受体,当LPS与TLR4结合时可激活白细胞介素1(interleukin-1,IL-1)、IL-6、IL-8和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等促炎性细胞因子的表达[14]。研究表明,LPS诱导PDLSCs的Toll样受体4/髓样分化因子88(Toll-like receptor 4/myeloid differentiation factor 88, TLR4/MyD88)复合物的激活,并进一步引发细胞因子的释放[15]。但TLR4在PDLSCs分化中的确切作用,以及潜在的分子机制尚未得到详细研究。本研究通过以PDLSCs细胞为载体,观察芦丁和LPS对PDLSCs细胞作用后所产生的成骨分化、炎症反应、氧化应激以及TLR4/NF-κB信号通路相关蛋白表达水平的变化,以探究芦丁是否可以减缓LPS对诱导PDLSCs成骨分化、成脂作用和TLR4/NF-κB信号通路的影响。
1 材料与方法
1.1 实验材料
青霉素、链霉素和磷酸盐缓冲盐水(PBS)购于成都里来生物科技有限公司;FBS、α-MEM培养基、RIPA裂解液、化学发光试剂盒购于美国Thermo公司;LPS和芦丁购于美国Sigma公司;培养皿购于NEST公司;胰蛋白酶、胶原酶购于美国Gibco公司;茜素红S购于上海雅吉生物科技有限公司;碱性磷酸酶(ALP)分析商用试剂盒、多聚甲醛购于碧云天生物技术研究所;BCA蛋白质测定试剂盒购于北京天根生化科技公司;Trizol试剂、ALP染色试剂盒购于碧云天生物技术研究所;NO试剂盒购于北京索莱宝科技有限公司;ELISA商用试剂盒购于上海纪宁实业有限公司;诱导型一氧化氮合酶(iNOS)试剂盒购于上海远慕生物科技有限公司;逆转录试剂盒HiScript Q RT Super Mix南京诺唯赞生物技术股份有限公司购于;一抗(p-NF-κB p65、MyD88、TLR4和GAPDH)和二抗IgG购于英国Abcam公司。
1.2 实验方法
1.2.1 PDLSCs的分离、培养及实验分组 本研究均获得每位受试者的知情同意,本项研究得到了西北妇女儿童医院伦理委员会的批准(批准号:No.2019-1-23-1016)。牙齿取自15~25岁的志愿者,他们需要正畸治疗以提取其前磨牙。在正畸拔除后,将牙齿转移到培养基中,并用含抗生素(100 U/ml青霉素、100 mg/ml链霉素)的磷酸盐缓冲盐水(PBS)冲洗牙齿3~4次,以去除凝结的血液。用手术刀片从牙根表面中间1/3处轻轻刮取牙周膜组织,然后用剪刀彻底切割成小块并将其转移到离心管中。向离心管中加入0.1%胶原酶,并置于37 ℃中消化60 min,然后加入1%胰蛋白酶继续消化30 min。加入等体积含10% FBS的α-MEM培养基溶液终止消化,于2 000 r/min离心10 min,去除上清,将沉淀使用含20% FBS的α-MEM培养基重悬,接种到10 cm的培养皿中培养,培养条件为5% CO2和37 ℃。每隔2~3 d更换1次培养基,直到细胞达到80%~90%的融合度。
为了选择LPS的最佳使用浓度,根据实验设计方案,将PDLSCs细胞于含不同浓度LPS(0,0.1,1,5 μg/ml)细胞培养基中培养14 d,并检验最佳LPS处理浓度;为了选择芦丁的最佳使用浓度,将PDLSCs细胞于含不同浓度芦丁(0,0.01,0.1,1,5,10,50,100 μmol/L)细胞培养基中培养14 d,并选择最佳芦丁浓度,然后执行1.2.2至1.2.4部分的检测实验。根据以上结果获得最佳浓度,并将实验分组为:对照组、芦丁组、LPS组和LPS+芦丁组。对照组PDLSCs细胞采用纯培养基培养,芦丁组PDLSCs细胞培养基中加入10 μmol/L的芦丁处理,LPS组PDLSCs细胞培养基中加入0.1 μg/ml的LPS处理,LPS+芦丁组PDLSCs细胞培养基中加入10 μmol/L的芦丁和0.1 μg/ml的LPS共同处理。然后对以上分组进行1.2.5至1.2.7部分的检测实验。
1.2.2 PDLSCs的形态学鉴定 将PDLSCs培养于10 cm的培养皿中,每2~3 d更换1次培养基。通过倒置荧光显微镜观察PDLSCs的形态,通过油红染色在倒置荧光显微镜下观察脂质液滴的形成。
1.2.3 PDLSCs的ALP活性测定和ALP染色 为了探究LPS对PDLSCs成骨分化的影响,将PDLSCs接种在6孔板或24孔板(5×104/孔)中,并在成骨培养基中分别补充LPS(0,0.1,1,5 μg/ml)。使用碱性磷酸酶(ALP)分析试剂盒检测ALP活性。将细胞在成骨诱导培养基中培养14 d,收集并洗涤细胞,使用细胞RIPA裂解液裂解细胞并通过BCA蛋白质测定试剂盒测定总蛋白浓度,加入50 μl分析缓冲液,然后在4 ℃下12 000 r/min离心3 min,然后加入50 μl的PNPP(5 mmol/L)反应液,于黑暗中60 ℃下反应60 min。最后,加入20 μl停止液,并在405 nm处测量吸光度。然后通过细胞总蛋白浓度计算ALP的活性。对于ALP染色,根据使用说明书,将细胞在成骨诱导培养基中培养14 d,使用ALP染色试剂盒进行染色,并于倒置荧光显微镜中观察。
1.2.4 茜素红S染色检测PDLSCs的矿化结节形成 为了探究LPS对PDLSCs成骨分化的影响,采用茜素红S染色检测PDLSCs的矿化结节形成。将PDLSCs培养于24孔板中,使用或不使用LPS和芦丁处理后,4%多聚甲醛固定。然后,在室温下用2%茜素红S溶液(pH=4.2)对PDLSCs染色30 min。然后使用PBS清洗3次后,使用倒置荧光显微镜观察,并使用Image J软件定量染色强度。
1.2.5 ELISA检测TNF-α、IL-6和IL-1β表达水平以及iNOS活性测定 为了探究LPS或芦丁对PDLSCs中炎性细胞因子和氧化应激标记物活性的影响,将PDLSCs培养于12孔板中,分别使用LPS和芦丁处理,待细胞处于对数生长期时进行后续实验。使用ELISA试剂盒定量分析细胞炎性因子TNF-α、IL-6和IL-1β表达水平。于37 ℃使用2’-7’-二氯磷脂酰二乙酸酯(DCFH-DA,20 μmol/L)避光染色30 min后通过酶标仪检测细胞上清液中ROS的含量。使用NO试剂盒根据使用说明书测定PDLSCs产生的NO。对于诱导型一氧化氮合酶(iNOS)活性测定,使用细胞RIPA裂解液裂解细胞,离心收集细胞上清液;将上清液与iNOS试剂盒的反应缓冲液于37 ℃混合孵育30 min,使用酶标仪测量吸光度。
1.2.6 RT-qPCR测定ALP、OCN、RUNX2、BMP2、PPARγ和LPL的mRNA表达水平 根据使用说明书,采用Trizol试剂提取PDLSCs的总RNA,使用逆转录试剂盒HiScript Q RT Super Mix对RNA(1 μg)进行逆转录合成cDNA。使用LightCycler 480II PCR仪在以下PCR扩增条件下进行RT-qPCR反应:95 ℃预变性2 min,40个循环:95 ℃ 20 s,60℃ 20 s和72 ℃ 20 s,然后在72 ℃下再延伸5 min。mRNA水平通过GAPDH水平标准化,并使用2-ΔΔCt方法计算。PCR扩增所用引物见表1。

表1 qPCR实验引物信息
1.2.7 蛋白质印迹分析PDLSCs中TLR4及NF-κB通路蛋白的表达水平 待PDLSCs在6孔板中融合度达到80%~90%,收集细胞,将PDLSCs用冷PBS洗涤,并在RIPA裂解缓冲液和1 mmol/L PMSF中裂解提取总蛋白,通过BCA蛋白质测定试剂盒测定蛋白质浓度。使用相同量的蛋白质浓度(30 μg)进行SDS-PAGE凝胶电泳,然后将蛋白质转移到PVDF膜上。然后,使用5%的脱脂奶粉封闭PVDF膜,并与一抗p-NF-κB p65(1 ∶500)、MyD88(1 ∶1 000)、TLR4(1 ∶1 000)和GAPDH(1 ∶1 000)在4 ℃下孵育过夜。使用TBST缓冲液洗涤3次后,将PVDF膜与二抗IgG(1 ∶10 000)在室温下孵育1 h。通过化学发光试剂盒和Bio-Rad凝胶成像仪检测蛋白条带,并通过ImageJ软件分析蛋白表达水平。
1.3 数据统计学分析
SPSS 21.0软件和GraphPad Prism 5.0用于所有实验数据的统计分析,数据均采用平均值±标准差表示,独立样本t检验用于两组之间的数据统计分析,多组之间的数据分析采用单因素方差分析,两两比较采用LSD检验。当P<0.05时,表示差异具有统计学意义。
2 结果
2.1 牙周膜干细胞的形态学鉴定
本研究所分离培养的细胞形态与成纤维细胞的形态相似,以纺锤形并可以形成螺旋排列(见图1A)。油红染色结果显示,培养基出现矿化且有红色堆积的结块(见图1B),利用倒置荧光显微镜进行观察发现这些红色结块为脂质滴(见图1C),这说明成功分离到牙周膜干细胞(PDLSCs)。
2.2 不同浓度的LPS对PDLSCs成骨分化的影响
ALP和茜素红S染色结果显示,与0 μg/ml LPS相比,第14天在0.1,1,5 μg/ml的LPS浓度处理下,ALP的活性和钙沉积物的形成水平均显著降低(P<0.01,见图2);在0.1,1,5 μg/ml的LPS浓度处理下,ALP的活性和钙沉积物的形成水平无统计学差异(P>0.05)。RT-qPCR检测结果显示,与0 μg/ml LPS相比,第14天在0.1 μg/ml LPS浓度处理下,成骨分化关键因子ALP、OCN、RUNX2和BMP2的mRNA水平显著降低(P<0.01,见图3);在0.1,1,5 μg/ml的LPS浓度处理下,各因子mRNA水平无显著性差异(P>0.05)。故本研究选择0.1 μg/ml的LPS作为后续实验的浓度。
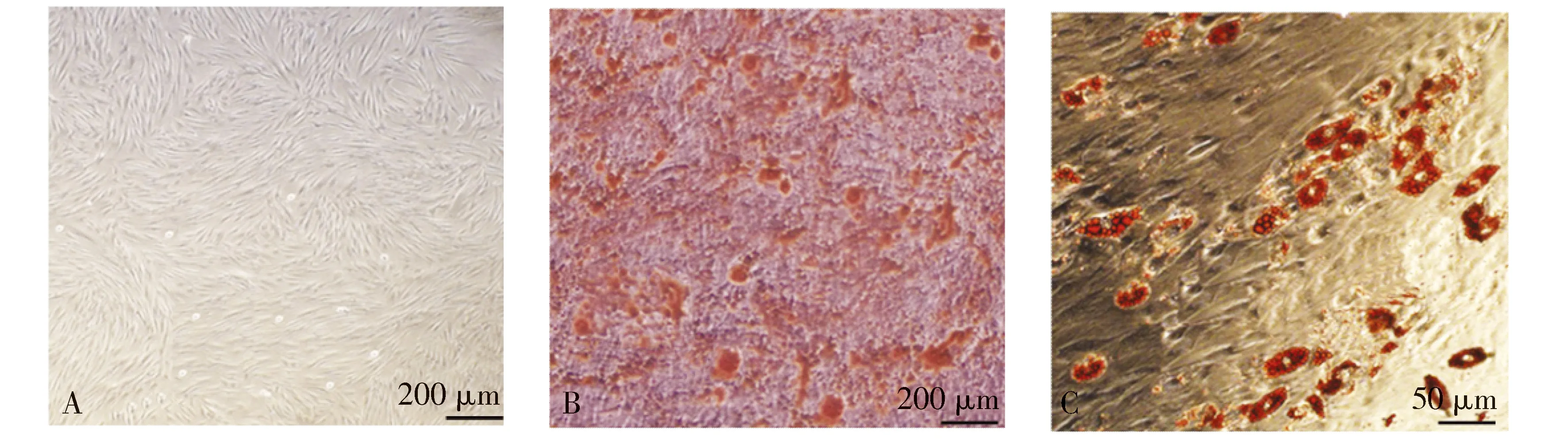
A.直接观察细胞形态;B.成骨诱导培养基中培养28 d后显微镜下细胞形态;C.脂肪细胞诱导培养基培养28 d倒置荧光显微镜下细胞形态图1 牙周膜干细胞的形态学鉴定Figure 1 Morphological identification of periodontal ligament stem cells
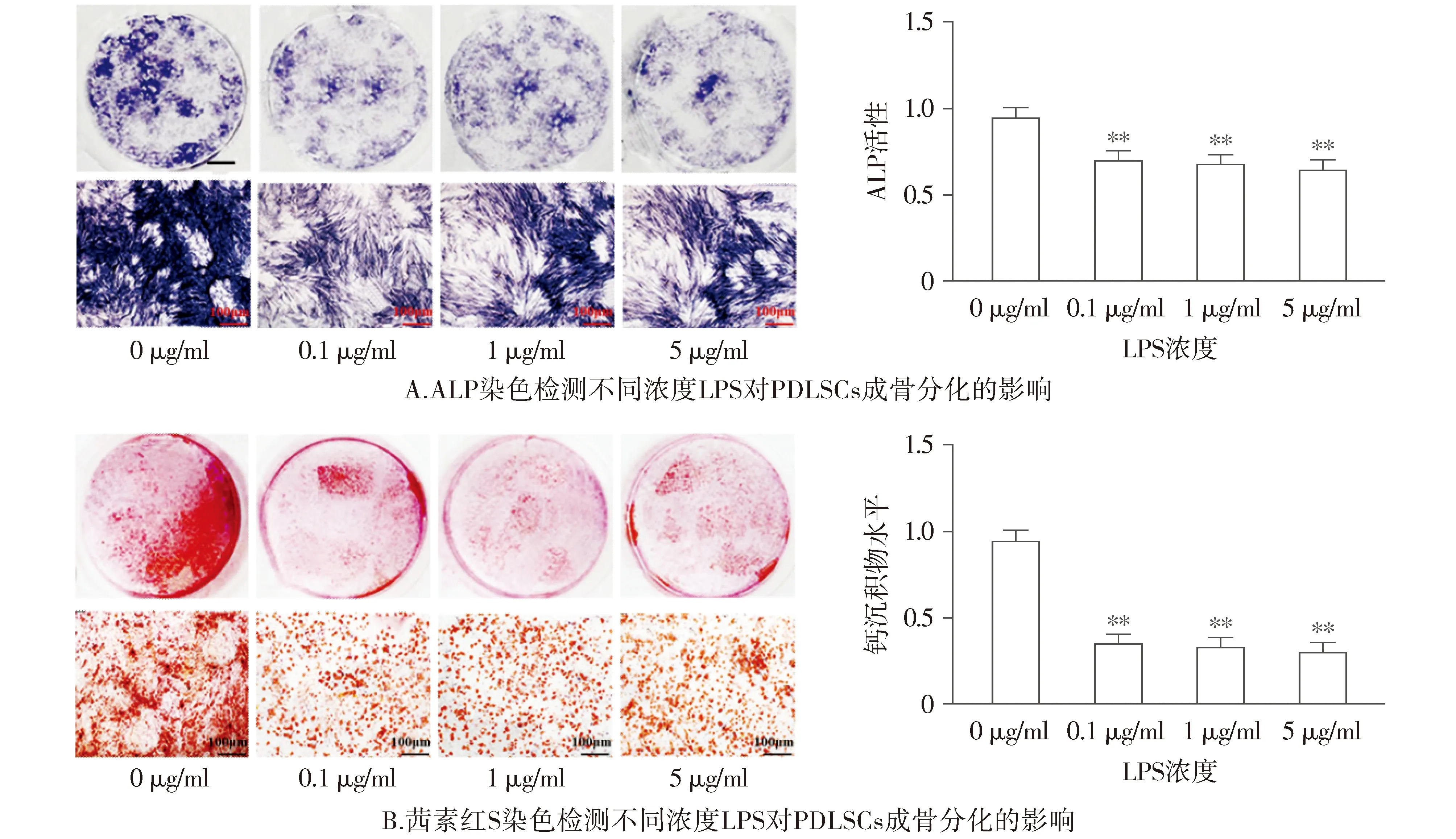
与0 μg/ml LPS相比,**P<0.01图2 不同浓度的LPS对PDLSCs成骨分化的影响 (n=5)Figure 2 Effect of different concentrations of LPS on the osteogenic differentiation of PDLSCs (n=5)

与0 μg/ml LPS相比,**P<0.01图3 不同浓度LPS对PDLSCs成骨分化关键因子mRNA表达水平的影响 (n=5)Figure 3 Effects of different concentrations of LPS on the mRNA levels of key factors in osteogenic differentiation of PDLSCs (n=5)
2.3 不同芦丁浓度减缓LPS对ALP活性的影响
ALP活性检测结果显示,与0 μmol/L芦丁处理相比,当芦丁浓度在0~10 μmol/L范围内,ALP的活性逐渐升高,在芦丁浓度为10 μmol/L时ALP的活性最高;与10 μmol/L芦丁处理相比,50 μmol/L和100 μmol/L芦丁处理下ALP活性均显著降低(P<0.05,见图4)。故本研究选择10 μmol/L芦丁作为后续实验浓度。
2.4 芦丁对LPS刺激PDLSCs中炎性细胞因子和氧化应激的影响
炎性细胞因子检测结果显示,与对照组相比,LPS组TNF-α、IL-6和IL-1β的表达水平显著升高(P<0.01);与LPS组相比,LPS+芦丁组TNF-α、IL-6和IL-1β的表达水平显著降低(P<0.01,见图5)。氧化应激水平检测结果显示,与对照组相比,LPS组ROS、NO和iNOS的表达水平显著升高(P<0.01);与LPS组相比,LPS+芦丁组ROS、NO和iNOS的表达水平显著降低(P<0.01,见图5)。

与0 μmol/L芦丁处理相比,*P<0.05;与10 μmol/L芦丁处理相比,#P<0.05图4 不同芦丁浓度处理对PDLSCs成骨分化的损伤影响 (n=5)Figure 4 Effects of different concentrations of rutin on the osteogenic differentiation of PDLSCs (n=5)

与对照组相比,**P<0.01;与LPS组相比,##P<0.01图5 芦丁对LPS刺激的PDLSCs中炎性细胞因子和氧化应激的影响 (n=5)图5 The effect of rutin on inflammatory cytokines and oxidative stress in PDLSCs stimulated by LPS (n=5)
2.5 芦丁减轻LPS诱导PDLSCs的成脂作用
成脂基因关键因子检测结果显示,与对照组相比,LPS组PDLSCs细胞中PPARγ和LPL的表达水平显著升高(P<0.01);与LPS组相比,LPS+芦丁组PDLSCs细胞中PPARγ和LPL的表达水平显著降低(P<0.01,见图6)。
2.6 芦丁抑制LPS诱导的PDLSCs中TLR4/NF-κB途径中关键因子的表达
蛋白质印迹结果显示,与对照组相比,芦丁组PDLSCs中p-NF-κB p65、MyD88和TLR4的表达水平差异无统计学意义(P>0.05),LPS组PDLSCs中p-NF-κB p65、MyD88和TLR4的表达水平显著升高(P<0.01);与LPS组相比,LPS+芦丁组PDLSCs中p-NF-κB p65、MyD88和TLR4的表达水平显著降低(P<0.01,见图7)。
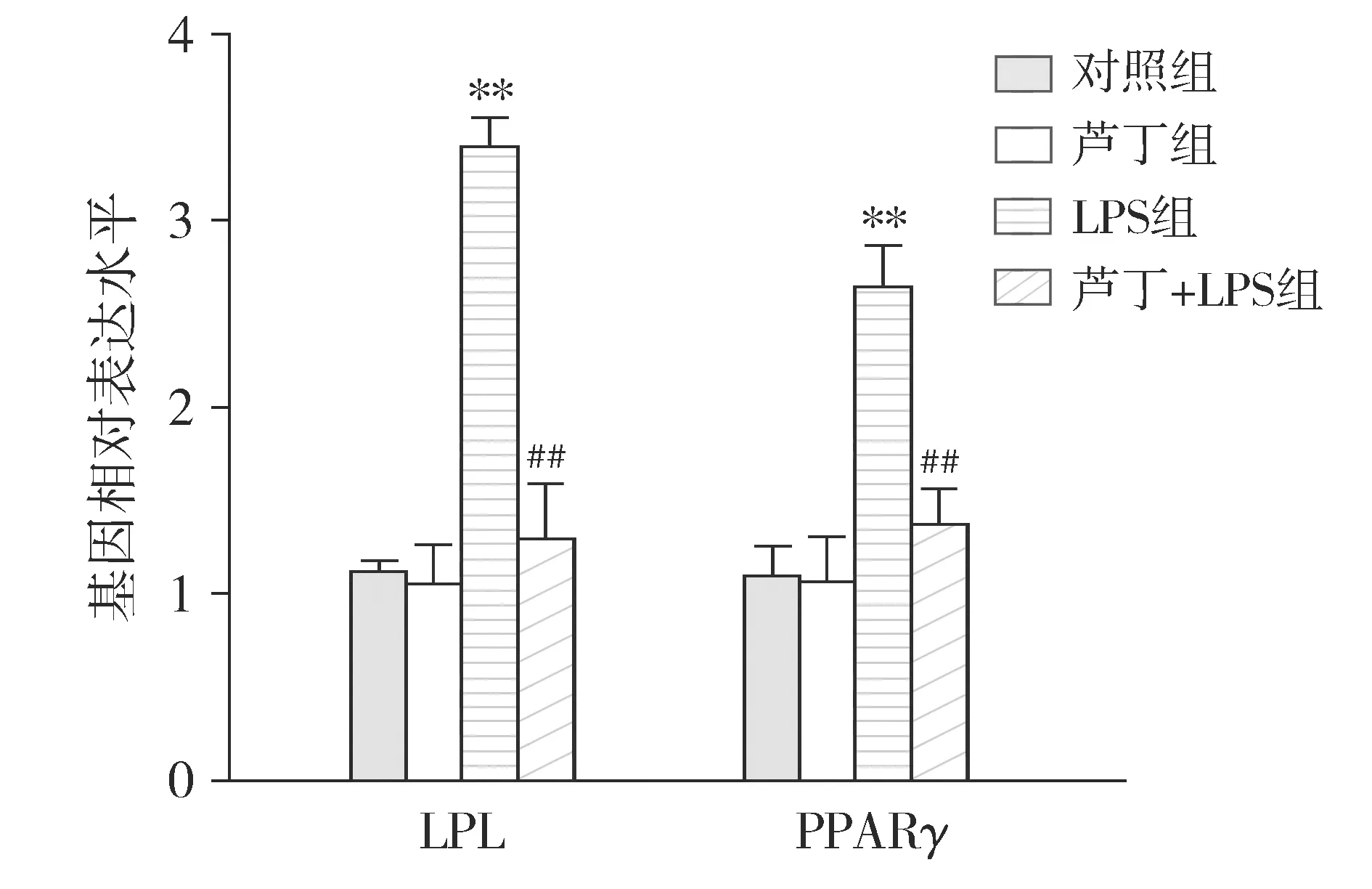
与对照组相比,**P<0.01;与LPS组相比,##P<0.01图6 芦丁对LPS诱导PDLSCs成脂作用的影响 (n=5)Figure 6 The effect of rutin on LPS-induced adipogenesis of PDLSCs (n=5)
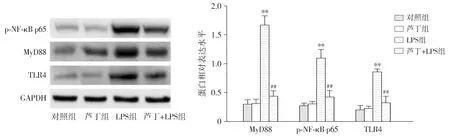
对照组相比,**P<0.01;与LPS组相比,##P<0.01图7 芦丁对LPS诱导PDLSCs TLR4/NF-κB表达的影响 (n=5)Figure 7 The effect of rutin on the expression of TLR4/NF-κB in PDLSCs induced by LPS (n=5)
3 讨论
牙周炎主要是由局部因素引起牙周支持组织的慢性炎症[16]。随着炎症的进一步发生,牙周膜被破坏,牙槽骨逐渐被吸收,最终牙周组织和骨组织被破坏[4]。文献表明,PDLSCs在牙周组织中具有再生能力[17]。作为未分化的间充质干细胞,PDLSCs具有多种分化潜能[18]。牙周炎发生发展过程中细胞炎性因子TNF-α会发生显著升高,而TNF-α是牙周炎的关键促炎因子[19]。TNF-α过量溢出会导致骨骼缺陷,并对骨骼发育产生不利影响[20]。芦丁作为一种抗炎药,可以通过局部作用于肠黏膜来改善炎性环境[21]。有研究结果显示,芦丁对模型大鼠的骨质疏松症具有一定的预防和治疗作用[22];芦丁能够显著提高成骨细胞中碱性磷酸酶的活性,以及骨钙素的分泌水平,进而促进成骨细胞的增殖和分化成熟[23]。同时,在炎症微环境下,10 μmol/L的芦丁能够改善炎症情况,上调ALP等成骨基因的表达水平,进而提高牙周膜干细胞的成骨分化能力[24]。本研究通过建立LPS诱导的PDLSCs作为牙周炎的体外模型,研究芦丁对牙周炎治疗作用的潜在机制,以为临床应用提供理论支持。
牙周炎是一种免疫介导的炎性疾病,其发生和发展涉及革兰氏阴性细菌的作用[25]。文献表明,LPS会导致PDLSCs中TNF-α和IL-1β的浓度增加,并显著抑制细胞增殖和迁移[26]。此外,LPS是细胞内活性氧的有效诱导剂,并导致鼠巨噬细胞中NO和iNOS含量显著增加[27]。本研究结果表明,LPS诱导PDLSCs中炎性细胞因子和氧化应激水平显著升高,而芦丁能有效抑制LPS引起的这些因子的过表达水平。这说明LPS诱导PDLSCs产生大量ROS,进而促进细胞内氧化应激水平的升高,而芦丁对牙周炎的治疗作用有可能是通过抑制ROS水平降低机体氧化应激水平实现的。
ALP是成骨细胞分化的标志,在结缔组织钙化和矿物质沉积中起关键作用[28]。研究表明,LPS可抑制成骨细胞中ALP的活性,以及抑制细胞代谢和活力[29]。本研究结果表明,与对照组相比,LPS显著抑制了ALP的活性及钙沉积物的形成,而芦丁有效逆转了LPS诱导的ALP活性降低。此外,通过芦丁处理LPS诱导的PDLSCs可提高OCN、RUNX2和BMP2(成骨分化关键因子)的mRNA水平。赵斌等[24]的研究结果显示,芦丁能够诱导COL1/RUNX2/ALP等成骨基因表达水平发生过不同程度的上调,该结果也表明芦丁可增强成骨分化和成脂能力,而本研究中成骨分化关键因子的基因表达水平变化也与该结果一致。
Toll样受体可识别微生物病原性分子,例如LPS、鞭毛蛋白和核酸[30]。PDLSCs可以表达多种TLR样受体[31];另外,TLR4被LPS识别,可刺激促炎细胞因子的产生和成骨分化[32]。文献结果表明,TLR4募集促炎介质受体相关激酶,通过与MyD88相互作用参与宿主对感染的炎症反应,然后激活下游信号通路如MAPK和NF-κB的传导途径,NF-κB信号传导在调节与炎症相关的分子和细胞因子编码的基因中起着至关重要的作用[33]。本研究结果显示,LPS诱导了TLR4/NF-κB信号通路(p-NF-κB p65,MyD88和TLR4)的激活,而芦丁有效降低了LPS诱导的NF-κB-65的磷酸化和TLR4的表达水平。有研究显示,LPS刺激诱导的TLR4/MyD88复合物的激活会触发细胞因子级联的释放,包括IL-8和IL-1α等[15];同时LPS刺激成骨细胞中Bax和Caspase-3的mRNA表达和蛋白水平上调,Bcl-2表达降低[34]。另外,LPS通过诱导TLR4信号通路激活,还可以降低细胞活力并促进细胞凋亡[35]。与上述结果一致,本研究中LPS对TLR4/NF-κB信号通路存在激活作用,但芦丁可以有效抑制LPS的激活作用,从而抑制炎症和促进细胞活力。
综上所述,芦丁通过PDLSCs中的TLR4/NF-κB途径减轻LPS诱导的炎症及减轻LPS诱导的成脂作用。因此,芦丁对牙周炎具有潜在的治疗作用,可能是牙周炎临床治疗的候选药物。

