缺血预处理在移植肾缺血-再灌注损伤中的应用进展
师朗 朱杰夫 吴雄飞
肾移植是目前治疗终末期肾病的最有效手段之一,可显著提高受者生存率和改善受者生活质量,已在全球范围内广泛应用。同种异体肾移植是常规的移植技术,也是一项复杂的、需要个体化预处理和严密监测的治疗方案。肾缺血-再灌注损伤(ischemia-reperfusion injury,IRI)仍然是影响供肾长时间保存的主要因素。如何减轻移植肾IRI也日渐成为重要的临床问题之一。因此,采用有效的器官保存及预处理技术是保证移植成功的重要前提。同时,缺血预处理(ischemic preconditioning,IPC)技术的开展一定程度上也拓展了供肾来源,使得终末期肾病患者具有更多移植的机会。近期,国内一家器官移植中心首创的无缺血肾移植手术,利用肾脏常温机械灌注机器在供肾获取、保存、移植全过程中,保持供肾血流和供氧不中断,减轻了供肾IRI[1]。IPC是指在长时间IRI前预先进行短暂的IRI处理,使靶器官对随后的缺血产生耐受性,从而减轻IRI[2]。IPC已在多种器官中实践,其中肾IPC是预防IRI发生的一种较为可行的方法[3]。Torras等[4]在大鼠肾移植模型中发现,预先15 min的热缺血和10 min的再灌注是预防热缺血和冷缺血损伤最有效方式。然而,Behrends等[5]和Kosieradzki等[6]在猪和狗大型动物模型中发现IPC并不能减轻肾IRI。此外,在猪肾移植模型研究中也发现,IPC并未提高移植肾热损伤后的恢复能力,反而存在一定的累加损伤效应[7]。IPC在小动物肾移植模型中的保护作用并未在较大动物中体现。由此可见,IPC对移植肾IRI的影响仍存在较大争议,较少有临床试验进一步评估IPC对肾移植中冷缺血损伤的疗效。
1 IPC在IRI中的应用
IPC按操作时间点可分为近期IPC(正式缺血前24 h以内)和远期IPC(正式缺血前24 h以上);按操作方式可分为连续IPC(持续15 min)和间断IPC(循环脉冲式);按操作部位可分为远程IPC(remote IPC,RIPC)和靶器官IPC(local IPC,LIPC)。在肾功能及肾组织病理学中观察到IPC操作时间可影响IPC的效果:与近期IPC相比,远期IPC者更能有效减轻肾IRI[8]。但目前注册的临床试验几乎都只使用近期IPC[8]。近、远期IPC的效果可能存在差异,未来的研究设计应更关注于最佳保护时间。RIPC最先在心脏研究中应用,并证实通过对远处组织或器官中进行短暂的缺血-再灌注,可使靶器官对随后较重的IRI有抵抗能力,被认为是一种很有前景的预防急性肾损伤(acute kidney injury,AKI)的方法[9]。在一项接受心脏手术高危患者的临床研究中已证实,RIPC可显著降低此类患者AKI的发生率,减少肾脏替代治疗的使用[10]。此外,在活体肾移植中发现,RIPC有益于术后远期肾功能的改善[11]。在单肾动物模型中发现,热缺血情况下,RIPC未能降低部分肾切除术对肾功能的影响[12]。在一项关于RIPC对肾移植术后肾功能影响的临床研究中发现,RIPC不仅可减轻移植肾IRI,还可促进移植肾功能的早期恢复[13]。由于短暂的缺血也存在损坏患者靶器官的风险,LIPC在临床实践中的使用受到一定限制。IPC操作易于在远端肢体等次要部位实现,因此RIPC具有更大的临床应用潜力。研究发现LIPC和RIPC同样有效,表明LIPC具有相同的临床转化潜力[8]。总之,LIPC和RIPC都具有减轻IRI的潜力,并且由于短暂肢体缺血的RIPC具有安全且易操作的优点,因此后者在临床实践中的潜力更大。RIPC的信号机制可能是体液通讯、神经元刺激、循环免疫细胞的系统性修饰和缺氧诱导因子的激活[14]。
2 IPC对移植肾IRI的调控机制
2.1 细胞水平的调控
IPC可通过直接调控靶细胞发挥作用,如诱导内皮细胞归巢、通过一氧化氮直接作用于内皮细胞及调控细胞周期等。IPC诱导的内皮祖细胞(endothelial progenitor cell,EPC)归巢对大鼠肾IRI具有保护作用[15]。进一步研究发现,IPC是通过EPC影响血管内皮生长因子-A和基质细胞衍生因子(stromal cellderived factor,SDF)-1α的释放来促进细胞增殖和血管生成,从而发挥对肾脏的保护作用[16]。有研究发现,促红细胞生成素(erythropoietin,EPO)预处理EPC可促进再灌注24 h后SDF-1α的表达,对肾脏手术引起的IRI具有一定的保护作用[17]。IPC也可能是通过EPO影响EPC,发挥肾脏保护作用。目前发现,氧衍生自由基的形成和随后的脂质过氧化是移植肾损伤的影响因素,维生素E作为主要的内源性抗氧化剂可通过干扰脂质过氧化来稳定细胞膜,而IPC可以维持体外维生素E的水平[18]。因此,IPC通过维持维生素E的水平,发挥抗氧化作用,可能是保护移植肾的另一种方法。
另外,免疫细胞水平对于移植肾的存活至关重要。大多情况下,免疫细胞是通过炎症因子及诱发炎症事件来实现其功能。有研究通过在肾移植术后3个月的不同时间点分别测量树突状细胞各亚型计数和细胞因子水平发现,RIPC组和对照组相比差异无统计学意义,但随着时间的推移,两组的几个参数表现出动态平行向的变化,提示RIPC可以通过对树突状细胞等免疫细胞的直接调控来影响移植肾IRI[19]。但也有研究表明,IPC对IRI的保护作用并不能通过早期炎症事件来解释[20]。由此可见,IPC对移植后免疫调节功能的影响存在异议。
更有趣的是,有学者发现IPC对大鼠肾功能、肾脏病理和肾动脉血流量均有明显改善(对全身血流动力学和肾静脉血流量无明显影响),可能是通过内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)/诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)介导的一氧化氮直接作用于靶细胞引起[21]。IPC也可能通过激活一氧化氮的产生来降低肾交感神经活动和去甲肾上腺素的释放,进一步缓解IRI引起的AKI[22]。更有学者通过测序在RIPC组中发现存在848个基因的表达水平发生了改变,并且这些基因(包括编码细胞因子、细胞因子受体以及在补体系统和凝血级联反应中起作用的基因)主要与免疫反应和炎症相关[23]。以上这些发现提示IPC通过多种机制对肾脏产生保护作用,并且这些作用在一段时间后才发生发展,并非在IPC后立刻出现。
单次的RIPC可通过血管内皮细胞引起微血管系统的延迟反应而导致皮肤血管舒张反应功能改善,且该反应在RIPC后48 h达到峰期[14]。肾小管上皮细胞增殖替换缺血坏死的肾小管是IRI后修复中关键的一环[24],而这必定涉及到细胞周期。有研究发现,IPC可直接影响肾小管上皮细胞周期。如在接受心脏手术的高危患者中进行RIPC可减少AKI的发生以及肾脏替代治疗的需求,可能是通过调节细胞周期来实现的[10]。细胞周期由不同的阶段组成,静止细胞通常处于G0状态,细胞只有程序性进入和退出细胞周期的每个阶段才能完成修复功能,节律打乱后正常的修复和恢复过程可能会变得不适应[25]。肾小管上皮细胞在G1或G2中保持停滞趋向于肥大和纤维化,而在G1晚期退出细胞周期会导致细胞凋亡[26]。研究发现,RIPC的作用机制与细胞周期阻滞生物标志物金属蛋白酶组织抑制因子(tissue inhibitor of metalloproteinase,TIMP)-2和胰岛素样生长因子结合蛋白(insulin-like growth factor binding protein,IGFBP)7释放到尿液中密切相关[27]。IGFBP7和TIMP-2都是G1细胞周期停滞的诱导剂,参与AKI的早期阶段[28]。由此可见,RIPC也可通过影响肾小管上皮细胞周期而减轻IRI。总之,IPC对细胞调控是从多维度、多体系发挥作用,过程较为复杂,有待我们进一步深入研究。
2.2 细胞内信号通路的调控
IPC和线粒体自噬密切相关。研究发现,IPC可通过Unc-51样激酶(Unc-51 like kinase,Ulk)1触发FUN14结构域包含蛋白(FUN14 domaincontaining,FUNDC1)1激活线粒体自噬,从而减轻肾IRI[17]。IPC可激活线粒体自噬调节剂PTEN诱导假定激酶(PTEN-induced putative kinase,PINK)1,并促使线粒体向溶酶体传递,加快受损线粒体的清除。同时,IPC还抑制线粒体去极化和活性氧的产生,促进三磷酸腺苷(adenosine triphosphate,ATP)的产生。可见线粒体自噬在IPC的保护作用中至关重要[29]。IPC也可通过上调肾脏自噬通量减轻IRI诱导的AKI[30]。
肾酶是一种由近端小管分泌的胺氧化酶,不仅可以降解循环中的儿茶酚胺,还可以防止肾IRI。内源性肾酶具有防治AKI的潜力,IPC对肾脏保护部分作用依赖于缺氧诱导因子(hypoxia-inducible factor,HIF)-1α诱导产生的肾酶[31]。IPC还可通过上调谷胱甘肽-S-转移酶(glutathione-S-transferase,GST)及下调水通道蛋白(aquaporin,AQP)1减轻肾IRI[32]。糖原合成酶激酶(glycogen synthase kinase,GSK)-3β是由肢体IPC触发的多个保护性信号通路的汇聚点,IPC可通过调节GSK-3β调控核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2),发挥预防AKI的作用[33]。IPC还可通过吲哚胺-2,3-双加氧酶(indoleamine 2,3-dioxygenase,IDO)1/犬尿氨酸途径防止缺血性肾损伤[34]。另外,由于反调节激素(胰高血糖素、去甲肾上腺素和皮质酮)与氧化应激的诱导有关,有学者发现通过IPC降低反调节激素水平可减轻肾IRI,反调节激素很可能是IPC对抗肾IRI的重要靶点[35]。总之,IPC可通过直接靶向多种信号功能蛋白产生对肾IRI对抗作用,笔者总结见图1。
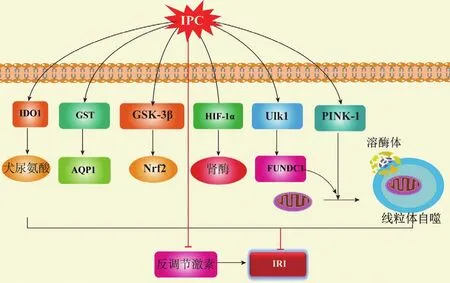
图1 IPC减轻肾IRI的胞内信号通路Figure 1 Intracellular signaling pathway of IPC attenuating renal IRI
IPC可通过微小核糖核酸(microRNA,miRNA,miR)在转录水平对IRI进行调控。在(双侧)IRI大鼠模型中发现间断IPC可影响多种miRNA的信号传导,IRI后miR-21-5p、miR-221-3p和miR-222-3p明显上调,而IPC可通过抑制定位于肾小管上的miR-21-5p、miR-221-3p和miR-222-3p上调发挥保护作用[36]。对肾移植受者尿液miRNA进行测序分析发现,IRI后 miR-9、miR-10a、miR-21、miR-29a、miR-221 和miR-429显著上调,表现为肾功能恢复延迟,但其均可被IPC抑制,这些miRNA可能作为肾小管缺血性损伤的生物标志物[36]。另有研究发现,肾脏中表达水平较高的miR-21-5p可通过靶向丝裂原活化蛋白激酶激酶(mitogen-activated protein kinase kinase,MKK)3抑制下游的白细胞介素(interleukin,IL)-6和肿瘤坏死因子(tumor necrosis factor,TNF)-α,IPC可通过上调miR-21-5p明显逆转这种现象[37]。IPC可通过抑制肾IRI导致生长停滞特异性转录因子(growth arrest-specific,GAS)5水平上调,而在IPC之前敲除miR-21可显著上调GAS5的水平。此外,血小板反应素(thrombospondin,TSP)-1在体内和体外均受到miR-21的负调控[38]。可见,miR-21-5p是IPC在转录水平调控IRI发挥保护移植肾的重要核心枢纽环节,在调节保护性和病理性分子途径方面发挥着重要作用,笔者总结见图2。
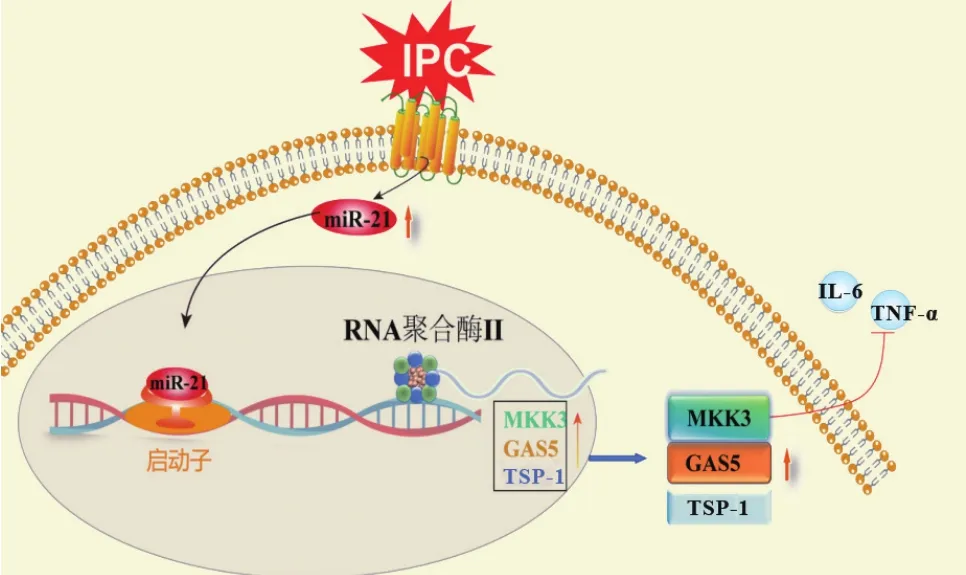
图2 IPC通过miRNA调控IRI的机制Figure 2 The mechanism of IPC regulating IRI by miRNA
3 IPC的临床应用价值和前景
自20世纪90年代首次发现IPC对移植肾IRI具有保护作用以来,各项实验研究不断开展,但只有极少数的IPC在临床试验中得到了预期的结果。目前,IPC对IRI保护作用的研究大多仍停留在动物实验阶段,IPC从实验领域转化为临床实践仍然面临着巨大的挑战及困难。考虑到全球移植器官短缺是主要的公共卫生问题之一,且移植物的存活时间有限,这种预处理方法可以使器官能够耐受IRI,从而提高移植物和受者的存活率。LIPC和RIPC都具有减轻IRI的潜力,并且由于RIPC具有安全且易于操作的优点,其在临床实践中的潜力更大。随着对IPC的不断研究,我们提出猜想:在进行活体器官捐献肾移植时,能否在保证安全的情况下对捐献者进行RIPC,或要求捐献者预先在高海拔地区等安全缺氧条件下短期居住。更为重要的是,迄今为止,还没有研究探讨IPC对合并症(如糖尿病、高血压或肥胖症)患者肾IRI的影响,以及IPC在不同性别的患者中效果是否存在差异。总之,未来的临床研究设计应更趋向于突出某些特定群体组内的IPC疗效研究,通过对该领域的动物研究将为临床试验的设计提供参考。

