末端岩藻糖基化抑制剂对环孢素诱导的肾脏上皮-间充质转化的影响及其机制
毛凯锋 罗嘉亮 林芬望 左大明 叶俊生
环孢素(ciclosporin,CsA)是肾移植术后抗排斥反应的基础免疫抑制剂,长期使用CsA的受者不可避免地会出现肾毒性、神经毒性、高血压、牙龈生长过度等不良反应[1-6],特别是CsA引起的肾毒性限制了其在临床上的广泛应用[7]。据报道,CsA引起的肾毒性发生率高达50%~70%[8],已经成为临床移植肾功能丧失的主要原因之一[9]。虽然CsA肾毒性的潜在机制仍未完全了解,但已有证据表明上皮-间充质转化(epithelial-mesenchymal transition,EMT)在其中发挥着重要作用[10]。CsA可以诱导肾脏发生EMT,进而引起肾脏纤维化,最终导致肾毒性[11-12]。近年来,越来越多的研究关注了肾脏纤维化与岩藻糖基化反应之间的关系[13-15]。
岩藻糖基化反应可以分为核心岩藻糖基化反应、亚末端岩藻糖基化反应、末端岩藻糖基化反应以及O-岩藻糖基化反应[16]。岩藻糖基化反应需要岩藻糖基转移酶(fucosyltransferase,FUT)的催化,其中末端岩藻糖基化反应由FUT1/2催化[17-18]。在乳腺癌中,FUT1/2可以促进乳腺癌细胞发生EMT[19]。2-脱氧-D-半乳糖(2-deoxy-D-galactose,2-D-gal)是一种末端岩藻糖基化抑制剂,可以抑制FUT1/2催化的末端岩藻糖基化反应[20],然而2-D-gal对CsA诱导的肾脏EMT的影响相关研究鲜有报道。本研究拟探讨2-D-gal对CsA诱导的肾脏EMT的影响及其机制。
1 材料与方法
1.1 实验动物
8~10周野生型C57BL/6雄性小鼠购于广东省医学实验动物中心。小鼠饲养于标准无特定病原体(specific pathogen free,SPF)环境中,温度为20~25 ℃,湿度为(50±5)%,光暗循环(12 h∶12 h),所有小鼠自由进食、饮水。本实验获得南方医科大学实验动物伦理委员会批准(L2016014),所有实验人员均善待实验动物。
1.2 主要试剂与仪器
CsA购自中国麦克林公司,2-D-gal购自德国Merck公司,人源肾近端小管上皮细胞株HK2购于武汉普诺赛生命科技有限公司,DMEM培养基、胎牛血清购自美国Gibco公司。异硫氰酸荧光素( fluorescein isothiocyanate,FITC)标记的荆豆凝集素Ⅰ(ulex europaeus agglutininⅠ,UEAⅠ)购自美国Invitrogen公司(UEAⅠ可以特异性识别末端岩藻糖),FUT1、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、Vimentin、E-cadherin抗体购自美国Proteintech公司,血尿素氮、血清肌酐测定试剂盒购自南京建成生物工程研究所有限公司,倒置显微镜、荧光显微镜购自日本Nikon公司,电泳仪购自美国Bio-Rad公司。
1.3 实验方法
1.3.1 小鼠分组与处理 将15只C57BL/6小鼠随机分为对照组(Ctrl组)、CsA组和CsA+2-D-gal组,每组各5只。Ctrl组以橄榄油50 mg/(kg·d)连续皮下注射28 d;CsA组以CsA 50 mg/(kg·d)连续皮下注射28 d;CsA+2-D-gal组以 CsA 50 mg/(kg·d)连续皮下注射28 d,同时隔日腹腔注射2-D-gal 250 mg/(kg · d)。
1.3.2 小鼠标本收集 给药结束后1 d,造模小鼠麻醉后进行眼眶采血,然后脱颈处死,摘下肾脏,去除包膜,沿肾脏长轴方向对切,剪取部分肾组织,用4%多聚甲醛溶液固定,石蜡包埋切片。将眼眶采集的血液室温下放置1 h,离心后吸取上层血清置于EP管中,用于检测小鼠血尿素氮和血清肌酐水平。
1.3.3 肾脏组织Masson染色 将石蜡切片切出10 μm的切片,进行Masson三色染色,在显微镜下观察并拍照,然后通过Image J软件计算每个视野中的胶原纤维面积比例。
1.3.4 细胞培养、处理与分组 用含10%胎牛血清和1%双抗(青霉素+链霉素)的DMEM培养基培养HK2细胞,并且置于37 ℃、5% CO2饱和湿度培养箱中。当细胞生长状态良好,融合度达到80%左右时更换为含4%胎牛血清和1%双抗(青霉素+链霉素)的DMEM培养基培养,分别用0、2.5、5.0和10.0 μmol/L的CsA刺激HK2细胞24 h,另将HK2细胞分为Ctrl组、2-D-gal组、CsA组和CsA+2-D-gal组,Ctrl组不加CsA或2-D-gal处理,2-D-gal组加入1.2 μmol/L的2-D-gal,CsA组加入10 μmol/L的CsA,CsA+2-D-gal组加入1.2 μmol/L的2-D-gal和10 μmol/L的CsA培养24 h。于倒置显微镜下观察HK2细胞形态。
1.3.5 蛋白质印迹法检测FUT1和EMT相关蛋白E-cadherin、Vimentin、α-SMA的表达 提取各组小鼠肾脏组织和HK2细胞总蛋白,进行电泳、转膜、封闭,孵育一抗(FUT1、E-cadherin、Vimentin和α-SMA),4 ℃过夜,洗涤后加入二抗,室温孵育1 h,洗膜后用化学发光法对印迹曝光显影。采用Image J软件分析FUT1、E-cadherin、Vimentin和α-SMA蛋白相对表达量。
1.3.6 免疫荧光染色检测末端岩藻糖的表达 石蜡切片脱蜡、酒精脱水、抗原修复、封闭。细胞爬片固定、通透、封闭。往玻片上滴加FITC标记的UEAⅠ,4 ℃孵育过夜。洗涤后用4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI) 染核5 min,滴加防淬灭剂封片。荧光显微镜下观察并获取图像。
1.3.7 血尿素氮和血清肌酐水平的检测 按照测血尿素氮测定试剂盒和血清肌酐测定试剂盒操作说明,分别检测小鼠的血尿素氮和血清肌酐水平。
1.4 统计学方法
采用SPSS23.0软件进行统计学分析。符合正态分布的计量资料采用均数±标准差表示,组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 CsA对小鼠肾脏组织EMT相关蛋白表达和末端岩藻糖基化的影响
蛋白质印迹法结果显示,与Ctrl组比较,CsA组小鼠肾脏组织E-cadherin的蛋白相对表达量下降,FUT1、Vimentin和α-SMA蛋白相对表达量均升高,差异均有统计学意义(均为P<0.05,图1A)。免疫荧光染色结果提示,与Ctrl组比较,CsA组小鼠肾脏组织末端岩藻糖表达增多(图1B)。
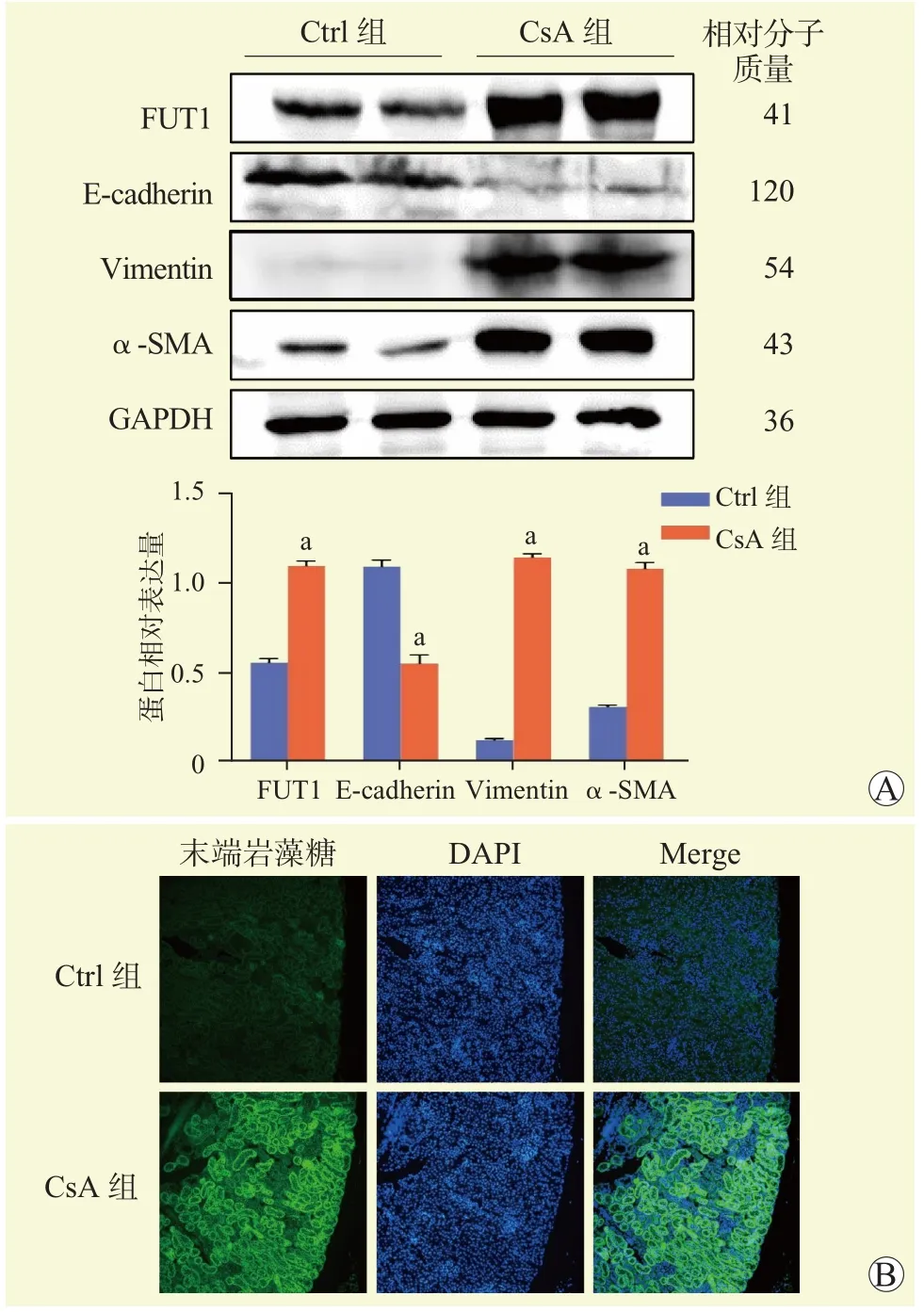
图1 CsA对小鼠肾脏组织EMT相关蛋白表达和末端岩藻糖基化的影响Figure 1 Effects of CsA on EMT-related protein expression and terminal fucosylation in renal tissue of mice
2.2 2-D-gal对CsA诱导的小鼠肾功能损害的影响
与Ctrl组比较,CsA组和CsA+2-D-gal组小鼠的血尿素氮和血清肌酐水平均升高,差异均有统计学意义;与CsA组比较,CsA+2-D-gal组小鼠的血尿素氮和血清肌酐水平均降低,差异均有统计学意义(均为P<0.05,图 2)。
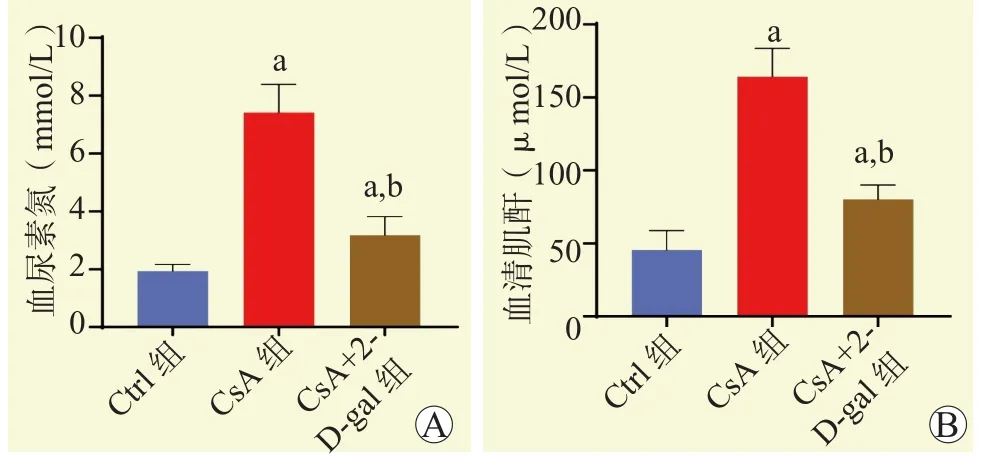
图 2 各组小鼠血尿素氮与血清肌酐水平Figure 2 Blood urea nitrogen and serum creatinine levels of mice in each group
2.3 2-D-gal对CsA诱导的小鼠肾脏纤维化的影响
Masson染色结果提示,与Ctrl组比较,CsA组和CsA+2-D-gal组小鼠肾脏组织胶原纤维沉积均增多;与CsA组比较,CsA+2-D-gal组小鼠肾脏组织胶原纤维沉积减少,差异均有统计学意义(均为P<0.05,图3A)。蛋白质印迹法结果显示,与Ctrl组比较,CsA组和CsA+2-D-gal组小鼠肾脏组织中α-SMA蛋白相对表达量均升高;与CsA组比较,CsA+2-D-gal组小鼠肾脏组织中α-SMA蛋白相对表达量下降,差异均有统计学意义(均为P<0.05,图3B)。
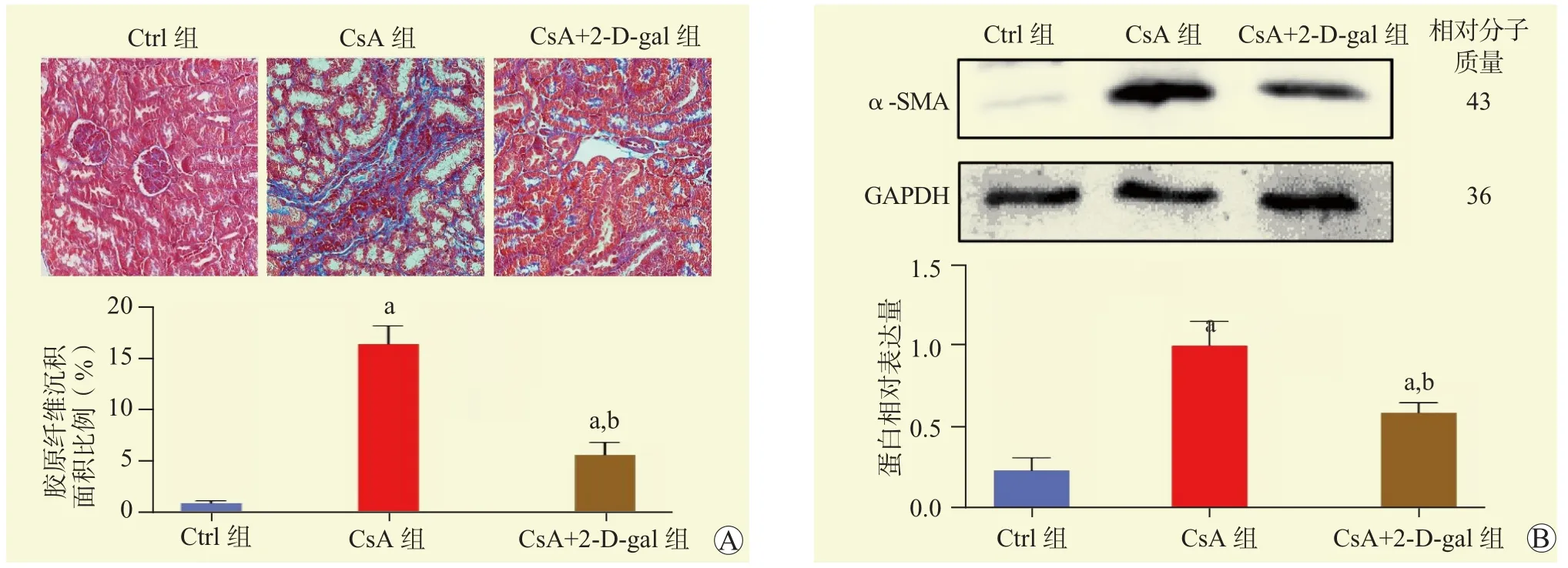
图 3 各组小鼠肾脏组织纤维化情况Figure 3 Renal tissue fibrosis of mice in each group
2.4 CsA对HK2细胞形态、EMT相关蛋白表达和末端岩藻糖基化的影响
随着CsA的浓度增加,HK2细胞的形态由正常的鹅卵石样逐渐变长变细,呈浓度依赖性(图4A)。蛋白质印迹法结果显示,随着CsA的浓度增加,HK2细胞FUT1、Vimentin和α-SMA蛋白相对表达量升高,E-cadherin蛋白相对表达量下降,差异均有统计学意义(均为P<0.05,图4B)。免疫荧光染色结果提示,与Ctrl组比较,CsA组HK2细胞末端岩藻糖表达增多(图4C)。
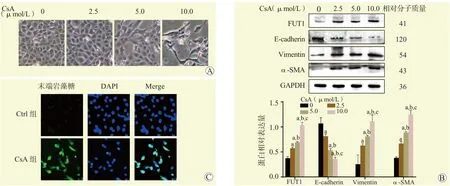
图4 CsA对HK2细胞形态、EMT相关蛋白表达和末端岩藻糖基化的影响Figure 4 Effects of CsA on morphology of HK2 cells, expression of EMT-related protein and levels of terminal fucosylation
2.5 2-D-gal对CsA诱导的HK2细胞EMT的影响
与Ctrl组比较,CsA组的HK2细胞形态变长变细,向成纤维细胞状改变,CsA处理的基础上联合2-D-gal干预后,CsA+2-D-gal组的HK2细胞形态变为与正常HK2细胞形态相似(图5A)。蛋白质印迹法结果显示,与Ctrl组比较,CsA组的HK2细胞E-cadherin的蛋白相对表达量下降,Vimentin和α-SMA蛋白相对表达量均升高;与CsA组比较,CsA+2-D-gal组的HK2细胞E-cadherin蛋白相对表达量升高,Vimentin和α-SMA蛋白相对表达量均下降,差异均有统计学意义(均为P<0.05,图5B)。
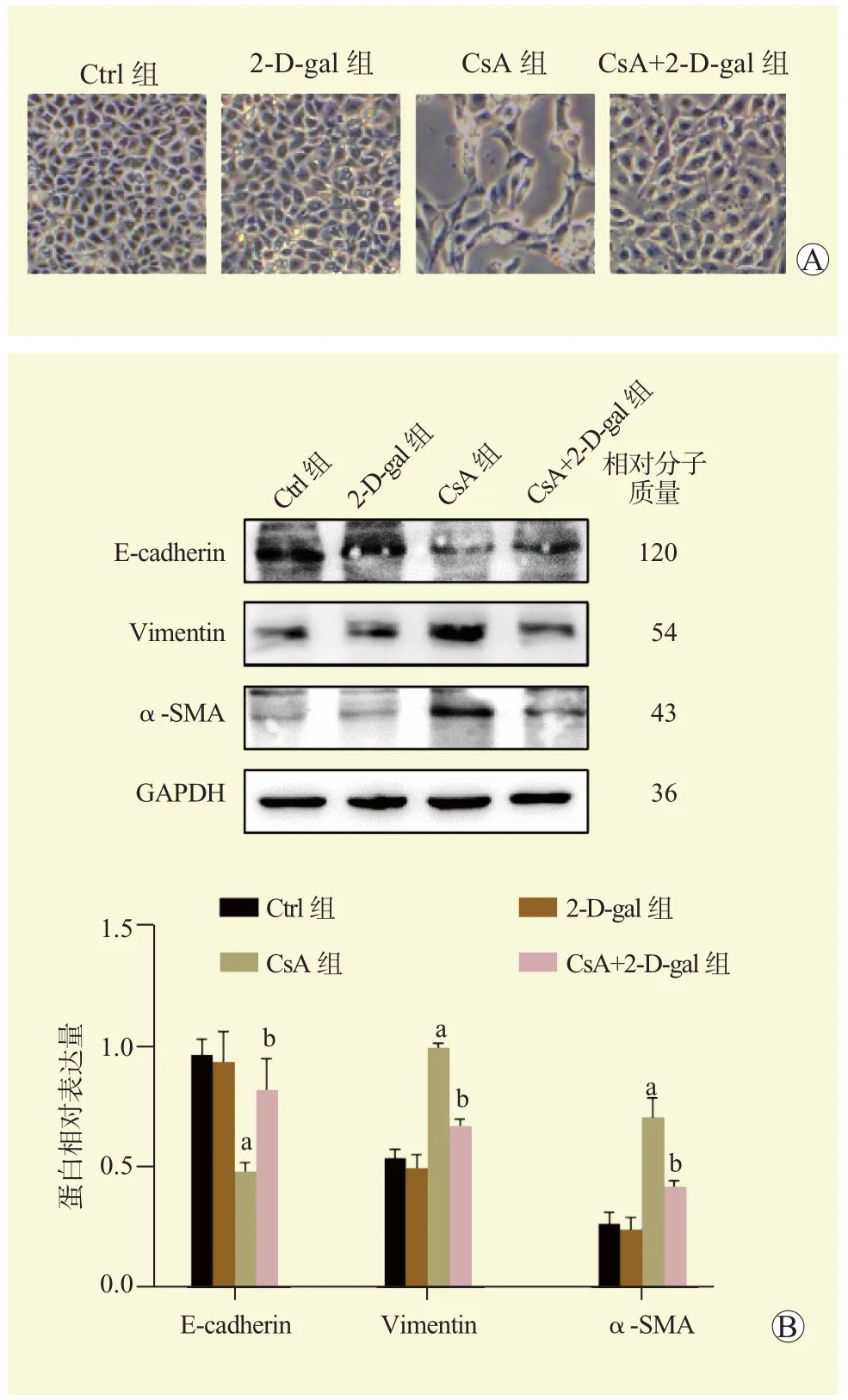
图 5 各组HK2细胞形态及EMT相关蛋白表达水平Figure 5 Morphology of HK2 cells and expression of EMT-related protein levels in each group
3 讨 论
CsA可用于实体器官移植和自身免疫性疾病的治疗,然而长期使用CsA的患者不可避免地会出现肾毒性(即肾脏纤维化),限制了其在临床上的广泛应用[21-23]。肾脏纤维化是多种进展性肾脏疾病的最终共同途径,发生机制复杂,其中肾脏发生EMT是一个重要的因素[24]。EMT是肾脏组织受到损伤后进行修复的重要过程,其特点是肾小管上皮细胞获得间充质表型和肌成纤维细胞功能[24]。EMT的转变可以诱导肾小管上皮细胞黏附连接蛋白如E-cadherin的表达减少,并诱导成纤维细胞标志物如α-SMA的表达[25]。因此,长期接受CsA治疗的患者的肾功能会受到损害,通常表现为血尿素氮和血清肌酐水平升高[26]。本研究结果表明,给小鼠皮下连续注射CsA 28 d后,肾脏组织α-SMA和Vimentin表达升高,E-cadherin表达下降,并且小鼠血尿素氮和血清肌酐水平均升高,同时肾脏胶原纤维沉积也增加,表明CsA处理引起小鼠肾损伤,在此过程中小鼠肾脏组织发生了EMT。
岩藻糖基化通常用来修饰细胞表面蛋白和脂质的糖链末端[27-28]。到目前为止,在人类身上共发现13种FUT,其中FUT1催化末端岩藻糖基化反应,FUT8催化核心岩藻糖基化反应[16]。Fang等[13]研究发现,核心岩藻糖基化参与了糖尿病肾病的进展,在小鼠体内抑制核心岩藻糖基化后可以阻止糖尿病肾病的进展。然而末端岩藻糖基化是否也参与了肾脏纤维化过程,目前相关证据较少。Loong等[20]报道,2-D-gal可以通过抑制溶酶体关联膜蛋白2(lysosomal associated membrane protein 2,LAMP2)、细胞间黏附分子 1(intercellular adhesion molecule-1,ICAM-1) 和表皮生长因子受体(epidermal growth factor receptor,EGFR)等受体上的末端岩藻糖基化来促使肝肿瘤对索拉非尼治疗敏感。本研究通过蛋白质印迹法和免疫荧光染色法检测了小鼠肾脏末端岩藻糖基化水平,结果提示,在CsA诱导的小鼠肾脏纤维化模型中末端岩藻糖基化水平升高,使用2-D-gal处理可以明显抑制小鼠的肾脏纤维化程度,改善肾功能。
肾小管上皮细胞的可塑性是肾脏纤维化的重要因素[29-30]。据报道,CsA可以直接作用于肾小管上皮细胞,并诱导其发生EMT,最终引起肾脏纤维化[10]。已有研究证明,在肺腺癌细胞中,末端岩藻糖基化反应上调,并且与肺腺癌细胞的EMT有关,抑制末端岩藻糖基化反应可以明显减弱EMT,抑制肺腺癌细胞的转移[31]。本研究采用了人源肾近端小管上皮细胞株HK2细胞来探究CsA对肾小管上皮细胞的直接作用,用不同浓度的CsA处理HK2细胞后发现,EMT相关蛋白表达和末端岩藻糖基化水平随着CsA的浓度增加而增加,具有浓度依赖性,当CsA联合2-D-gal处理HK2细胞时,可以明显抑制HK2细胞发生EMT,表明CsA可以直接诱导HK2细胞发生EMT,同时伴有末端岩藻糖基化的上调,当2-D-gal抑制末端岩藻糖基化后,可以抑制CsA诱导的EMT。
综上所述,CsA在体内和体外均可诱导EMT发生,并且伴有末端岩藻糖基化水平增加。2-D-gal可以通过抑制末端岩藻糖基化来抑制体内CsA诱导的肾脏EMT及体外CsA诱导的HK2细胞EMT。2-D-gal有可能成为潜在的抗肾脏纤维化的治疗药物,值得深入研究。

