脂多糖反式激活表皮生长因子受体诱导子宫内膜癌增殖和环氧化酶⁃2表达
张学术,张加盟,曹淑新,李翠,宋智慧
1.唐山市妇幼保健院妇科门诊,河北唐山 063000;2.唐山市妇幼保健院优生遗传科,河北唐山 063000;3.唐山市妇幼保健院产科,河北唐山 063000
子宫内膜癌发病率与人口老龄化相关,主要见于围绝经期和绝经后女性,是最常见的女性生殖系统肿瘤之一[1]。有报道[2]证实,当宫颈局部天然屏障功能被破坏,细菌可逆行进入宫腔,形成局部高感染状态,引起炎症发生,促进子宫内膜癌进展,细菌特定的成分和产物对子宫内膜癌的进展有正向或负向的调节作用。细菌、病毒感染可迅速上调环氧化酶⁃2 和前列腺素E2 水平,进而激发炎症[3⁃4]。并且,二者在子宫内膜癌组织高表达,提示同子宫内膜癌的发生发展相关[5⁃6],COX⁃2 抑制剂也在子宫内膜癌治疗中显示出临床效果[7⁃8]。目前,细菌感染对子宫内膜癌生长及COX⁃2 表达影响的研究较为缺乏。本文观察人子宫内膜癌细胞株在脂多糖刺激下的细胞生长增殖及炎症因子COX⁃2 水平变化,探讨其潜在机制。
1 材料与方法
1.1 细胞培养
人子宫内膜癌RL95⁃2 细胞株采购于上海富衡生物,培养于含10%胎牛血清(Gibco)、 100 μg/mL青霉素、100 μg/mL 链霉素、 0.005 mg/mL 胰岛素、1 ×GlutaMAXTM(Invitrogen)的DMEM/F12 培养液(Invitrogen)中,37 ℃、5% CO2饱和湿度培养。
1.2 脂多糖、单抗和抑制剂的加药处理和分组
用胰蛋白酶消化RL95⁃2 细胞,按照4 ×104/孔密度接种于96 孔培养板(Corning),每孔100 μL 培养体系,细胞过夜贴壁后,加入各种药物处理。处理方式如下:采用0~50 μg/mL 脂多糖(L4391,Sigma)刺激细胞24 h,以确定最适浓度;采用5 μg/mL 脂多糖刺激细胞0~72 h,以确定最适孵育时间,上述实验均设立不做任何处理的control 组。
干预实验中,将RL95⁃2 细胞随机分为5 组: control组、 LPS 组、 LPS +CD14 mAb 组、 LPS +TAK⁃242 组、LPS +cetuximab 组。control 组:不做任何处理;LPS 组:5 μg/mL LPS 刺激细胞24 h;LPS +CD14 mAb 组:5 μg/mL LPS 和10 μg/mL CD14 mAb(MAB3832,R&D Systems)联合干预24 h;LPS +TAK⁃242 组:5 μg/mL LPS 和10 nm`ol/L TAK⁃242(614316,Sig⁃ma)联合干预24 h;LPS +cetuximab 组:5 μg/mL LPS和10 μg/mL cetuximab(C225,MedChemExpress)联合干预24 h。收集细胞或上清液进行后续检测。
1.3 MTT 法检测细胞增殖活力[9]
根据实验要求用不同药物处理细胞24 h 后,更换为含有0.5 mg/mL MTT 试剂(Sigma)的完全培养液,继续于37 ℃孵育培养4 h,小心吸弃上清液,加入100 μL二甲亚砜,避光水平震摇3 min,490 nm 波长读取吸光度值。
1.4 qRT⁃PCR 检测Ki⁃67 和COX⁃2 基因水平[10]
如收集各组样品,裂解细胞、提取总RNA(Bio⁃sharp)。cDNA 由逆转录试剂盒(Qiagen)获得。qRT⁃PCR 检测各基因表达,β⁃actin 作为管 家基因,在ABI7500 实时定量PCR 系统上操作,扩增程序为:95 ℃预变性10 min;然后95 ℃变性15 s、 55 ℃退火延伸50 s,40 个循环;最后72 ℃延伸10 min。Ki⁃67 引物序列:正向为5′⁃AGAAGACAGTACCGCAGATGA⁃3′,反向为5′⁃CGGCTCACTAATTTAACGCTGG⁃3′。COX⁃2 引物序列:正向为5′⁃TGAGCATCTACGGTTTGCTG⁃3′,反向为5′⁃AACTGCTCATCACCCCATTC⁃3′。β⁃actin 引物序列:正向为5′⁃GCA CCA CAC CTT CTA CAA TG⁃3′,反向为5′⁃ TGC TTG CTG ATC CAC ATC TG ⁃3′。根据荧光定量的标准曲线分析获得循环阈值(Ct 值),以2⁃ΔΔCt法和control 组计算目标基因的相对表达量。
1.5 ELISA 检测PGE2 浓度[11]
细胞经不同药物处理后,每孔用PBS(Invitrogen)清洗细胞2 次,然后更换为含有1% 胎牛血清、5 μmol/L花生四烯酸(10931,Sigma)的DMEM/F12培养液。孵育8 h 后收集细胞上清液,离心后留取上清液,于-80 ℃冰箱保存。PGE2 浓度用ELISA 试剂盒一次性检测。
1.6 统计学分析
应用SPSS 18.0 统计软件包进行统计分析。所有试验数据采用均数± 标准差表示,多个样本均数用单因数方差分析(one way ANOVA),样本均数间两两比较用Tukey 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 脂多糖对RL95⁃2 细胞株增殖的影响
首先,检测脂多糖对人子宫内膜癌细胞株增殖的影响,经24 h 培养后,在0 ~25 μg/mL 浓度范围内,随着脂多糖浓度的增加,RL95⁃2 细胞的生长逐渐增加,表明脂多糖刺激RL95⁃2 细胞的增殖呈剂量依赖关系;当浓度为50 μg/mL 时,RL95⁃2 细胞生长下降,表明该浓度的脂多糖具有毒性效应。见图1。
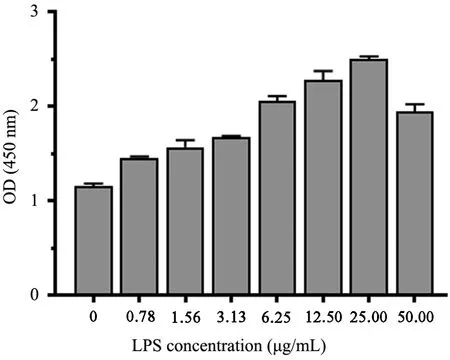
图1 不同浓度LPS 对RL95⁃2 细胞增殖率的影响
用5 μg/mL 的脂多糖处理RL95⁃2 细胞,0~72 h内分别取样,检测细胞增殖。Control 组细胞随着培养时间延长,在72 h 内,RL95⁃2 细胞持续生长;加入脂多糖后,0~48 h 内RL95⁃2 细胞持续生长,第72 h 时显示了对细胞的毒性效应,表明脂多糖刺激的RL95⁃2细胞增殖呈时间依赖关系。见图2。
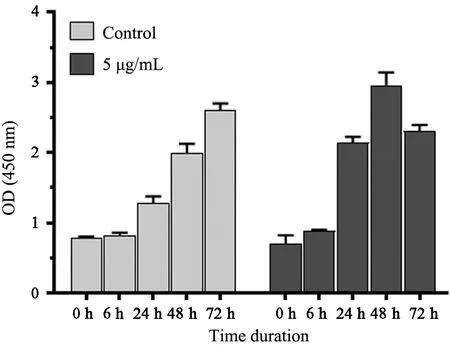
图2 5 μg/mL LPS 作用不同时间对RL95⁃2 细胞增殖率的影响
由于5 μg/mL 脂多糖刺激RL95⁃2 细胞24 h,处于细胞的线性增殖区间,因此该刺激剂量和时间被用于后续实验。
2.2 脂多糖对RL95⁃2 细胞株Ki⁃67 基因水平的影响
Ki⁃67 为增殖标志物。相比于control 组,RL95⁃2细胞经5 μg/mL 脂多糖刺激24 h 后,Ki⁃67 mRNA 表达水平明显升高,是control 组的(3.42 ±0.33)倍。见图3。
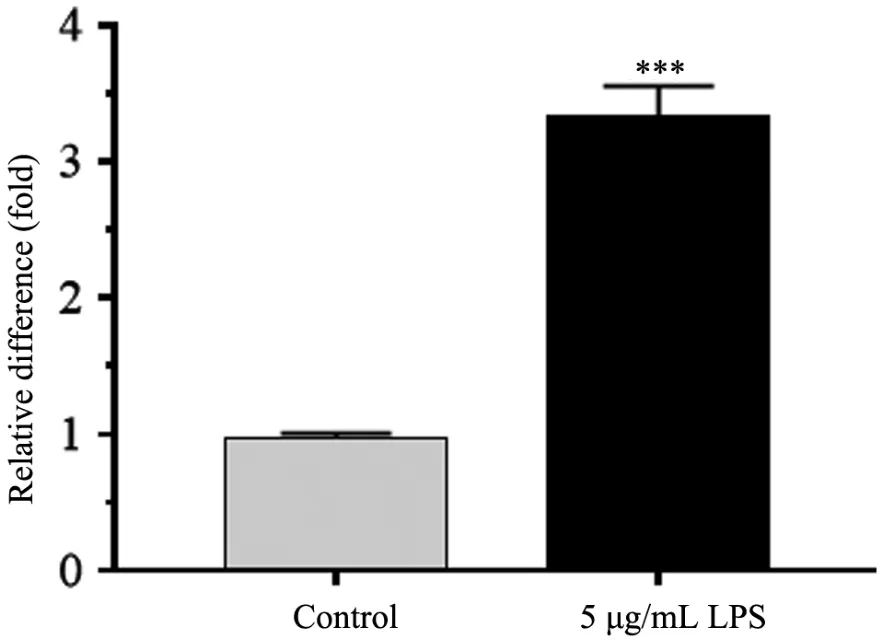
图3 5 μg/mL LPS 对RL95⁃2 细胞Ki⁃67 mRNA 表达的影响
2.3 CD14、TLR⁃4 和EGFR 对脂多糖刺激RL95⁃2 细胞增殖的影响
5 μg/mL 脂多糖作用RL95⁃2 细胞的同时,加入10 μg/mL CD14 单抗(CD14 抑制剂)、 10 nmol/L TAK⁃242 (TLR⁃4 特异性抑制剂)或10 μg/mL cetux⁃imab (EGFR 抑制剂),24 h 后检测细胞增殖,可见脂多糖刺激的细胞生长被全部抑制,同control 组相比,差异无统计学意义(P>0.05)。见图4。
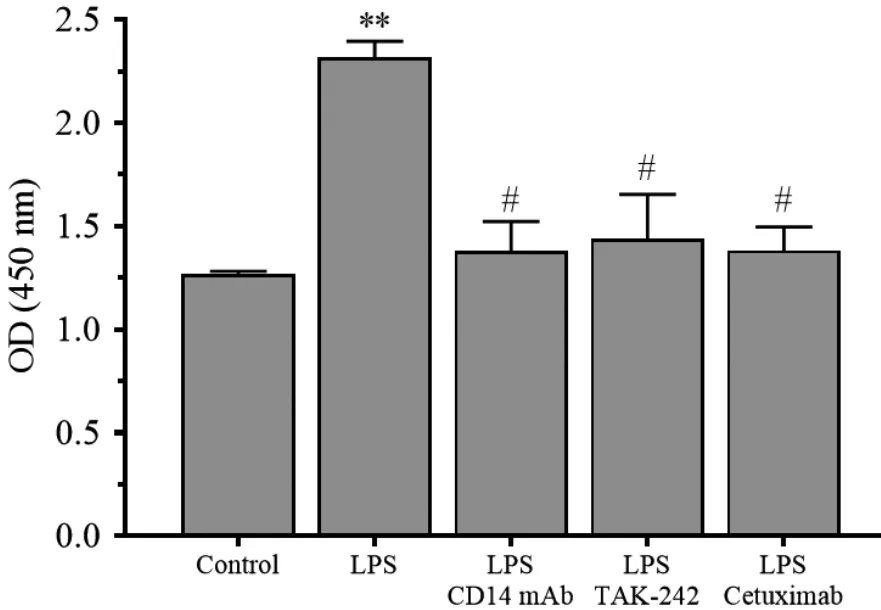
图4 CD14 mAb、 TAK⁃242、 cetuximab 对LPS 刺激RL95⁃2 细胞增殖的干预作用
2.4 CD14、 TLR⁃4 和EGFR 对COX⁃2 表达的影响
相比于control 组,RL95⁃2 细胞经5 μg/mL 脂多糖刺激24 h 后,COX⁃2 mRNA 表达水平明显升高,是control 组的(3.82 ± 0.61)倍;然而经CD14 单抗、TAK⁃242、 cetuximab 同时处理后,COX⁃2 mRNA 表达水平分别下降到(1.24 ±0.01)倍、 (1.14 ±0.06)倍、(1.18 ±0.15)倍,同control 组相比,差异无统计学意义(P>0.05)。见图5。
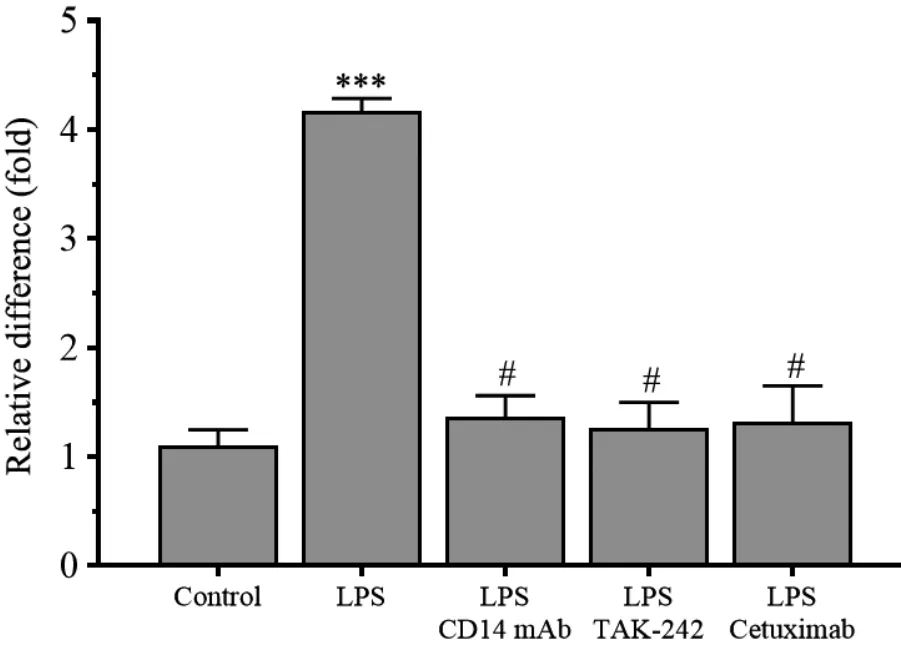
图5 CD14 mAb、 TAK⁃242、 cetuximab 对LPS 刺激RL95⁃2 细胞COX⁃2 mRNA 表达的干预作用
2.5 脂多糖对RL95⁃2 细胞株分泌PGE2 的影响
在control 组中,随着RL95⁃2 细胞培养时间延长,PGE2 分泌量逐渐增加;加入5 μg/mL 的脂多糖后,0~48 h 内,PGE2 分泌量逐渐增加,第72 h 时,PGE2分泌降低,且均明显高于control 同时间处理组(P<0.05),图6结果表明脂多糖升高了RL95⁃2 细胞分泌PGE2 的水平,且呈时间依赖关系。
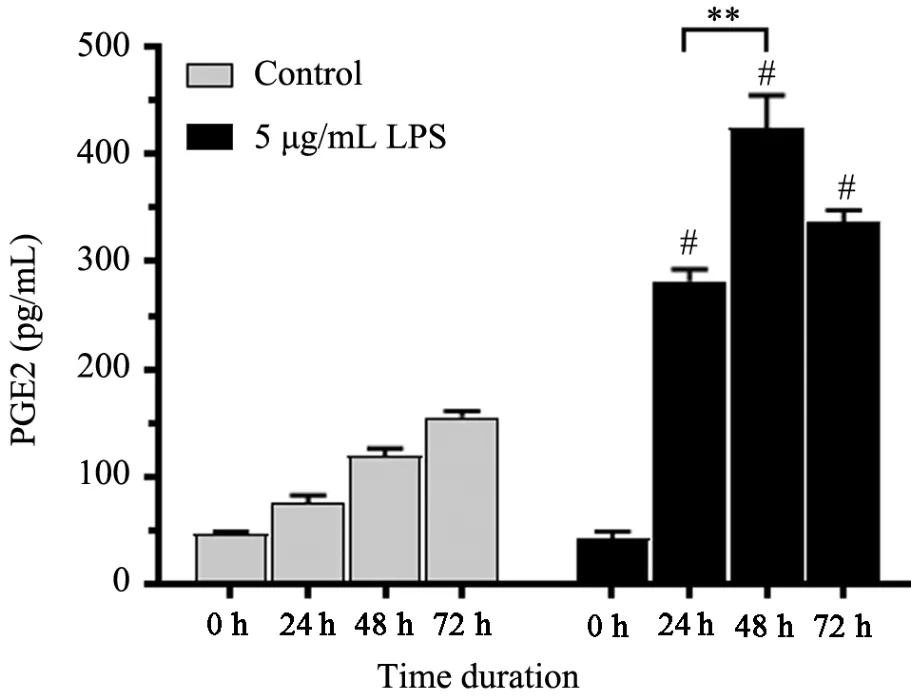
图6 5 μg/mL LPS 作用不同时间对RL95⁃2 细胞PGE 表达的影响
由于5 μg/mL 脂多糖刺激RL95⁃2 细胞24 h,处于PGE2 分泌的线性区间,因此该刺激浓度和时间被用于后续实验。
2.6 CD14、 TLR⁃4 和EGFR 对PGE2 分泌的影响
图7显示,相比于control 组,5 μg/mL 脂多糖诱导RL95⁃2 细胞分泌PGE2 水平显著升高,从(76.55±7.20)pg/mL 升高到(271.99 ±24.66)pg/mL(P<0.01),然而经CD14 单抗、 TAK⁃242、 cetuximab 同时处理后,PGE2 分泌水平分别下降到(118.42 ±10.74)pg/mL、(107.45 ±30.89)pg/mL、 (113.42 ±23.49)pg/mL,同脂多糖组相比,差异有统计学意义(P<0.01),同control 组相比,差异无统计学意义(P>0.05)。
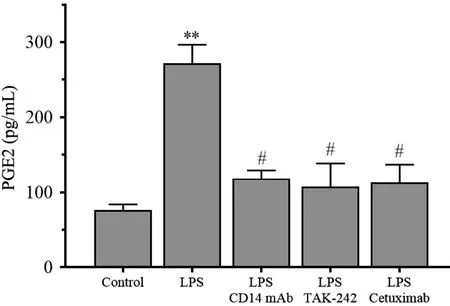
图7 CD14 mAb、 TAK⁃242、 cetuximab 对LPS 刺激RL95⁃2 细胞PGE 表达的干预作用
3 讨论
子宫内膜癌以55 ~65 岁女性之间发病居多,与年龄具有相关性,本研究可能为老年患者子宫内膜癌的炎症研究提供参考性的实验依据。在脂多糖刺激下,促进RL95⁃2 细胞增殖,上调Ki⁃67 mRNA、COX⁃2 mRNA表达和PGE2 分泌,CD14 中和抗体、 TLR⁃4抑制剂和EGFR 抑制剂降低了COX⁃2/PGE2 信号活化和细胞增殖。研究证实,脂多糖通过LPS/TLR⁃4 信号通路、 EGFR 信号通路调控COX⁃2/PGE2 信号通路,促进子宫内膜癌细胞生长。
脂多糖是革兰氏阴性菌细胞壁上的主要成分,通过启动生物体的多种炎症反应,在细菌感染和癌症演化中发挥重要作用。研究证实,子宫内膜癌组织中细菌培养阳性率高于正常子宫内膜组织,并且发现污泥单胞菌和普氏菌在高肿瘤负荷的子宫内膜癌中富集[12],炎症因子IL⁃6、 IL⁃11 阳性表达升高,提示感染及炎症因子可能参与了子宫内膜癌的发病过程,癌组织中的细菌影响癌症发展,可能与治疗效果有关[2]。CD14 和TLR4 是人体细胞识别脂多糖和脂多糖启动炎症发生的重要受体。细胞膜表面的CD14 蛋白结合脂多糖并将其转运至跨膜蛋白TLR4 的胞外基团,引起TLR4 胞内基团的构象变化,将信号传递到细胞内部,引起扩大的下游信号瀑布[13]。临床研究也显示,TLR4 主要定位于腺上皮和腔上皮,存在于子宫内膜树突状细胞、单核细胞和巨噬细胞上,子宫内膜异位症中TLR4 mRNA 表达显著增加[14]。本研究发现,脂多糖促进了人子宫内膜癌细胞株RL95⁃2 的增殖,抑制CD14 和TLR4 活性后,可以完全抑制RL95⁃2 细胞增殖。本研究的结果表明,脂多糖激活TLR4 胞内信号的进程是脂多糖诱导RL95⁃2 细胞增殖的初始步骤。
与结构性环氧化酶COX⁃1 不同的是,COX⁃2 是诱导型环氧化酶,生理状态下,在绝大部分组织和细胞中不表达,仅在受到各种刺激后迅速合成,参与炎症和肿瘤的病理过程[15]。这一过程中,COX⁃2 作为花生四稀酸代谢的限速酶,合成各种具有炎性递质作用的前列腺素产物,其中主要的代谢产物为PGE2。PGE2 作为重要的递质,密切参与生长、炎症、组织修复等过程。在多种组织和细胞中均发现,COX⁃2 和PGE2 水平可经脂多糖刺激后上调,并且有研究报道,子宫内膜癌组织含有高水平的COX⁃2 和PGE2[16⁃17]。本实验发现,脂多糖诱导RL95⁃2 细胞24 h 后,COX⁃2 mRNA 表达及PGE2 分泌增加,然而,抑制脂多糖识别受体CD14 和TLR4 活性后,可以完全干预COX⁃2 mRNA 表达和PGE2 分泌,表明COX⁃2/PGE2 信号依赖于LPS/TLR4 信号通路激活。本研究同时发现,脂多糖刺激和TLR4 信号干扰对COX⁃2 mRNA、 PGE2、细胞增殖的反应表现一致,由此推测,脂多糖引起的RL95⁃2 细胞增殖中,LPS/TLR4 信号通路依赖的COX⁃2/PGE2 发挥关键作用。
有趣的是,本实验发现干预EGFR 也可完全抑制脂多糖诱导的RL95⁃2 细胞增殖、COX⁃2 mRNA 表达和PGE2 分泌。EGFR 是子宫内膜癌治疗中极为重要的靶点,是由胞外配体结合域、跨膜亲脂区域和胞内酪氨酸激酶结构域组合成的跨膜蛋白。2 个EGFR 单体同多种配体结合后,形成有酪氨酸激酶活性的二聚体,对细胞内众多的信号分子进行磷酸化,促进细胞增殖、分化、迁移。目前已知EGFR 二聚体下游的信号级联通路PI3K/AKT、RAS/RAF/MEK/ERK、p38MAPK,甚至JAK/STAT 均可能诱导COX⁃2 表达。本研究采用的cetuximab 是识别EGFR 胞外配体结合域,阻止EGFR 二聚体的干扰抑制剂,实验结果显示,干预EG⁃FR 二聚体形成可以完全抑制COX⁃2/PGE2 产生,表明COX⁃2/PGE2 的产生依赖于EGFR 活化,然而本实验的前期结果同样表明COX⁃2/PGE2 激活也依赖于LPS/TLR4 信号通路,由此推测位于初始环节的LPS/TLR4 信号可能对EGFR 及其下游通路有活化作用,从而激活COX⁃2/PGE2。有研究报道,肠上皮细胞中存在脂多糖对EGFR 的反式激活,TLR4 激活后,通过Src 家族激酶的信号传递和基质金属蛋白酶的参与,反式激活EGFR,再经由EGFR 下游RAS/RAF/MEK/ERK 信号调节COX⁃2 表达[18]。Holani 等[19]研究者在结肠上皮细胞内也证实TLR4 信号通路和EGFR 信号通路之间存在交叉作用,TLR4 通过Src 激活EGFR,调控EGFR 依赖性的信号传递过程。此外,TLR4 也可能通过PGE2 反式激活EGFR,研究发现在干细胞隐窝分裂进程中,透明质酸结合TLR4,刺激下游COX⁃2/PGE2 发生,PGE2 再进一步激活EGFR[20⁃21]。本实验结果表明,EGFR 的反式激活是LPS/TLR4 信号通路活化COX⁃2 和PGE2 的关键环节,提示EGFR 抑制剂可能在感染引起的子宫内膜癌细胞生长方面有抑制效应。
子宫内膜癌临床被区分为2 种类型,Ⅰ型为雌激素依赖型,确诊时常为早期,全子宫切除后大多可自治愈,Ⅱ型为非雌激素依赖型,确诊时多属晚期,恶性程度高,易复发,影响预后的因素多为肿瘤细胞的侵袭转移能力。本研究选取雌激素受体阳性的子宫内膜癌细胞株RL95⁃2 进行研究,无法完全代表2种类型的子宫内膜癌,在未来的研究中,需对比EGFR 抑制剂处理雌激素依赖和非依赖性型子宫内膜癌细胞的抑制作用差异。此外,本研究未全面验证EGFR 抑制剂对EGFR 表达的影响,仍需在未来工作中补充和完善。
综上所述,脂多糖可诱导子宫内膜癌细胞的体外增殖,LPS/TLR4 信 号 通 路、 EGFR 活 化、 COX⁃2/PGE2 信号通路参与了该病理进程,炎症递质COX⁃2和PGE2 的水平上调依赖于TLR4 对EGFR 的反式激活。本研究从体外细胞水平上,提示EGFR 抑制剂可能在感染促进的子宫内膜癌发展中有控制作用,为子宫内膜癌并发感染的治疗及联合用药方面提供证据,然而,各信号通路之间的激活和串扰仍需在体内动物水平上进行验证,以阐述信号通路之间的复杂联系。

